注射用益气复脉(冻干)对脓毒症诱导小鼠急性肺损伤的改善作用研究∗
2021-07-30潘雪薇薛漓轩张佳智代玉洁张媛媛寇俊萍
潘雪薇 薛漓轩 张佳智 代玉洁 李 芳 张媛媛 寇俊萍 △
(1.中国药科大学,江苏 南京 211198;2.江苏省中药评价与转化重点实验室,江苏 南京211198)
急性肺损伤(ALI)是由脓毒症、肺炎、创伤、急性胰腺炎等因素引起的临床危重病,死亡率高达35%~40%,以急性、弥漫性和炎性肺部损伤为特点,主要表现为肺泡毛细血管通透性增加,血管渗漏,引起肺部水肿甚至严重的低氧血症[1]。脓毒症是感染引起的宿主反应失调所致的致命性器官功能障碍[2],在脓毒症引起的多器官功能损伤过程中,最先受到打击的器官是肺,同时,ALI又是引起脓毒症患者器官功能衰竭和死亡的独立危险因素[3]。因此,改善ALI是脓毒症治疗的重要治疗方向。近年来中医药的发展为脓毒症急性肺损伤治疗提供了新的突破口。中药在降低炎性指标、清除氧自由基和维持机体平衡方面显示出一定的优势,部分清热解毒、活血化瘀、通里攻下和补益类中药复方或单味中药对脓毒症诱导的急性肺损伤显示出明显的改善效果[4]。注射用益气复脉(冻干)是经典名方“生脉散”经现代化工艺提取和制备的冻干粉针剂,主要用于治疗气阴两虚型心绞痛与心功能不全[5]。临床实验结果表明,脓毒症患者在早期目标导向治疗外静脉滴注益气复脉可显著改善器官组织低灌注和组织缺血,调节氧代谢,降低脓毒症患者死亡率[6]。此外,前期研究证明益气复脉(冻干)可以改善血管内皮屏障功能障碍及气管滴注脂多糖或细颗粒引起的ALI[7-8],但其是否可以改善脓毒症诱导的ALI尚不清楚。因此,本研究从肺微血管内皮屏障功能损伤的角度出发,考察了益气复脉(冻干)对脓毒症所致小鼠ALI的改善作用,为其临床用于脓毒症ALI的防治提供一定实验基础和参考依据。
1 材料与方法
1.1 实验动物 雄性C57BL/6J小鼠18~22 g,共210只,由扬州大学比较医学中心提供,动物许可证号:SCXK(苏)2017-0007。所有动物饲养于相对湿度40%~60%,室温24~26℃,12 h昼夜交替的SPF级动物实验房中。
1.2 药物与仪器 注射用益气复脉(冻干)(天津天士力天之骄药业有限公司,批号:20170311);地塞米松(Biosharp生物科技公司,批号:BS134B);伊文思蓝(美国Sigma公司,批号:E2129);TLR4抗体、VE-cadherin抗体(美国Santa Cruz公司,批号分别为sc-293072、sc-9989);p120-catenin抗体(美国Abcam公司,批号:ab92514);P-Src(Y416)抗体、Src抗体(美国CST公司,批号分别为6943S、2108S),髓过氧化物酶(MPO)试剂盒(南京建成生物工程研究所,批号:A044-1-1)。NanoZoomer 2.0 RS型数码病理切片扫描仪(日本Hamamatsu公司);Infinite 200Pro酶标仪(瑞士Tecan公司);1645050型湿法电转膜仪(美国Bio-Rad公司);冰冻切片机(德国Leica公司);LSM 700激光共聚焦显微镜(德国Zeiss公司)。
1.3 分组与给药 适应性饲养3~5 d后将小鼠随机分为6组(每组35只):假手术组、模型组、益气复脉低剂量组(1 g/kg)、益气复脉中剂量组(2 g/kg)、益气复脉高剂量组(4 g/kg)和地塞米松组(5 mg/kg)。各组小鼠于造模前禁食12 h,各给药组尾静脉注射相应剂量药物,假手术组和模型组注射等体积(0.1 mL/10 g)生理盐水。
1.4 模型制备 各组小鼠药物干预后1 min立即进行盲肠结扎再穿孔(CLP)造模,腹腔注射4%的水合氯醛麻醉,固定于手术台上,剃去腹毛。沿小鼠腹白线剪开约1 cm,分离表皮和肌层,在腹腔中钝性分离盲肠和肠系膜,用5-0缝合线在盲肠全长75%处结扎。用16号针头在盲肠末端以上由肠系膜侧向非肠系膜侧贯穿盲肠2次,避开血管,从针孔的两端挤出少量肠内容物,将盲肠放回腹腔,尽量避免肠内容物黏附在手术切口,逐层缝合关腹,碘酒消毒伤口后,将小鼠放入装有干净垫料且可自由饮食的鼠笼中。假手术组只开关腹,不结扎和穿孔盲肠,手术过程中使用恒温毯维持小鼠肛温37℃。
1.5 标本采集与检测 1)HE染色检测肺组织病理形态学变化。造模后18 h,每组取3只小鼠处死,取左上叶肺组织,4%多聚甲醛固定,经石蜡包埋,切片染色,数字病理切片扫描仪扫描切片。剩余肺组织用于Western blotting及免疫荧光实验。2)肺组织湿重/干重比测定。每组取8只小鼠,取肺部组织并精确测定质量,记为肺湿重,再将肺组织置于120℃的烘箱中烘干48 h后测定质量,为肺干重,计算肺湿重/干重比以确定肺组织水肿程度。3)肺泡灌洗液(BALF)检测。每组取8只动物,剥离小鼠气管,用4号针头注射器对肺泡进行灌洗,用500 μL磷酸盐缓冲液(PBS)灌洗3次,回收的BALF(4℃,1 500 r/min离心5 min)离心后弃去上清液,用800 μL PBS重悬沉淀后检测。4)MPO含量测定。每组取8只小鼠,采集血浆、肺泡灌洗液及肺组织匀浆,严格按照MPO试剂盒测定说明书进行实验操作。5)伊文思蓝(EB)检测肺微血管通透性。每组取8只动物,造模16 h后,尾静脉注射EB溶液(50 mg/kg),2 h后麻醉小鼠,用生理盐水从小鼠心脏处灌注,取肺、拍照、吸干多余水分、称重。每100 mg肺组织加入1 mL甲酰胺进行匀浆,60℃孵育18 h,5 000g离心30 min后取上清,于620 nm波长下测定,按标曲计算EB渗漏量。6)Western blotting法检测肺组织中蛋白表达。造模18 h后提取肺组织蛋白,定量后采用SDS-PAGE凝胶电泳,200 mA湿法转膜,用5% BSA封闭2 h,4℃孵育一抗过夜,室温孵育二抗1.5 h后使用增强型化学发光液显影,通过凝胶成像仪拍照,分析蛋白表达水平。7)免疫荧光法检测肺组织切片相关蛋白表达。取肺组织于4%多聚甲醛中固定24 h,40%蔗糖溶液脱水至组织沉底。将脱水后的组织用OCT胶固定在包埋盒中,去除气泡后,于冰冻切片机内速冻并切片(厚8 μm),吸附于黏附载玻片上。将肺组织切片用PBS浸洗3次,每次5 min,封闭液(5% BSA、0.2% Triton X-100的PBS)室温封闭1 h,4℃孵育一抗过夜。PBS浸洗后室温孵育二抗1.5 h,PBS浸洗后用DAPI染色5 min,PBS浸洗后滴加少量抗荧光猝灭封片液,盖玻片封片,激光共聚焦观察拍照。
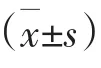
2 结 果
2.1 各组脓毒症诱导的ALI小鼠肺组织病理形态观察 结果显示,与假手术组比较,模型组小鼠肺泡坍塌,肺泡壁充血并伴有炎性细胞浸润,肺部血管水肿,气管周围有轻度炎症,而益气复脉和地塞米松能不同程度地改善小鼠肺组织病理学损伤。见图1。
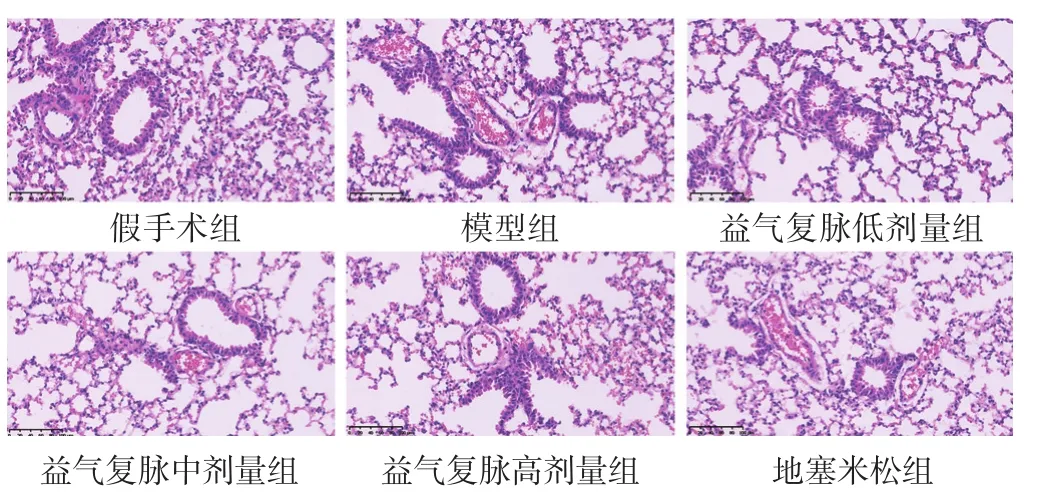
图1 各组脓毒症诱导的ALI小鼠肺组织病理形态(HE染色,100倍)
2.2 各组脓毒症诱导的ALI小鼠肺水肿情况比较见表1。相比于假手术组,模型组小鼠肺组织湿干重比显著升高(P<0.01),提示肺部水肿严重,低、中、高剂量益气复脉组小鼠的肺湿干重比均较模型组有所降低。经统计,与模型组相比,益气复脉低、中剂量组可以显著降低脓毒症引起的小鼠肺部水肿(P<0.05或P<0.01),其中益气复脉中剂量组改善作用最显著。
表1 各组脓毒症诱导的ALI小鼠肺水肿情况比较(±s)

表1 各组脓毒症诱导的ALI小鼠肺水肿情况比较(±s)
注:与模型组比较,∗P<0.05,∗∗P<0.01;与益气复脉低剂量组比较,$P<0.05,$$P<0.01;与益气复脉中剂量组比较,&P<0.05,&&P<0.01;与地塞米松组比较,△P<0.05,△△P<0.01。下同。
组别假手术组模型组益气复脉低剂量组益气复脉中剂量组益气复脉高剂量组地塞米松组n 8 8 8 8 8 8肺湿重/干重比4.79±0.21**5.59±0.14 5.23±0.29*&△△4.87±0.14**$△△5.29±0.17&&△5.67±0.34$$&&EB渗漏量(μg/g)33.50±4.80**77.87±8.44 35.21±5.72**31.91±2.43**39.47±7.41**51.33±8.78**
2.3 各组脓毒症诱导的ALI小鼠BALF中细胞数目比较 见表2。与假手术组相比,模型组小鼠BALF中白细胞、中性粒细胞和淋巴细胞数目均显著增加(P<0.05或P<0.01);与模型组比较,益气复脉中、高剂量组和地塞米松组BALF中白细胞数目显著降低(P<0.01),其中益气复脉中剂量组可以显著抑制肺微血管中白细胞、中性粒细胞和淋巴细胞渗漏到肺泡腔(P<0.05)。
表2 各组脓毒症诱导的ALI小鼠BALF中细胞数目比较(×104个±s)
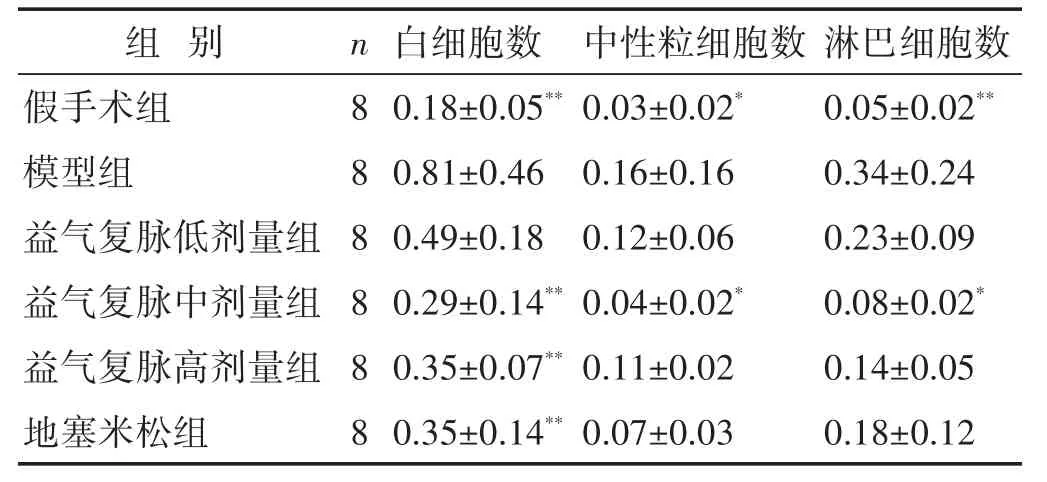
表2 各组脓毒症诱导的ALI小鼠BALF中细胞数目比较(×104个±s)
组别假手术组模型组益气复脉低剂量组益气复脉中剂量组益气复脉高剂量组地塞米松组n888888白细胞数0.18±0.05**0.81±0.46 0.49±0.18 0.29±0.14**0.35±0.07**0.35±0.14**中性粒细胞数0.03±0.02*0.16±0.16 0.12±0.06 0.04±0.02*0.11±0.02 0.07±0.03淋巴细胞数0.05±0.02**0.34±0.24 0.23±0.09 0.08±0.02*0.14±0.05 0.18±0.12
2.4 各组脓毒症诱导的ALI小鼠肺组织匀浆、BALF和血浆中MPO活力的比较 见表3。相比于假手术组,模型组小鼠肺组织匀浆、BALF和血浆中MPO活力均显著增强(P<0.01),益气复脉低、中剂量组和地塞米松组均可显著抑制脓毒症诱导ALI小鼠肺组织、BALF和血浆中MPO活力的增加(P<0.05或P<0.01),益气复脉高剂量组可显著降低脓毒症诱导ALI小鼠BALF和血浆中MPO的活力(P<0.01)。
表3 各组脓毒症诱导的ALI小鼠肺组织匀浆、BALF和血浆中MPO活力的比较(±s)
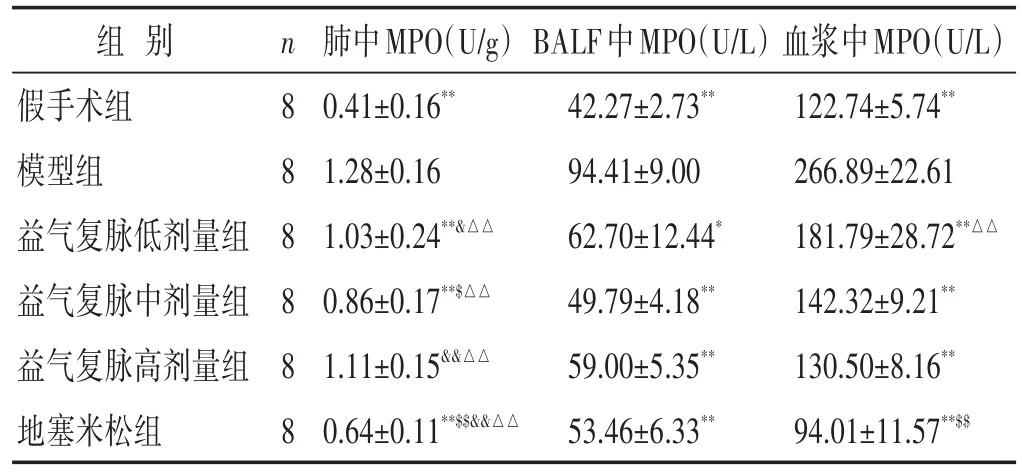
表3 各组脓毒症诱导的ALI小鼠肺组织匀浆、BALF和血浆中MPO活力的比较(±s)
组别假手术组模型组益气复脉低剂量组益气复脉中剂量组益气复脉高剂量组地塞米松组n 8 8 8 8 8 8肺中MPO(U/g)0.41±0.16**1.28±0.16 1.03±0.24**&△△0.86±0.17**$△△1.11±0.15&&△△0.64±0.11**$$&&△△BALF中MPO(U/L)42.27±2.73**94.41±9.00 62.70±12.44*49.79±4.18**59.00±5.35**53.46±6.33**血浆中MPO(U/L)122.74±5.74**266.89±22.61 181.79±28.72**△△142.32±9.21**130.50±8.16**94.01±11.57**$$
2.5 各组脓毒症诱导的ALI小鼠肺组织EB渗漏程度的比较 见图2,表1。脓毒症诱导小鼠急性肺损伤后肺组织EB渗漏明显(P<0.01),益气复脉各剂量组及地塞米松组均能显著降低小鼠EB渗漏情况(P<0.01),中剂量组效果最显著。结果提示益气复脉可以显著抑制脓毒症引起的小鼠肺微血管内皮屏障完整性的破坏,进而改善ALI。

图2 各组脓毒症诱导的ALI小鼠肺组织EB渗漏程度
2.6 各组脓毒症诱导的ALI小鼠肺组织中VE-cadherin和p120-catenin表达比较 见图3、图4和表4。上述实验结果表明,益气复脉中剂量组改善脓毒症诱导ALI的效果最佳,后续选取中剂量益气复脉进一步操作。模型组小鼠肺组织中VE-cadherin和p120-catenin蛋白表达显著降低(P<0.01),而益气复脉中剂量组可显著增加肺组织中VE-cadherin和p120-catenin的蛋白表达(P<0.05或P<0.01)。综上所述,益气复脉可能是通过抑制VE-cadherin和p120-catenin表达的下降,恢复黏附连接,改善脓毒症小鼠肺微血管内皮屏障功能,进而改善ALI。
表4 各组脓毒症诱导ALI小鼠肺组织中VE-cadherin和p120-catenin表达比较(±s)

表4 各组脓毒症诱导ALI小鼠肺组织中VE-cadherin和p120-catenin表达比较(±s)
组别假手术组模型组中剂量益气复脉组n 3 3 3 VE-cadherin/β-actin 1.00±0.11**0.31±0.21 0.82±0.22*p120-catenin/β-actin 1.00±0.10**0.12±0.07 0.94±0.21**
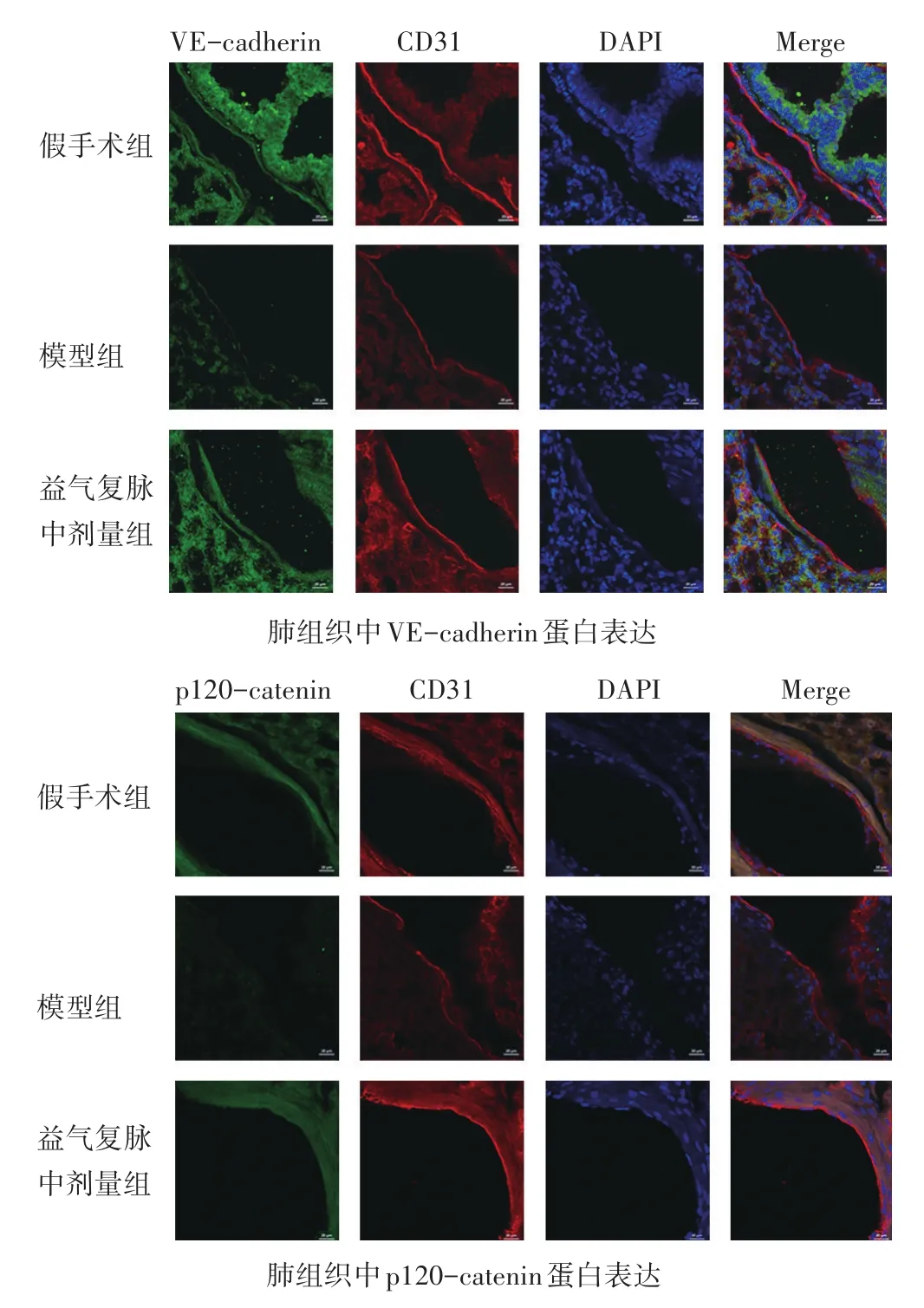
图3 各组脓毒症诱导ALI小鼠肺组织中VE-cadherin和p120-catenin表达的影响

图4 各组脓毒症诱导ALI小鼠肺组织中VE-cadherin和p120-catenin表达
2.7 各组脓毒症诱导ALI小鼠肺组织中Src磷酸化和TLR4表达的比较 见图5,表5。相比于假手术组,模型组小鼠肺组织中Src磷酸化水平和TLR4表达显著升高(P<0.01),中剂量益气复脉组可显著抑制脓毒症小鼠肺组织中Src磷酸化水平和TLR4表达水平(P<0.05)。
表5 各组脓毒症诱导ALI小鼠肺组织中Src磷酸化和TLR4表达比较(±s)

表5 各组脓毒症诱导ALI小鼠肺组织中Src磷酸化和TLR4表达比较(±s)
组别假手术组模型组益气复脉中剂量组n 3 3 3 p-Src/Src 1.00±0.12**2.62±0.72 1.28±0.37*TLR4/β-actin 1.00±0.20**2.06±0.38 1.12±0.27*
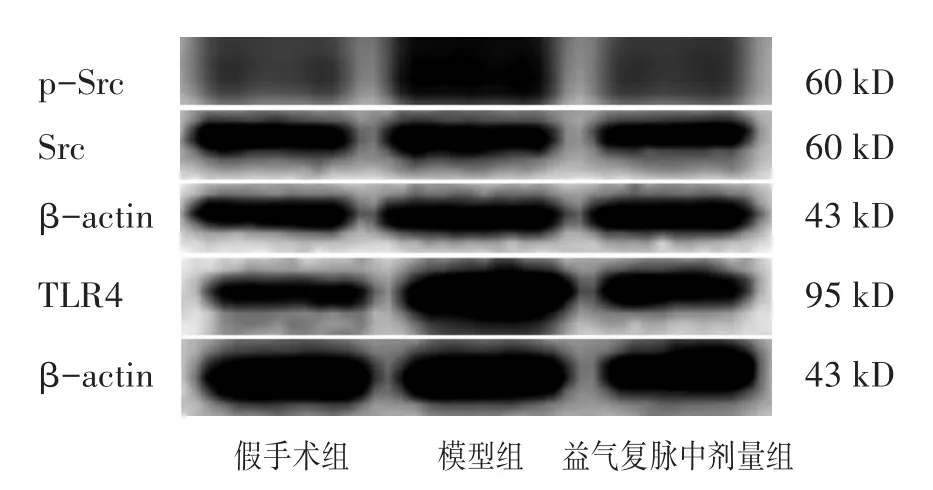
图5 各组脓毒症诱导ALI小鼠肺组织中Src磷酸化和TLR4的表达
3 讨 论
肺主气,司呼吸,且肺为娇脏,易受外邪侵扰,使肺失宣降功能,其通调水道功能也受到影响,膀胱气化不利,水液运行障碍,导致机体内水液积聚,形成水肿[9]。此外,临床上脓毒症患者皮下和体腔也通常会发生水肿,这也与中医理论“肺与大肠相表里”相符合[10]。脓毒症合并ALI患者全身内皮通透性的增加,引起的机体水肿会显著增加患者死亡率[11]。肺泡-毛细血管屏障完整性被破坏引起血管内皮弥漫性损伤,炎性细胞活化是ALI的基本病理特征,也是脓毒症引起的多器官功能损伤的重要环节[12]。因此,保护脓毒症中肺脏的功能,是治疗脓毒症合并ALI的重要治疗靶标。
益气复脉来自经典名方生脉散,由红参、麦冬、五味子3味药物组成,临床上常用来治疗冠心病心绞痛、慢性心衰等疾病,偶见用于慢性阻塞性肺疾病,改善中晚期肺癌患者生存质量[13]。其中红参为人参熟制品,味甘、微苦、性微温,归脾、肺、心、肾经,具大补元气、复脉固脱、补脾益肺等功效;麦冬味甘、微苦,性微寒,归心、肺、胃经,具滋阴生津、润肺清心之功效;五味子味酸、甘,性温,归肺、心、肾经,具收敛固涩、益气生津、补肾宁心之功效[14]。前期研究显示,益气复脉中多种有效成分均可以改善脓毒症及脓毒症相关的器官损伤[8]。然而,益气复脉对于脓毒症诱导的小鼠肺损伤的影响未见报道。
CLP模型是实验室复制脓毒症模型的金标准,是由腹部手术引起的创伤、盲肠结扎导致的组织坏死以及肠道内菌群的泄露引起的腹部感染。该模型操作简单,可重复性高,广泛应用于脓毒症的病理生理研究[15]。在ALI的发生发展过程中,炎症激活巨噬细胞,并将中性粒细胞招募至毛细血管来杀灭病原体,MPO会随中性粒细胞浸润释放到炎症部位[16]。此外,毛细血管内皮屏障被破坏导致了中性粒细胞从血管渗漏到肺泡腔,中心粒细胞的迁移和活化是ALI进程中与炎症反应和肺水肿相关的重要事件[17]。本文结果显示模型组小鼠肺组织病理形态损伤严重、炎性细胞及MPO水平升高、肺水肿及肺微血管内皮通透性显著增加,而益气复脉可显著改善小鼠肺组织病理损伤、减轻肺部炎症反应、降低肺水肿及内皮通透性,从而改善脓毒症诱导的小鼠肺损伤。
TLR4是一种Ⅰ型跨膜蛋白,可以识别高度保守病原相关分子,从而启动先天免疫反应和炎症[18]。据报道,TLR4信号通路的激活在病毒诱导的炎症反应和随后的细胞因子风暴中起着至关重要的作用,从而导致严重的ALI,急性呼吸窘迫综合征,MODS甚至死亡[19]。TLR4的激活可通过促进Src磷酸化,导致VE-cadherin和p120-catenin的酪氨酸磷酸化及降解,增加内皮通透性,引起肺毛细血管内皮细胞和肺泡上皮细胞的弥漫性损伤[20]。本文结果显示益气复脉可以通过抑制脓毒症模型诱导的TLR4的激活和Src的磷酸化,恢复肺血管内皮VE-cadherin和p120-catenin的表达,降低肺血管内皮通透性,进而抑制脓毒症引起的小鼠肺组织、BALF及血浆中MPO的活化以及炎性细胞浸润,改善肺病理学损伤及肺水肿,改善脓毒症诱导的小鼠ALI。
综上所述,益气复脉可能是通过调节TLR4/Src/VE-cadherin/p120-catenin信号通路,进而维持小鼠肺血管内皮屏障功能,改善脓毒症诱导的小鼠肺组织弥漫性损伤,抑制血管中炎症细胞渗漏到肺泡腔及肺组织中性粒细胞迁移浸润,进而改善ALI。提示益气复脉对于临床治疗脓毒症合并ALI的潜在可能性。但其具体如何调节肺血管内皮屏障功能,对于脓毒症引起的其他脏器损伤是否具有保护作用有待进一步研究。本研究结果为益气复脉临床应用于脓毒症或细菌、病毒引起的肺部疾病的防治提供了参考依据。
