血氧水平依赖磁共振成像评价肾脏铁过载的初步研究
2021-07-30耿薇薇沙圆圆王思齐邱建国
耿薇薇 孙 军 潘 靓 沙圆圆 王思齐 邱建国
铁是人体中最重要的微量元素之一,参与体内多种代谢途径。铁在人体内分布广泛,包括肝脏、心脏、肾脏等多种器官[1]。然而过量的铁通过一系列催化反应产生氧自由基,导致氧化应激和炎症,进而引起肾脏结构及功能的损伤[2]。MRI是目前无创评估机体铁含量的重要工具,利用、等对顺磁性物质铁的敏感性高的特性,来评价机体内的铁沉积[3],临床上主要应用于肝脏、心肌等部位,而对肾脏铁沉积的可行性评价较少。当组织内脱氧血红蛋白、含铁血黄素等顺磁性物质增多时会引起值的缩短、值(=1/)的增大。因此,血氧水平依赖成像(blood oxygen level-dependent,BOLD) 可通过值反映肾脏氧含量水平及组织铁沉积情况[4]。本研究拟建立兔肾脏铁过载模型,通过MR血氧水平依赖成像初步评价兔肾脏铁过载病理变化的可行性。
方 法
1.实验动物和模型建立
本研究经苏州大学附属第三临床医学院伦理委员会批准。选用纯种健康新西兰大白兔24只(苏州湖桥生物科技有限公司提供),体质量为2.0~2.5 kg,采用随机区组法分为对照组(n=12)和铁过载组(n=12)。铁过载组兔经后腿肌内一次注射60 mg/kg右旋糖酐铁(上海迈瑞尔化学技术有限公司)。对照组后腿肌内注射同等剂量0.9%生理盐水。实验兔肌内注射后单笼饲养12周,自由进食饮水。
2.MRI检查
所用仪器为Siemens Magnetom Verio 3.0 T磁共振扫描仪,采用8通道腹部线圈。由于右肾位置较高,右肾BOLD图像受呼吸运动及肠道气体等影响显著,所以本实验仅扫描左肾。2组实验兔分别于肌内注射后即刻(0周)及第12周行MRI扫描。检查前实验兔禁食禁水8 h。所有实验兔麻醉后取左侧卧位置于MR检查床上固定,置沙袋于腹部两侧。扫描范围从左肾上极至下极,轴位扫描定位线垂直左肾长轴,中心位于左肾门水平。
MRI扫描序列:①冠状位T2WI采用单次激发半傅里叶采集快速自旋回波(half acquisition single-shot turbo spin echo,HASTE)序列,重复时间(TR)/回波时间(TE)1400.0 ms/93.0 ms,视野(FOV)154 mm×219 mm,矩阵126×256,层厚3 mm,层间距0.9 mm,翻转角160°,带宽781 Hz/像素,扫描时间14 s。②轴位T2WI采用HASTE序列,TR/TE1 000.0 ms/108.0 ms,FOV130 mm×130 mm,矩阵179×256,层厚4 mm,层间距0 mm,翻转角138°,带宽199 Hz/像素,扫描时间98 s。③轴位BOLD,TR/TE 561 ms/11.2 ms;FOV130 mm×130 mm;矩阵218×256;层厚4 mm;层间距0.8 mm;翻转角20°;带宽331 Hz/像素;扫描时间737 s。BOLD扫描完成后工作站自动生成map。
3.图像分析
所有图像分析在Siemens Sygno工作站进行。由2名具有5年以上工作经验的泌尿系统影像诊断医师采用双盲法独立完成图像分析,如有不同意见则协商一致。对照轴位T2WI图像,选择左肾门水平map图像进行分析。由于内髓与肾盂及肾门结构无法区分,数据测量不稳定,因此未纳入本研究图像分析。参考T2WI,2名诊断医师沿皮质(cortex,CO)及外髓(outer medulla,OM)边缘勾画感兴趣区(region of interest,ROI)测量皮质及外髓的值,根据公式=1计算值,并计算外髓值(medullary,)与皮质值(cortical,)的比值(MCR=/)。
4.病理组织学检查
2组实验兔于肌内注射后第12周MR扫描后分别处死,取出左肾,用10%甲醛固定24 h取材,石蜡包埋,在垂直于左肾长轴的肾门水平切片,行HE染色、普鲁士蓝染色和Masson染色。在HE染色图上观察肾脏损伤情况,在普鲁士蓝染色图上观察铁分布情况(阳性呈蓝染),在Masson染色图上观察肾间质纤维化情况。
5.统计学分析
采用SPSS 19.0软件进行统计学分析。应用Shapiro-Wilk检验评价计量资料是否符合正态分布,若符合正态分布,则使用xˉ±s表示,若不符合正态分布,则用中位数(四分位间距)表示。采用Mann-WhitneyU检验比较肌内注射后0周及第12周对照组与铁过载组间值的差异;采用Wilcoxon检验分别比较对照组及铁过载组实验兔肌内注射后0周与第12周值的差异。P<0.05为差异有统计学意义。
结 果
1.MRI-BOLD图像表现
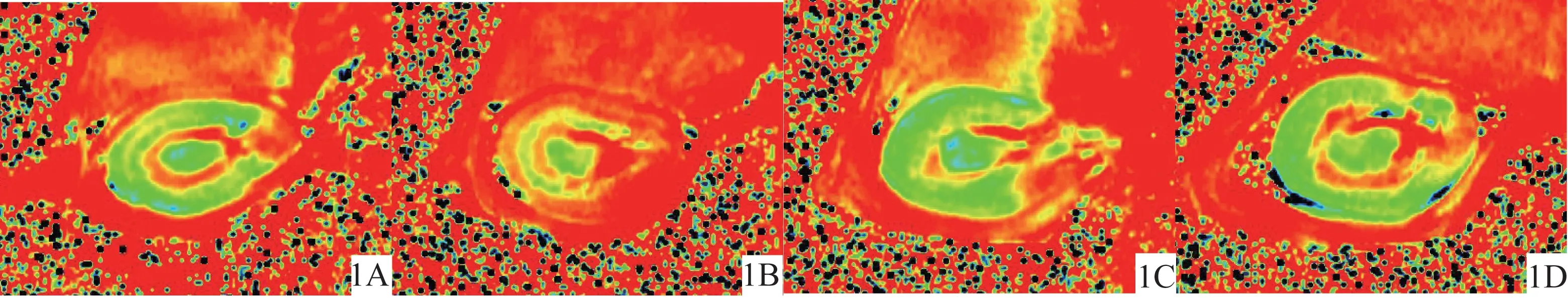
图1 铁过载组和对照组左肾血氧水平依赖(BOLD)图像
2.对照组及铁过载组值的差异
表1 对照组和铁过载组肾脏皮髓质值比较

表1 对照组和铁过载组肾脏皮髓质值比较
正态分布资料用xˉ±s表示,偏态分布资料用M(P25,P75)表示。
组别images/BZ_98_1547_1473_1591_1517.png值(0周)images/BZ_98_1547_1473_1591_1517.png值(12周)皮质 外髓MCR皮质 外髓MCR正常组22.54(20.12,25.32)29.82±2.361.32±0.0821.08±1.3128.89±1.421.37±0.08铁过载组23.49(21.41,25.19)30.35±1.721.30±0.0830.36±5.1433.57±4.881.12±0.13 P值0.2250.5310.440<0.0010.003<0.001
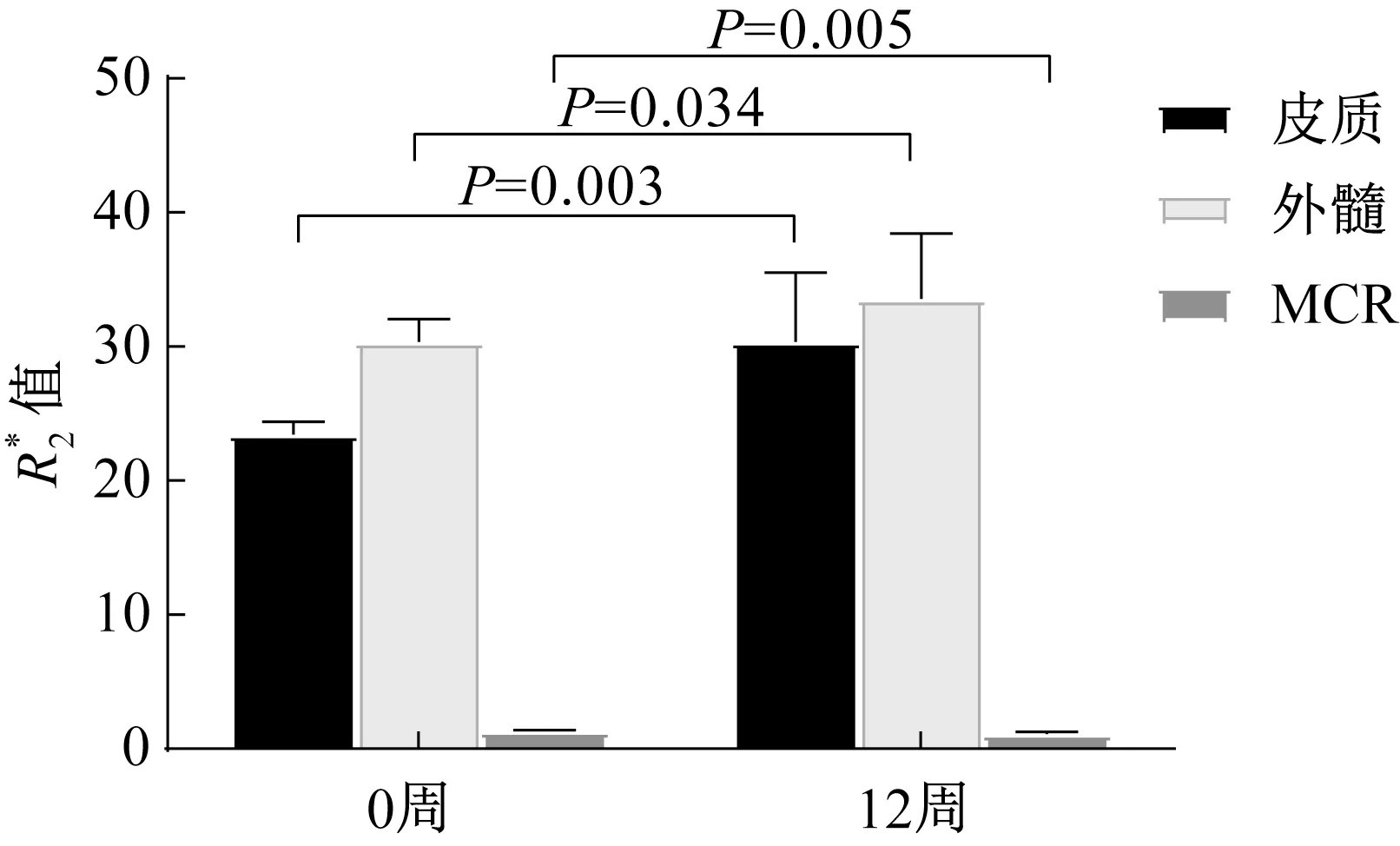
图2 铁过载组在0周及12周时值的比较
3.病理组织学结果
铁过载组HE染色显示肾小球毛细血管及肾小管间质内可见少许炎性细胞浸润,部分肾小管上皮细胞水肿变性,胞质疏松淡染(图3A);普鲁士蓝染色呈阳性,肾小球及肾小管可见较多蓝染颗粒(图3B);Masson染色显示肾间质可见少许蓝染的胶原纤维沉积(图3C)。对照组HE染色显示肾小球及肾小管形态结构正常(图3D);普鲁士蓝染色呈阴性,未见明显蓝染颗粒(图3E);Masson染色显示肾间质内未见明显蓝染胶原纤维沉积(图3F)。

图3 铁过载组和对照组左肾病理表现
讨 论
铁是人体细胞所必需的微量元素,在正常生理状态下,铁的摄入与排泄是保持平衡的[5]。过量的铁会在肝、肾、胰腺、心肌和内分泌腺等实质器官内沉积,导致组织损伤和纤维化。肾脏作为人体重要器官,对于机体体液调节、维持电解质平衡具有重要作用[6]。当肾脏铁负荷过多时,可引起氧化应激及全身炎症反应,最终导致肾脏结构和功能异常[7]。虽然肾脏内铁沉积量相对较少,但在以往的研究发现少量的铁沉积也会损害器官功能[8],目前针对肾脏铁过载的检测方法研究较少,但其临床意义不可忽视。因此,探索、寻找肾脏铁过载的无创性检测方法具有较高的临床意义。
血氧水平依赖磁共振成像是一种无创性氧合评估方法,该技术对含铁血黄素、脱氧血红蛋白等顺磁性物质敏感,这类顺磁性物质增多会导致横向驰豫率增加而引起值增大。脱氧血红蛋白增多、值升高,又反映了组织氧合水平的减低。因此BOLD-MRI不仅可以反映组织铁沉积情况,还可以间接反映组织氧合水平。部分研究[9]指出,值在评估心脏、肝脏铁过载方面具有可行性、准确性和可重复性。陈钇地等[10]针对重型β地中海贫血患者的一项回顾性研究发现肝脏值与肝铁浓度呈高度负相关,提示值可以很好地反映肝脏铁含量。Grassedonio等[11]的研究指出,在肾脏铁过载的测量上是可行的,且具有可重复性。本研究采用值作为评价指标,并且计算了外髓值与皮质值的比值(MCR值),MCR值可以在一定程度上减少外在因素对值的影响。
Naito等[12]通过建立慢性肾脏病大鼠模型,发现铁螯合剂可减轻慢性肾脏病大鼠肾间质纤维化的进展,提出肾铁沉积似乎与肾间质纤维化有关。Ikeda等[13]的研究结果显示去铁胺可减轻单侧输尿管梗阻小鼠的肾间质纤维化,其在输尿管梗阻诱导的肾间质纤维化中的保护作用包括抑制氧化应激、炎症以及促纤维化信号。查婷婷等[14]通过构建兔输尿管梗阻模型,发现兔肾脏皮髓质值随着兔肾纤维化程度的进展而升高,提出BOLD可以通过反映肾脏氧合水平而间接反映肾脏纤维化的进展过程。从以往文献中可以发现,肾脏铁过载可以引起肾间质纤维化,值不仅可以反映肾脏铁过载程度,同时也可以反映肾脏纤维化程度。
此外,本研究结果显示肌内注射铁剂后第12周,铁过载组兔肾的MCR值较对照组减低,表明第12周时铁过载组兔肾皮质值的增加较髓质值的增加更加明显。该结果表明过量的铁主要沉积在皮质区域,可能是由于铁代谢经过肾小球滤过及肾小管重吸收的过程主要在肾皮质内完成,当铁过载引起肾脏损伤时,多余的铁沉积在肾皮质内。
本研究存在的不足之处:①样本量较少,实验兔可能存在个体差异性,需加大样本量,进一步验证实验结果的可靠性及稳定性;②本实验仅针对BOLD评估肾铁沉积的可行性进行研究,未对铁沉积程度进行研究,后续将在更长时间及更大铁剂量的条件下观察过量铁沉积对肾脏可能造成的病理及影像学改变。
综上所述,MR血氧水平依赖成像所得观察指标肾皮髓质伪彩图改变、肾皮质及外髓增高、MCR值减低等表现,可以成为评价铁过载介导肾脏损伤的无创性检测方法。
