1,25-(OH)2D3通过lncRNA-uc.412抑制TGF-β1诱导的系膜细胞增殖的机制研究
2021-07-30安梦如王银妃盛晓静张爱青甘卫华
安梦如,黄 婵,王 锦,王银妃,盛晓静,张爱青,甘卫华,殷 勤
(南京医科大学第二附属医院 儿科,江苏 南京 210003)
慢性肾脏病(chronic kidney disease,CKD)是目前社会共同关注的疾病[1],系膜细胞增殖引起的肾脏纤维化及肾小球硬化是CKD的常见病理改变[2]。大量研究表明,转化生长因子β1(transforming growth factor β1,TGF-β1)在肾脏系膜细胞增殖、纤维化的发生发展中起重要作用[3-4]。1,25二羟基维生素D3[1,25-(OH)2D3]是维生素D的生物活性形式,可通过多种方式保护肾脏,延缓CKD的发生和发展[5]。
长链非编码RNA(lncRNA)是一类以转录长度超过200nt、不编码蛋白为特征的新型RNA分子,lncRNA能够以多种方式在生命有机体的分子信号通路中发挥调控作用[6]。本课题组前期研究发现,lncRNA-uc.412可受TGF-β1调控,在增殖的系膜细胞中表达升高[7]。本研究通过构建TGF-β1处理的大鼠系膜细胞作为增殖模型,探讨1,25-(OH)2D3与lncRNA-uc.412在系膜细胞增殖中的作用及可能的机制,以期为CKD的诊治提供更加精准的靶点。
1 材料与方法
1.1 实验对象 大鼠肾小球系膜细胞株HBZY-1(中国典型培养物保藏中心)。
1.2 主要实验试剂 MTT试剂、1,25-(OH)2D3购于Sigma公司,Trizol试剂购自Invitrogen公司,lncRNA-uc.412慢病毒购自吉凯公司,逆转录试剂盒、PCR试剂盒购于Takara公司,PCR引物由上海锐真生物合成,TGF-β1购于novoprotein公司,SIS3购于MCE公司,DMSO购于Biofroxx公司,细胞周期试剂盒购于US EVERBRIGHT公司。
1.3 实验方法
1.3.1 系膜细胞培养 大鼠肾小球系膜细胞株复苏后用含10%胎牛血清的DMEM完全培养基(含青霉素100 μL/mL,链霉素100 μL/mL),在5%CO2、37℃饱和湿度条件下培养,当细胞生长至70%~80%融合时,用0.25%胰蛋白酶消化传代继续培养,细胞传代培养至第3~8代用于实验。收集对数期大鼠系膜细胞,以1×104个/mL接种于96孔板内,每孔200 μL,待细胞贴壁后,无血清DMEM同步化24h后,再进行细胞干预处理48 h并按实验要求分组,用TGF-β1(10 ng/mL)、1,25-(OH)2D3(10-8mol/L)干预分组:正常对照组、TGF-β1组、VD组、TGF-β1+VD组。用smad 3磷酸化特异性抑制剂SIS3(1 μmol/L)与TGF-β1(10 ng/mL)干预分组:正常对照组、TGF-β1组、TGF-β1+SIS3组、SIS3组。
1.3.2 四甲基偶氮唑盐法(MTT)检测各组系膜细胞增殖情况 于各组结束干预前4 h,向每孔加入20 μL MTT溶液(5 mg/mL),继续培养4 h后,去除上清,加入DMSO,室温避光振荡10 min后,使紫色结晶溶解,用酶标仪测定各孔在490 nm波长处的吸光度值(A490),每组设4个复孔,设置空白调零孔(只加DMEM溶液+MTT+DMSO),以上实验重复3次,并按下列公式计算各组细胞增殖:细胞增殖率(细胞活力)=(A实验组-A空白对照)/(A阴性对照-A空白对照)×100%。
1.3.3 Real-time PCR法检测目的基因的表达 收集各组细胞,根据RNA提取说明书,Trizol试剂分别提取总RNA,测RNA浓度;参照逆转录试剂盒说明书,配置10 μL逆转录反应体系,制备cDNA;以β-actin作为内参,参照PCR试剂盒说明书进行Real-time PCR。反应体系为20 μL(SYBR 5 μL,上下游引物各0.4 μL,Rox 0.2 μL,cDNA 1 μL,ddH2O 3 μL);反应条件为预变性:95℃ 30 s;变性:95℃ 5 s;退火:60℃ 34 s;延伸:60℃ 1 min,40个循环,根据溶解曲线分析扩增产物的特异性,2-△△CT法计算其相对表达量。每个样本设置3个复孔,实验重复3次。所用引物序列见表1。

表1 PCR引物序列
1.3.4 流式细胞术检测细胞周期 收集各组细胞,加入75%冰乙醇,吹打均匀,-20℃固定过夜,上机前再次离心,加1 mL冰浴预冷的PBS重悬细胞,配制碘化丙啶染色液,每管加入500 μL碘化丙啶染色液,缓慢并充分重悬细胞沉淀,37℃避光孵育30 min后流式细胞仪检测细胞周期,实验重复3次。
1.3.5 Western blot法检测目的蛋白表达 收集各组细胞,按100∶1加入蛋白裂解液和蛋白酶抑制剂,冰上裂解30 min,离心后吸取上层液体用BCA蛋白定量试剂盒测蛋白浓度。每组蛋白上样量为30 μg,经电泳、转模、5%脱脂牛奶封闭,加一抗(浓度1∶1 000)于4℃孵育过夜,TBST漂洗3次,加二抗(浓度1∶5 000)室温孵育1h,TBST漂洗3次后ECL显色,凝胶成像系统进行图像扫描记录。以GAPDH作为内参,用Image J进行灰度值分析,计算目的蛋白的相对表达量。
1.3.6 lncRNA-uc.412过表达慢病毒转染 将处于对数生长期的系膜细胞按1×105/孔接种于6孔板,置于37℃、5%CO2细胞培养箱中培养24 h后,换用无血清DMEM同步化24 h后,待细胞融合率达60%~70%左右,加入lncRNA-uc.412(2×107TU/mL)过表达病毒液、1,25-(OH)2D3(10-8mol/L)干预分组,继续37℃培养48 h,构建lncRNA-uc.412过表达模型,分为对照组、过表达(uc.412)组与uc.412+VD组。
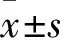
2 结果
2.1 1,25-(OH)2D3对TGF-β1诱导的系膜细胞增殖率的影响 MTT结果可见,TGF-β1组系膜细胞数量多于对照组,差异有统计学意义(P<0.01);与TGF-β1组相比,TGF-β1+VD组细胞数减少,差异有统计学意义(P<0.01)。见图1。
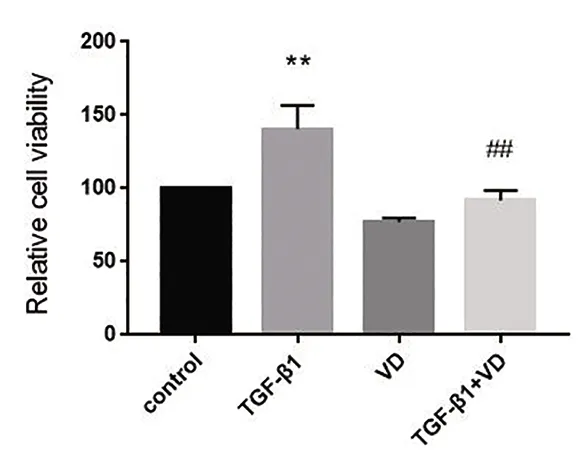
与对照组相比,**P<0.01;与TGF-β1组相比,## P<0.01。F=56.020,P<0.001。
2.2 1,25-(OH)2D3对TGF-β1诱导的系膜细胞增殖相关基因及lncRNA-uc.412的表达影响 如图2A~C所示,与对照组比较,TGF-β1组ki67、PCNA mRNA表达量增加,抑制性周期蛋白p27 mRNA表达量下降,差异有统计学意义(P<0.01);与TGF-β1组比较,TGF-β1+VD组ki67、PCNA mRNA的表达量下降,p27 mRNA表达量增加,差异有统计学意义(P<0.01)。如图2D所示,TGF-β1组的lncRNA-uc.412的表达量较对照组增加,差异有统计学意义(P<0.01);TGF-β1+VD组的lncRNA-uc.412的表达量较TGF-β1组下降,差异有统计学意义(P<0.01)。

与对照组相比,**P<0.01;与TGF-β1组相比,## P<0.01。FA=9.908,PA=0.001;FB=89.647,PB<0.001;FC=64.911,PC<0.001;FD=88.690,PD<0.001。
2.3 1,25-(OH)2D3对肾小球系膜细胞周期的影响 与对照组比较,TGF-β1组G1期细胞百分率减少,G2、S期细胞百分率增多,差异有统计学意义(P<0.05);与TGF-β1组相比,TGF-β1+VD组G1期细胞百分率增多,G2、S期细胞百分率减少,差异均有统计学意义(P<0.05)。见表2。
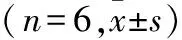
表2 1,25-(OH)2D3对细胞周期的影响
2.4 SIS3对TGF-β1诱导的系膜细胞lncRNA-uc.412表达的影响 与对照组相比,TGF-β1组的p-smad3蛋白表达升高;与TGF-β1组比较,TGF-β1+SIS3组p-smad3蛋白的表达量下降,差异有统计学意义(P<0.01)(图3A、B)。各组smad3蛋白的表达量差异均无统计学意义(P>0.05)(图3C)。与对照组比较,TGF-β1组lncRNA-uc.412的表达量增加,差异有统计学意义(P<0.01);与TGF-β1组比较,TGF-β1+SIS3组lncRNA-uc.412的表达量下降,差异有统计学意义(P<0.01)(图3D)。
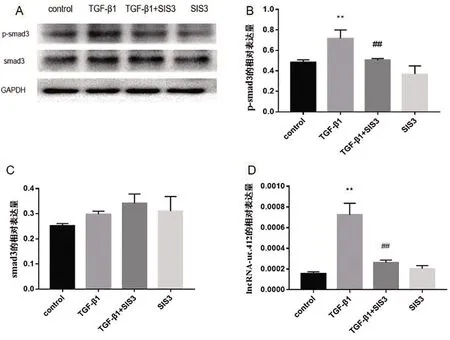
与对照组相比,**P<0.01;与TGF-β1组相比,## P<0.01。FB=24.030,PB<0.001;FC=3.414,PC=0.053;FD=56.790,PD<0.001。
2.5 1,25-(OH)2D3对系膜细胞lncRNA-uc.412过表达后增殖相关基因的表达影响 与对照组比较,uc.412组ki67、PCNA mRNA的表达量增加,p27 mRNA表达量下降,差异有统计学意义(P<0.01);与uc.412组比较,uc.412+VD组ki67、PCNA mRNA表达量下降,p27 mRNA表达量增加,差异有统计学意义(P<0.01)。见图4A~C。

与对照组比较,**P<0.01;与TGF-β1组比较,## P<0.01。FA=12.130,PA<0.001;FB=88.190,PB<0.001;FC=15.770,PC<0.001。
3 讨论
肾小球系膜细胞的异常增殖,可引起肾脏纤维化,导致终末期肾病[2,8]。这是许多肾小球疾病的共同特征,其机制尚未完全阐明,临床目前尚无有效治疗方法。因此,亟待从分子和细胞的角度寻找抑制系膜细胞异常增殖的靶点。1,25-(OH)2D3是钙、磷代谢的重要物质,近来发现,1,25-(OH)2D3还可对多种细胞的异常增殖起抑制作用。Mizgalski等[9]发现1,25-(OH)2D3可抑制头颈部鳞状细胞癌的增殖。Jamali等[10]发现,1,25-(OH)2D3是视网膜新生血管形成的有效抑制剂。Zhang等[11]研究表明,1,25-(OH)2D3可抑制EGF诱导的大鼠系膜细胞的增殖。本研究以大鼠肾小球系膜细胞为研究对象,通过TGF-β1干预系膜细胞,成功构建系膜细胞增殖模型,添加1,25-(OH)2D3后发现ki67、PCNA表达下调,p27表达上调,细胞增殖率下降,并将其细胞周期阻滞于G1期。提示1,25-(OH)2D3可抑制TGF-β1所致的大鼠系膜细胞增殖,其机制可能与阻滞细胞周期有关。
lncRNA既往被认为没有生物学作用[12],但近来发现,lncRNA可通过DNA甲基化、染色质重塑、信使RNA降解等多种方式参与调控各种生命活动[13-14]。在肾脏病学领域,已有多项研究报道相关lncRNA的显著高表达,Ren等[14]报道lncRNA PVT1、lncRNA-PRINS、TapSaki等lncRNAs在急性肾损伤中高表达。Li等[15]发现,lncRNA-NOP14-AS1和lncRNA-HCP5在CKD中特异性高表达。TGF-β1是肾小球系膜细胞异常增生的关键因子[16],TGF-β1/smad3信号通路参与了系膜细胞的异常增殖及肾小球硬化。本课题组前期在体外TGF-β1诱导系膜细胞增生模型中,发现多个lncRNAs的表达存在差异,其中lncRNA-uc.412的表达水平与系膜细胞增殖程度显著相关[7,17]。本研究用TGF-β1处理大鼠系膜细胞,可观察到细胞增殖率升高,且lncRNA-uc.412的表达量增加,这与我们前期研究结果相符。并且,我们发现过表达lncRNA-uc.412后,ki67、PCNA的表达上调,p27的表达下调,这说明TGF-β1可通过介导lncRNA-uc.412的表达,促进系膜细胞增殖。而1,25-(OH)2D3与TGF-β1共同干预后,lncRNA-uc.412的表达下调;过表达lncRNA-uc.412后,用1,25-(OH)2D3干预发现ki67、PCNA的表达下调,p27的表达上调。这表明,1,25-(OH)2D3可能通过下调lncRNA-uc.412的表达水平抑制TGF-β1诱导的大鼠系膜细胞增殖。
综上所述,1,25-(OH)2D3可抑制TGF-β1诱导的大鼠系膜细胞增殖,其机制可能与1,25-(OH)2D3阻滞细胞周期及下调lncRNA-uc.412的表达有关。但1,25-(OH)2D3是否通过其他途径抑制系膜细胞增殖,lncRNA-uc.412调控系膜细胞增殖的深层机制,还有待于进一步研究。
