长链非编码RNA 调控神经病理性疼痛的研究进展*
2021-07-30张如月武彩花刘永敏
张如月 武彩花 李 熳 贾 珉 刘永敏 △
(1 华中科技大学同济医学院基础医学院,武汉 430030;2 华中科技大学同济医学院附属协和医院,武汉 430022;武汉市第一医院3 针灸科;4 检验科,武汉 430022)
神经病理性疼痛 (neuropathic pain, NP) 是由躯体感觉神经系统的损伤或疾病直接或间接造成的一种疼痛,其主要表现为自发性疼痛、痛觉过敏、异常疼痛和感觉异常等临床特征[1]。中枢敏化和外周敏化共同参与神经病理性疼痛的发生发展,其中神经元的异常放电与神经胶质细胞的功能失调改变了伤害性信号的传导和处理,最终导致痛阈的降低[2]。目前的治疗药物仅能缓解病人的疼痛症状,不能改善外周神经的损伤,未能从神经病理性疼痛的发生机制上解决疼痛问题。因此,探究神经病理性疼痛发生发展的分子机制,不仅有利于加深对疼痛本质的认识,对疼痛病人的临床诊治也有重要意义。
长链非编码RNA (long non-coding RNA, lncRNA)是一组长度大于200 个核苷酸、没有明显蛋白编码功能的RNA,由RNA 聚合酶II 催化转录合成。越来越多的研究结果表明lncRNA 参与神经元活动以及神经损伤,其中机制可能是通过调节神经元的生长、分化以及突触的形成和功能来影响神经系统发育和突触可塑性[3]。已有文献报道神经病理性疼痛模型中存在着大量lncRNA 的差异表达,干预这些 lncRNA 能有效缓解神经病理性疼痛,由此说明lncRNA 在神经病理性疼痛的发生发展过程中发挥着重要作用。本文就近年来lncRNA 参与神经病理性疼痛的细胞和分子机制及其介导的下游潜在信号通路进行综述,为深入了解神经病理性疼痛的发生发展提供理论支持,为神经病理性疼痛的临床治疗提供新靶标。
一、lncRNA 与神经病理性疼痛
神经病理性疼痛起源于外周或中枢神经系统损伤(三叉神经痛、脊髓损伤)、病毒感染(带状疱疹后神经痛)、代谢紊乱(糖尿病神经病理性疼痛)、卡压、肿瘤等[4],严重影响病人的生活质量。神经病理性疼痛的模型分为外周神经损伤模型和糖尿病神经病理性疼痛模型 (diabetic neurophathic pain,DNP)两大类。常见的外周神经损伤模型有坐骨神经慢性压迫损伤模型 (chronic constriction injury, CCI)、坐骨神经切断模型 (sciatic nerve transaction, SNT)、脊髓神经结扎模型 (spinal nerve ligation, SNL)等。DNP 模型是通过腹腔注射链脲佐菌素诱导速发型实验性糖尿病模型,糖尿病引起的外周神经损伤导致神经病理性疼痛。下面将从目前lncRNA 在调控神经病理性疼痛中的几个视角分别进行综述。
1. lncRNA 调控离子通道、兴奋神经元促进神经病理性疼痛的发生发展
在神经损伤时,电压依赖性钾通道 (Kv) 亚基kcna2 的表达下调,导致DRG 神经元静息期钾离子外流减少,静息电位升高,神经元兴奋性升高。Zhao 等[5]发现lncRNA Kcna2-AS (Kcna2 antisense RNA)可以在DRG 神经元沉默Kcna2 进而导致神经病理性疼痛。Kcna2-AS 是 Kcna2 的反义链,它的大部分序列与Kcna2 RNA 互补。外周神经损伤时,DRG中 Kcna2-AS 的表达显著升高,抑制Kcna2 mRNA和蛋白质的表达,使总Kv 电流减少,DRG 神经元的兴奋性增加促进神经病理性疼痛的发生。进一步研究发现转录因子髓系锌指蛋白1 (transcriptional activator myeloid zinc finger protein 1, MZF1) 可以与Kcna2-AS 的启动子区结合,促进 Kcna2 的反义链Kcna2-AS 的转录,而下调Kcna2-AS 的表达可以缓解神经病理性疼痛。
最近浙江大学Zhang 等[6]的发现脊髓背角lncRNA uc.153 在小鼠CCI 模型中显著升高,敲低uc.153 的表达可以抑制CCI 导致的脊髓广动力神经元自发活性和自发放电率的增加,逆转脊髓敏化,进而改善慢性神经病理性疼痛,并且uc.153 在naive小鼠过表达也会产生痛超敏及脊髓神经元敏化。进一步研究发现pre-miR-182-5p 是其下游靶标,uc.153 负性调控miR-182-5p 及EphB1-NMDA 受体参与慢性神经病理性疼痛的调节。
南 昌 大 学Li等[7]在大鼠CCI模型中发现lncRNA MRAK009713 的表达上调,而抑制MRAK009713的表达可以显著减轻大鼠痛行为,进一步研究发现MRAK009713 通过与 P2X3 受体相互作用,引起ATP 介导的细胞电流增加,提高了DRG 伤害性神经元的兴奋性,增加CCI 大鼠的疼痛敏感行为。在2017 年该 课 题 组 又 发 现 在 2 型 糖 尿 病 大 鼠(type 2 diabetes mellitus, T2DM) 模 型 中 沉 默 lncRNA NONRATT021972[8]可以下调 P2X7 mRNA 及蛋白水平的表达,抑制胶质细胞中BzATP 激活电流,进而抑制DRG 星形胶质细胞的活化以及神经元兴奋性,减少炎症介质的释放,最终达到缓解T2-DM 神经病理性疼痛的目的。
在臂丛神经撕脱模型 (brachial plexus avulsion,BPA) 中脊髓背角神经元胞浆产生的lncRNA Malat1[9]减少,而在脊髓背角原代培养的神经元中Malat1 的下调导致神经元自发性放电频率的显著增加。进一步分析表明在谷氨酸刺激过程中,敲低Malat1 表达的神经元中胞内钙浓度明显高于正常神经元。说明Malat1 表达下调可能通过调节钙电流来增加脊髓神经元兴奋性以诱导神经病理性疼痛。
以上研究结果表明,一些lncRNA 与离子通道蛋白或离子通道受体密切相关,外周神经损伤引起这些lncRNA 表达异常,进而使与其相关的离子通道蛋白表达或功能异常,引起神经元或胶质细胞膜电流改变进而影响神经元兴奋性,最终导致神经病理性疼痛的发生。
2. lncRNA 通过调节炎症通路、氧化应激以及自噬调控神经病理性疼痛
外周神经损伤会引起炎症反应,研究发现lncRNA 可以激活炎症通路促进炎症介质释放促进神经病理性疼痛的发生发展。Yu 等[10]检测了152 例临床2 型 糖 尿 病 病 人 的 血 清 ,发 现LncRNA NONRATT021972 和前炎症因子TNF-α 在 T2DM 组显著高于对照组,并与神经病理性疼痛的严重程度呈正相关,动物实验也证实沉默NONRATT021972可以降低TNF-α 的表达,减轻炎症反应,进而缓解神经病理性疼痛。
南昌大学Liang 等[11]在T2DM 大鼠模型中对该LncRNA 研究也得到相同的结论,进一步研究发现NONRATT021972 可能作用于P2X3,促进炎症介质TNF-α 的释放,并磷酸化激活ERK1/2 信号通路,促进神经病理性疼痛的发生发展。该课题组还发现沉默lncRNA uc.48+[12]可以抑制DRG 中P2X3受体的表达,使ERK1/2 通路介导的磷酸化和兴奋性降低,TNF-α 释放减少,从而减轻神经病理性疼痛。细胞水平的实验[13]也发现高糖高游离脂肪酸处理巨噬细胞系RAW264.7 后,uc.48+和P2X7 受体表达升高,P2X7 介导的炎症介质IL-10 和IL-1β释放,活性氧 (reactive oxygen species, ROS) 形成,ERK 通路被激活,而沉默uc.48+可以翻转P2X7 的表达并抑制其介导的炎症和免疫反应。Liu 等[14]研究发现T2DM 大鼠模型中lncRNA BC168687 高表达,瞬时受体电位香草酸亚型1 (transient receptor potential channel subfamily vanilloid 1, TRPV1) 受体被激活,磷酸化的ERK 通路和磷酸化的p38 信号通路同时被激活,血清炎症因子TNF-α 和 IL-1 升高,促进神经病理性疼痛的发生发展,而下调 lncRNA BC168687 可以减轻TRPV1 介导的糖尿病神经病理性疼痛。该课题组在细胞水平的研究结果也发现高糖高游离脂肪酸处理星形胶质细胞后,lncRNA BC168687 和 P2X7 升 高,siRNA 下 调 BC168687 可降低P2X7 的表达以及P2X7 介导的NO 和 ROS 的形成,减轻氧化应激[15]。
最新研究发现lncRNA 可以通过调节细胞自噬参与神经病理性疼痛。CircRNAs (CircularRNAs, 环状RNA) 是一类不具有5'末端帽子和3'末端poly (A)尾巴、并以共价键形成环形结构的客观存在于生物体内的非编码RNA 分子,它也属于lncRNA。有研究表明,环状RNA 也参与神经病理性疼痛的调节,Cai等[16]发现ciRS-7 (circRNA-7) 在神经病理性疼痛中表达上调,ciRS-7 的表达与CCI 神经病理性疼痛的进展正相关。ciRS-7 可以部分上调CCI 大鼠自噬和炎症表达水平,而下调ciRS-7 的表达可以减轻自噬和炎症进而改善神经病理性疼痛,进一步研究发现ciRS-7 是通过海绵吸附miR-135a-5p 调节神经病理性疼痛。
大量文献表明神经病理性疼痛的发生发展与免疫反应、炎症反应的激活密切相关。神经病理性疼痛时lncRNA 可以通过调节神经炎症、氧化应激、自噬等生物学过程,影响炎症介质、ROS 以及自噬生物标志物合成或释放,使神经病理性疼痛得以维持和发展。
3. lncRNA 调节神经递质释放参与神经病理性疼痛
吉林大学Li 等[17]发现脊髓背角lncRNA H19在神经病理性疼痛模型高表达,神经递质5-羟色胺(5-hydroxytryptamine, 5-HT)、GABAB2在脊髓背角低表达。进一步研究发现,H19 通过海绵吸附miR-196a-5P 调控细胞周期蛋白依赖性激酶5 (cyclin-dependent kinase 5, CDK5)/P35 到磷酸化的cAMP 反应元件结合蛋白 (p-CREB) 信号通路(CDK5/P35/CaMKII/p-CREB),最终影响神经递质5-TH、GABAB2和炎症介质的合成。抑制性递质合成减少、炎症介质释放增多共同促进神经病理性疼痛的发生发展。
4. lncRNA 调节神经元凋亡参与神经病理性疼痛
昆明医科大学Liu 等[18]研究发现在臂丛神经损伤 (acute brachial plexus injury, BPI) 模型中,lncRNA JHDM1D-AS 1和DUSP1(又被称为MAPK磷酸酶-1,MKP-1)表达显著下降,miR-101-3p 表达升高。过表达JHDM1D-AS 1 抑制BPI 引起的神经元凋亡和小胶质细胞的激活。进一步研究发现,在BPI 模型中,调控JHDM1D-AS1/miR-101-3p/DUSP1/P38/NF-KB 信号通路可引起脊髓背角小胶质细胞的过度激活(神经炎症)和神经元凋亡。而JHDM1D-AS1 正是通过吸附miR-101-3p 进而上调DUSP1 来抑制P38/NF-κB途径的激活来发挥神经保护以及抗炎作用。
5.神经病理性疼痛中lncRNA、miRNA 以及mRNA 的相互作用
近几年报道了大量长链非编码RNA 通过lncRNA-miRNA-mRNA 轴调节神经病理性疼痛发生发展的研究,经过梳理,lncRNA, miRNA 以及mRNA 的相互作用机制如下:①lncRNA 作为分子海绵,吸附miRNA,抑制其与mRNA 的结合,使得mRNA 免于降解,这类lncRNA 被称为内源竞争RNA (competing endogenous RNAs, ceRNA)[19~22];②miRNA 可引起lncRNA 降解。miRNA 通过减弱靶lncRNA 的稳定性来降低其丰度,进而影响多种生物学过程。例如,miR-145-5p 是人类胚胎干细胞中lncRNA-RoR 的靶基因,而增加miR-145-5p 的浓度会降低lncRNA-RoR 的活性[23];③lncRNA 与miRNA 竞争性结合mRNA,lncRNA 也可以直接在miRNA-mRNA 结合位点区域与mRNA 结合,从而消除miRNA 对mRNA 的调控[24];④lncRNA 可以产生miRNA,lncRNA 可能含有发夹结构,可以产生pre-miRNA(miRNA 前体),进一步调节下游基因的表达[25]。在神经病理性疼痛的研究中,目前已报道的多为lncRNA 通过海绵作用吸收miRNA进而中和miRNA 对靶基因的作用。多项研究证明lncRNA XIST 在CCI 动物模型中表达明显上调,通过调控下游靶miRNA miR-150[22],miR-137[19],miR-154-5p[20],miR-544[21]的表达,进而作用于核转录因子STAT3、ZEB1 以及TLR5 影响细胞的炎症信号通路、氧化应激等促进神经病理性疼痛的发生发展。近几年报道了很多 lncRNA 通过调控microRNA 的表达进而影响炎症介质释放、氧化应激来参与神经病理性疼痛的研究,具体机制见表1[26~37]。
长链非编码RNA 在神经病理性疼痛模型中异常表达,通过一系列分子机制影响神经元或胶质细胞的功能,调控神经病理性疼痛的发生发展。表1从模型、下游分子机制,功能等方面汇总了近年来报道的lncRNA 参与神经病理性疼痛的研究。
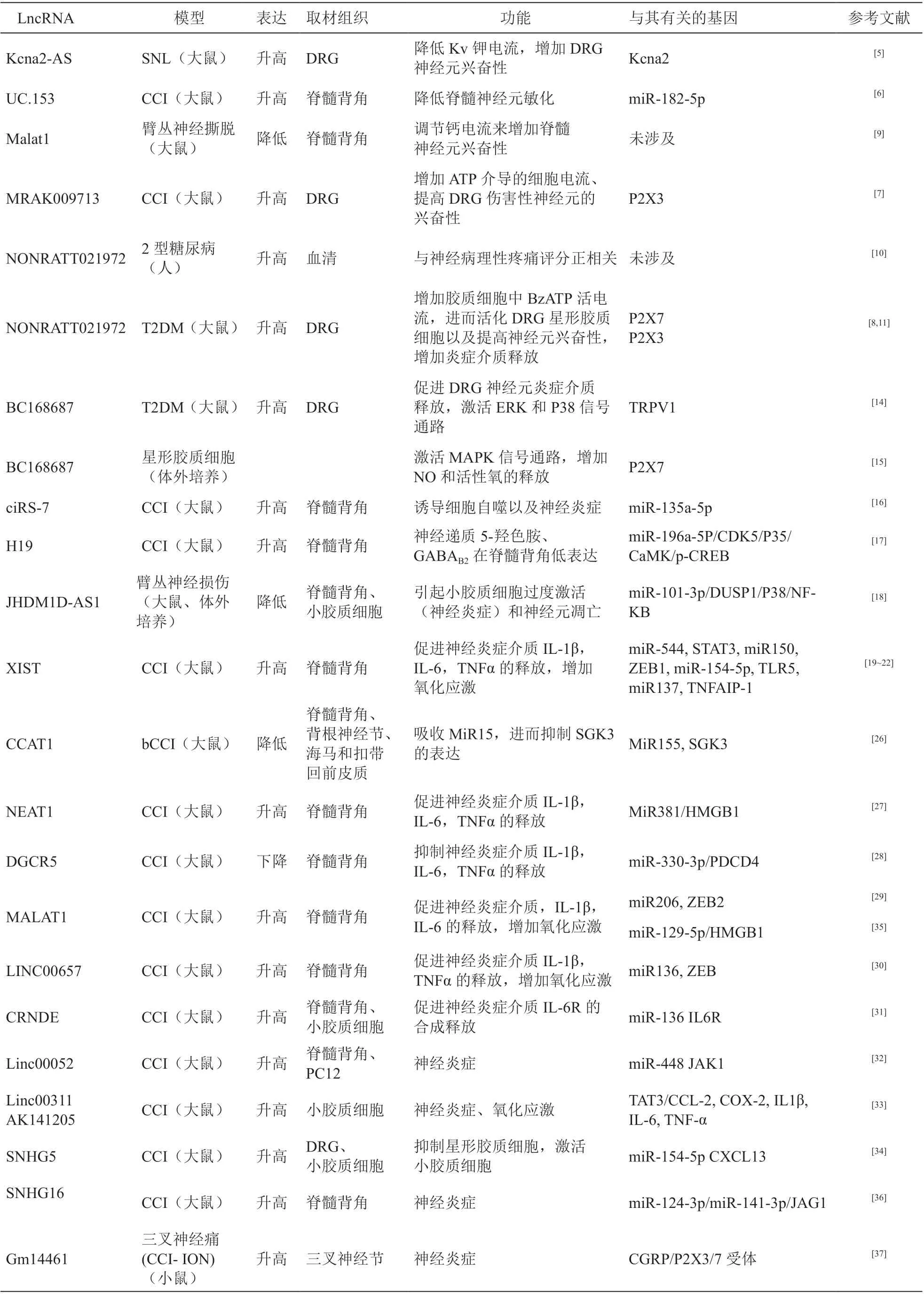
表1 lncRNA 在神经病理性疼痛中的功能特征汇总
二、神经病理性疼痛模型中差异lncRNA 的表达谱分析
随着RNA 测序技术的发展和普及,神经病理性疼痛模型的差异lncRNA 及mRNA 被筛选出来并得到验证。下面汇总了近几年发表的神经病理性疼痛模型RNA 测序、差异基因表达谱分析的研究(见表2)。
1. 脊神经结扎模型,研究的侧重点在神经病理性疼痛相关的lncRNAs
Jiang 等[38]对大鼠实施脊神经结扎术 (spinal nerve ligation, SNL) 后 10 天取 lncRNA 和 mRNA 基因芯片分析,发现511 个差异表达的lncRNA(其中 366 个表达上调、145 个表达下调)和 493 个差异表达的mRNA(其中 363 个表达上调、122 个表达下调)。对上调的 lncRNA 和 mRNA 进行功能分析,发现差异表达的 mRNA 功能主要集中在免疫反应、防御反应和炎症反应,这也是神经病理性疼痛
的重要致病机制。进一步分析发现有35 个差异表达的lncRNA 与差异表达的 mRNA 相邻或重叠,功能分析发现其与toll 样信号受体、细胞因子受体相互作用、过氧化物酶体增殖物激活的受体信号通路有关(见表2)。
新泽西州医学部Wu 等[39]对小鼠脊神经结扎模型6 天后 L4DRG 进行RNA 测序,发现了944 个差异表达的的非编码RNA(见表2),其中变化最显著的是长链固有非编码RNA,其次是反义RNA、假基因。后期qPCR 验证 Kcna2, Oprm1 以及lncRNAs Gm21781 和4732491K20Rik 在脊神经结扎后确实存在差异表达。
2. 坐骨神经损伤模型,研究的侧重点在与神经再生相关的lncRNAs
Yu 等[40]对大鼠坐骨神经切断后0、1、4、7 天的背根神经节 (dorsal root ganglion, DRG) 进行RNA芯片分析,发现了105 个差异表达的lncRNA,其中有24 个下调的lncRNAs 以及115 个靶基因,通过信号通路分析发现下调的lncRNA 与神经胶质细胞迁移、嘌呤能核苷酸受体信号通路、血管舒张、神经肽信号通路以及神经再生信号通路包括 MAPK信号通路和神经活性配体-受体相互作用有关(见表2),其中验证了沉默lncRNA BC089918 可以促进外周神经损伤后轴突再生。而Yao 等[41]也通过RNA 表达谱分析发现lncRNAs uc.217 在外周神经再生中有重要调控作用,沉默uc.217 促进神经元的轴突再生,通过生物信息学分析和实验验证确定uc.217 靶向蛋白质sema3d 和smad7 参与了神经再生。Mao 等[42]对大鼠坐骨神经损伤模型7 天后L4-L6DRG 转录组水平进行高通量测序,发现了86 个已知的 lncRNA 和 26 个新的lncRNA 存在差异表达,对这86 个已知的lncRNA 所调控的866 个靶基因进行GO 分析和KEGG 富集分析发现单侧坐骨神经损伤后涉及到神经元合成、分泌神经递质的基因表达下调,参与神经元再生的基因表达上调,说明神经再生成为应对外周神经损伤后的中坚力量。RTqPCR 验证了下调的rno-Cntnap lncRNA 和上调的AC111653.1 lncRNA,说明它们与神经病理性疼痛有关,并推断它们可以促进周围神经再生。
3. 糖尿病神经病理性疼痛模型中差异lncRNA的表达谱分析
糖尿病周围神经病变是糖尿病病人最常见、最复杂和最严重的并发症之一,是因糖尿病慢性高血糖状态及其所致各种病理生理改变而导致的神经系统损伤,临床上多表现为肢体疼痛、感觉减退、麻木、灼热、冰凉等,也可表现为自发性疼痛、痛觉过敏、痛觉超敏。与其他类型的神经性疼痛病人相似,病人表现出外周和中枢敏化,病理性小胶质细胞活化和参与伤害性感受的神经元和神经胶质细胞的突触可塑性变化。Du 等[43]通过对链脲佐菌素 (streptozotocin, STZ) 诱导的DNP 小鼠脊髓背角组织RNA芯片分析发现有1481 个差异表达的 lncRNAs 和 1096个差异表达的mRNA,功能分析发现TGF-β 结合是最重要的分子功能,逆行的内源性大麻素信号转导通路是差异mRNA 最重要的通路,其次是钙离子转运(见表2)。最后验证ENSMUST00000150952-Mbp和AK081017-Usp15 与DNP 的发生发展密切相关。

表2 神经病理性疼痛模型中lncRNAs 的差异表达谱汇总
三、结语
通过RNA 测序和RT-qPCR,越来越多参与神经病理性疼痛的lncRNA 被筛选出来并得到验证,并且它们的功能和调控机制也在被探索。从功能机制上看,lncRNA 主要是通过离子通道影响神经元兴奋性以及神经炎症氧化应激这两方面参与神经病理性疼痛,而最新研究发现lncRNA 也可以通过调节神经元凋亡、神经递质合成释放等其他角度参与神经病理性疼痛。从分子机制上看,lncRNA 主要是通过其反义RNA(如KCNA2-AS 和JHDM1DAS1)与mRNA 结合引起mRNA 降解以及lncRNA海绵吸附miRNA 进而调节下游靶基因参与神经病理性疼痛。这些研究为它们在神经病理性疼痛的临床诊断和治疗中作为潜在的治疗靶标提供了新的启示。
