汤汁特性对罐藏黄桃贮藏期质构品质的影响
2021-07-29于笑颜毕金峰王凤昭张嗣伟郭崇婷
吕 健,于笑颜,毕金峰,王凤昭,谢 晋,张嗣伟,郭崇婷
(中国农业科学院农产品加工研究所,农业农村部农产品加工重点实验室,北京 100193)
黄桃为蔷薇科桃属,果肉金黄、肉质较韧,多为罐藏加工用桃[1]。制罐用桃的优良品种主要有‘NJC83’‘黄金冠’‘金童5号’‘金童6号’‘罐5’‘NJC19’等[2]。我国桃罐头加工制品主要依赖出口,出口量受国际市场波动影响较大。中国海关数据统计表明[3],2020年1至4月,我国桃罐头出口总量达4.29万 t,数量同比增长26%,销售额同比增加17%,平均单价同比减少7%。
贮藏加工能够有效钝化微生物和酶活性,保障罐藏产品贮藏期的部分感官品质;但是罐藏加工中的高温处理和长期的贮藏过程可能会导致果肉组织破损、水分和固形物流失[4],进而影响产品的质构、口感和风味。质构作为罐藏黄桃产品的关键品质,是影响制罐企业产品出口和发展的关键因素。目前针对罐藏黄桃的研究多集中在工艺优化、加工参数对黄桃果肉色泽等品质的影响以及杀菌技术等方面的研究。江舰等[5]优化了护色工艺结合五段式中温(85~92 ℃)杀菌技术,能够有效改善罐藏黄桃色泽、滋味、组织形态等品质特性。姚佳等[6]对比分析了热杀菌技术和高静压杀菌技术对罐藏黄桃质构的影响,认为高静压技术能够基本保持黄桃果肉细胞的组织形态,进而使黄桃果肉保持较好的硬度,但是其在工业生产中的应用还需要考虑技术成本和产业规模。Zhang Fusheng等[7]探讨了高静压技术对贮藏期罐藏黄桃质构的影响,认为加工过程中较长时间(10~30 min)压力的保持有利于罐藏黄桃果肉硬度的维持,同时指出果胶物质的溶出可能是导致果肉质构变化的重要原因。Saura等[8]在罐藏黄桃蔗糖汤汁中添加柠檬汁(提供柠檬酸)能够有效控制果肉pH值,减少褐变色素类物质的生成,从而有效抑制罐藏黄桃果肉的非酶褐变程度,但是未进一步探讨蔗糖汤汁特性在贮藏期间的变化。
蔗糖溶液是罐藏黄桃加工企业最普遍使用的汤汁,汤汁特性(如流变性等)与果蔬罐头组织的化学组成、分子结构、分子内及分子间缔合的状态、组织构造均紧密相关[9-10];同时由于果肉细胞与汤汁之间渗透压的差异,通常伴随有质的传递,即果肉中的水分、固形物等扩散至汤汁中,汤汁溶质进入到果肉细胞中[11]。因此,可以推断贮藏过程中罐藏黄桃可能受汤汁特性的影响而发生软化,有必要追踪解析汤汁特性在贮藏过程中的变化,并阐明其与罐藏黄桃质构之间的相关性,为调控罐藏黄桃质构提供理论依据。本研究以‘金童5号’为原料制备罐藏黄桃,追踪检测贮藏期间蔗糖汤汁特性和黄桃果肉质构特性变化,分析二者之间的相关性,从而阐释汤汁特性对罐藏黄桃质构的影响机制。
1 材料与方法
1.1 材料与试剂
‘金童5号’黄桃(7~8 级成熟)采自北京平谷,挑选大小均一、表面无损伤、无病虫害的黄桃运回实验室,立即贮藏于4 ℃冷库。
柠檬酸、硫酸、四硼酸钠(均为分析纯) 国药集团化学试剂有限公司;D-半乳糖醛酸、间羟基联苯美国Sigma公司;无水乙醇 北京化工厂有限责任公司;白砂糖(食品级) 市售。
1.2 仪器与设备
DHP-9162型电热恒温培养箱 上海精宏实验设备有限公司;TA.XT 2i/50型物性分析仪 英国Stable Micro Systems公司;S-570扫描电子显微镜 日本Hitachi公司;XSP-BM10A光学照相电子显微镜 上海光学仪器六厂;WZB45型数显折光仪、PHS-3C pH计 上海精密科学仪器有限公司;UV-1800型紫外分光光度计 日本岛津公司;Physica MCR301流变仪 奥地利Anton Paar公司;2100N浊度仪 美国Hach公司;3000型冰点渗透压仪德国Gonotec公司;Color Quest XT色差计 美国Hunter Lab公司;RE-300旋转蒸发器 上海亚荣生化仪器厂。
1.3 方法
1.3.1 罐藏黄桃制备方法及前处理
‘金童5号’黄桃经清洗、二分切、挖核、去皮后得到桃瓣,将桃瓣于温度为(90±2)℃的蒸馏水中预煮6 min,随后进行冷却、装罐、灌汤(汤汁由蔗糖配制而成,控制糖浓度19~20 °Brix,煮沸5 min,保证温度不低于85 ℃),封口后热杀菌处理15 min。
罐藏黄桃贴好标签后置于恒温培养箱中,设置温度为37 ℃,贮藏时间为90 d,每10 d用吸管于汤汁上、中、下层分别取样。
1.3.2 汤汁特性指标的测定
1.3.2.1 pH值及可溶性固形物含量测定
pH计经校准后用于罐藏黄桃汤汁pH值测定;数显折光仪用于罐藏黄桃汤汁可溶性固形物(total soluble solid,TSS)含量测定,单位为°Brix。
1.3.2.2 浊度测定
参照Klavons等[12]的方法并略作修改。取10 mL汤汁,使用校准后的浊度仪进行测定。
1.3.2.3 色泽测定
采用Color Quest XT色差计测定汤汁的色泽。色差计预热30 min后,依次使用黑板、白板进行校准,测定贮藏期间罐藏黄桃汤汁色泽,记录L*值(亮度)、a*值(红绿度)、b*值(黄蓝度)。色差(ΔE)按下式计算。
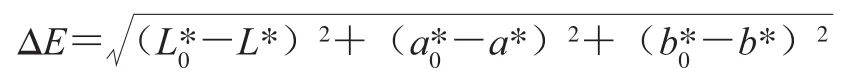
式中:L*、a*、b*分别为贮藏期间汤汁的色度值;分别为装罐前汤汁的色度值。
1.3.2.4 表观黏度曲线绘制
参照Augusto等[13]的方法,并稍作修改。流变仪选取筒转子,运用水循环系统控制测定温度为(25±1)℃。取4 mL汤汁置于筒转子中,在稳态剪切模式下进行测定。设置剪切速率由0.01 s-1增加到100 s-1,记录该剪切速率范围内表观黏度随剪切速率的变化并绘制曲线。
1.3.2.5 渗透压测定
分别采用纯水、300 mOsm/kg和850 mOsm/kg氯化钠标准液对冰点渗透压仪进行精准校准后,取贮藏期汤汁50 μL于干燥的一次性测试管中进行测定[14]。
1.3.2.6 汤汁水溶性果胶含量测定
取罐藏黄桃汤汁150 mL,用柠檬酸调节pH值至2.5,80 ℃加热2 h,不停搅拌,冷却后50 ℃旋转蒸发至75 mL,按体积比1∶4加入无水乙醇,充分搅拌后,室温过夜得到絮状物,10 000 r/min离心15 min,弃上清液,将沉淀加适量蒸馏水溶解,透析,冻干得到汤汁水溶性果胶(water soluble pectin in syrup,SWSP)[15]。
SWSP含量的测定参考Blumenkrantz等[16]的方法,采用比色法进行测定。取0.6 mL水解后的样品至试管中,在冰水浴中加入3.6 mL硫酸-四硼酸钠溶液。漩涡振荡充分混匀后,100 ℃水浴中加热5 min。反应结束后立即置于冰水浴中冷却至室温。向试管中加入60 μL间羟基联苯溶液,混合1 min,于520 nm波长处测定吸光度。配制D-半乳糖醛酸标准溶液,绘制标准曲线(y=0.006x+0.038 4,R2=0.999 8)。SWSP含量以每克果胶中含D-半乳糖醛酸质量表示,单位为mg/g。
1.3.3 罐藏黄桃果肉质构的测定和形态观察
1.3.3.1 质构测定
采用物性分析仪TPA模式测定罐藏黄桃果肉硬度、咀嚼性、回复性、弹性、凝聚性等质构特性[17],取形状、大小一致的黄桃样品,切取10 mm×10 mm×10 mm大小的果块,重复测定10 次。预压速率、下压速率、上行速率均为1 mm/s,压缩程度60%,停留间隔5 s,数据采集速率200 pps,触发力5 kg,探头为P/36。
1.3.3.2 扫描电子显微镜观察
将罐藏黄桃样品切成4 mm×4 mm×4 mm大小的果块,置于体积分数4%戊二醛溶液(室温)固定1~4 h,真空抽气0.5 h,0.1 mol/L磷酸盐缓冲液清洗3 次,每次20 min;体积分数1%锇酸溶液固定4 h,0.1 mol/L磷酸盐缓冲液清洗3 次,每次20 min;梯度乙醇溶液(体积分数依次为50%、70%、95%)脱水,乙酸异戊酯置换乙醇。将待测样品平铺于双面粘有导电胶的载物台上,喷金镀膜后观察微观结构[18],放大倍数为100。
1.3.3.3 光学显微镜观察
选用半薄切片技术,将罐藏黄桃果肉切块用福尔马林-乙酸-乙醇(5∶5∶90,V/V)固定1~4 h,真空抽气0.5 h,0.1 mol/L磷酸盐缓冲液清洗2 次,每次停留15 min,体积分数1%锇酸固定1~2 h,0.1 mol/L磷酸盐缓冲液清洗2 次,每次停留15 min;室温条件下,分别用体积分数50%、70%、95%乙醇溶液脱水,每次停留15 min;用体积比1∶1丙酮和环氧树脂混合液为包埋剂将样品渗透4 h,换新鲜包埋剂过夜;用新配制的包埋剂包埋样品,在70 ℃下聚合8 h;修整包埋块,在超薄切片机上用玻璃刀制片,将制得的5 μm的半薄切片置于载玻片上,用带照相机的光学显微镜观察[19],放大倍数为20。
1.4 数据统计与分析
实验重复测定3 次,结果以平均值±标准差表示。采用SPSS 22.0统计软件进行数据分析和Person相关性分析,采用Origin 2018软件作图。用Duncan多重法进行显著性差异比较,P<0.05表示差异显著。
2 结果与分析
2.1 贮藏过程中罐藏黄桃汤汁pH值、TSS含量及浊度变化
贮藏过程中罐藏黄桃汤汁pH值、TSS含量、浊度变化如表1所示。贮藏过程中汤汁上层、中层、下层的pH值均未发生显著变化,范围分别为3.53~3.68、3.46~3.68、3.46~3.70,且不同取样位置的汤汁pH值无显著差异;汤汁TSS含量先下降后趋于稳定,变化范围分别为13.80~14.77、13.83~14.63、13.87~14.37oBrix,且不同取样位置的汤汁TSS含量无显著差异,这与Maresca等[20]的研究结果一致。随贮藏时间延长,罐藏黄桃汤汁浊度显著增加,其中下层汤汁浊度变化最为显著(从贮藏0 d的3.81增加到贮藏90 d的5.24),可能是由于贮藏期间果肉软化降解,部分物质溶出并在重力作用下进入汤汁下层。贮藏期间,由于罐藏黄桃处于高渗透压的蔗糖汤汁中,细胞膜内外渗透压力差的存在使黄桃果肉中的水分及可溶性物质渗出,同时蔗糖小分子物质扩散至果肉中;贮藏后期,水分及可溶性物质的扩散速率会趋于动态平衡[21]。
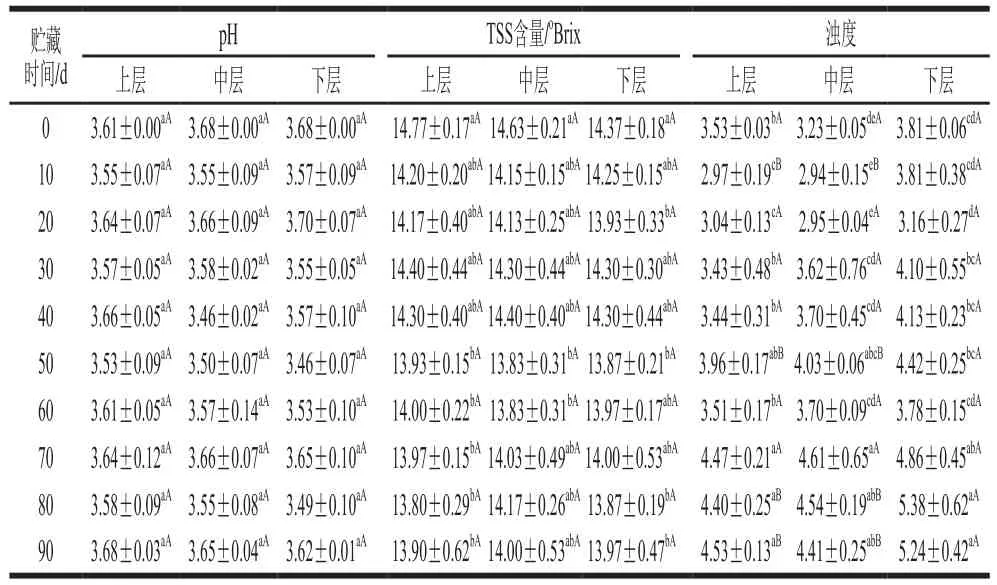
表1 贮藏过程中罐藏黄桃汤汁pH值、TSS含量及浊度的变化Table 1 Changes in pH, TSS content and turbidity of canned yellow peach syrup during storage
2.2 贮藏过程中罐藏黄桃汤汁色泽的变化
贮藏期间汤汁色泽参数测定结果如表2和图1所示。同一贮藏时间不同取样位置罐藏黄桃汤汁的色泽参数(L*、a*、b*值和ΔE)均无显著差异。随着贮藏时间的延长,汤汁L*值先呈下降趋势,贮藏至70 d时趋于平缓;a*值呈显著下降趋势;b*值则呈显著增加趋势。ΔE表示贮藏期间实验样品和装罐前汤汁之间的色泽偏差,ΔE越大表示色泽偏差越大。随着贮藏时间(10~90 d)的延长,罐藏黄桃汤汁ΔE呈逐渐增大趋势(0.88~1.87),特别地,贮藏30 d后,ΔE上升迅速,至70 d后逐渐趋于平稳。热杀菌环节可能会导致黄桃果肉细胞轻微破坏和分离,贮藏过程中渗透压使果肉组织膨压改变,引发细胞膨胀和破坏,果肉中的黄色素被释放,汤汁b*值增加[22];贮藏过程中美拉德反应的缓慢发生以及汤汁中的蔗糖分子与黄桃果肉中的可溶性或不溶性物质发生交换都可能是导致汤汁ΔE发生较大改变的原因[23]。
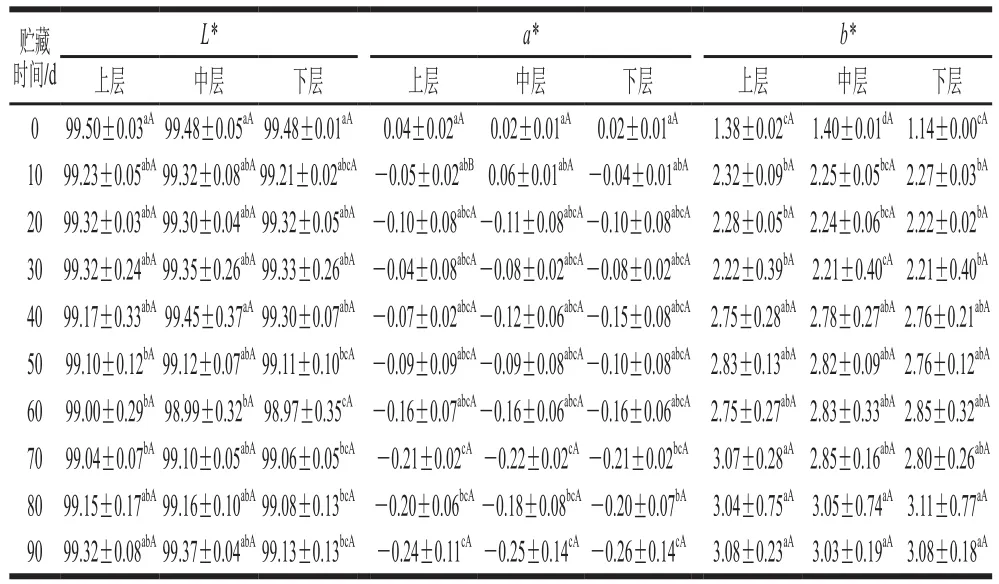
表2 贮藏过程中罐藏黄桃汤汁色泽的变化Table 2 Changes in color parameters of canned yellow peach syrup during storage

图1 贮藏过程中罐藏黄桃汤汁ΔE的变化Fig. 1 Changes in color difference of canned yellow peach syrup during storage
2.3 贮藏过程中罐藏黄桃汤汁表观黏度的变化
贮藏期间罐藏黄桃汤汁的表观黏度结果如图2所示。随着剪切速率升高,汤汁的表观黏度逐渐降低,呈现剪切变稀的流体特性。在0.01~1 s-1的剪切速率下,随着剪切速率增大,汤汁不同位置的表观黏度均呈下降趋势;在1~100 s-1的剪切速率下,汤汁黏度趋于平稳。随着剪切速率增大,黄桃果肉扩散到汤汁中的大分子物质(如果胶等)的结构被破坏,从而导致汤汁黏度下降[24]。随着贮藏时间的延长,汤汁不同位置的表观黏度均呈现上升趋势,下层汤汁表观黏度略低于上、中层汤汁,可能是由于桃瓣在高浓度的糖液中处于上浮的状态;在重力作用下,桃果肉中渗出到汤汁中的固形物会向下移动,汤汁下层与桃瓣间距较大,导致下层汤汁黏度低于上中两层汤汁;此外,黄桃果肉细胞内外浓度梯度的差异,促使果肉组织内SWSP等具有胶体溶液性质的物质迁移到汤汁中,同时汤汁中的蔗糖由于含有亲水性的羟基结构,在溶液中易结合水分子,发生水合作用,会降低游离水含量进而诱导果胶等大分子物质发生聚集,使汤汁黏度增加[25]。可以初步推测细胞内或者细胞间物质溶出是罐藏黄桃质构发生软化的原因之一。
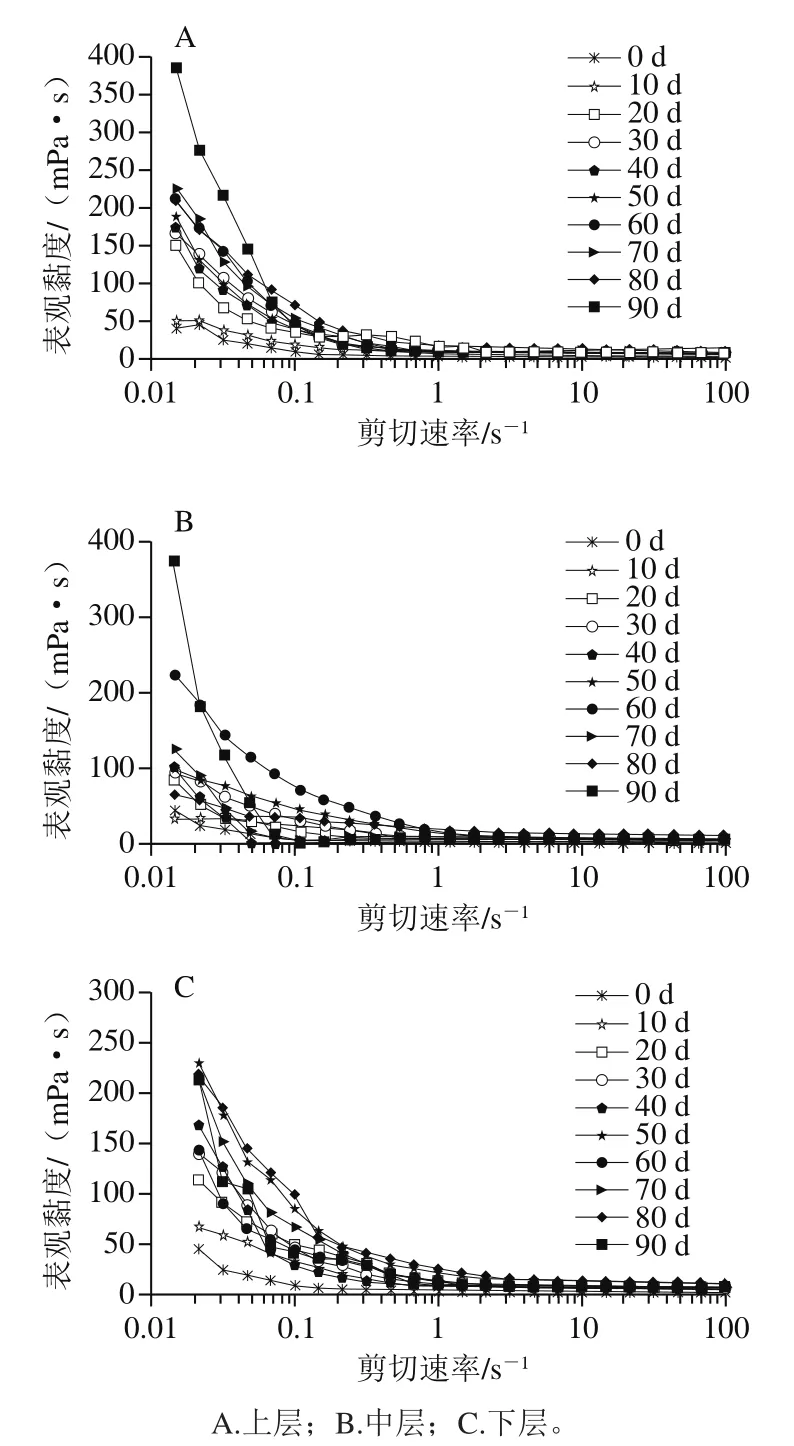
图2 贮藏过程中罐藏黄桃汤汁表观黏度的变化Fig. 2 Changes in apparent viscosity of canned yellow peach syrup during storage
2.4 贮藏过程中罐藏黄桃汤汁渗透压的变化
如图3所示,贮藏期间上层、中层、下层汤汁渗透压变化范围分别为506~922、504~922、517~930 mOsm/kg。同一贮藏时间不同取样位置的汤汁渗透压差异不显著,表明不同取样位置的汤汁特性基本保持一致。随着贮藏时间的延长,汤汁渗透压呈现逐渐上升趋势,贮藏50 d后趋于平缓。黄桃组织细胞内部液相和外部汤汁溶液之间呈现出的水化学势差异会促进水的扩散[26],同时由于前期的预煮或杀菌会诱导细胞内部结构发生一定程度的降解,黄桃内部的小分子成分(如葡萄糖、果糖等)会扩散进入汤汁中,使汤汁渗透压升高。随着贮藏时间的延长,黄桃组织表层细胞壁物质发生降解并扩散至外部溶液,同时内部组分发生轻微脱水或不再变化,最终与外部溶液达到动态平衡。
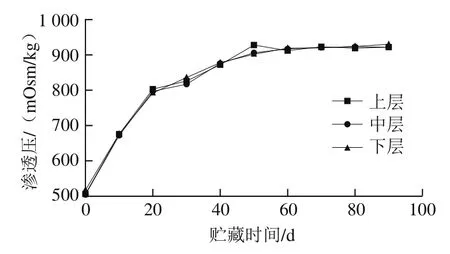
图3 贮藏过程中罐藏黄桃汤汁渗透压的变化Fig. 3 Changes in osmotic pressure in canned yellow peach syrup during storage
综合汤汁特性结果分析可知,贮藏期间汤汁特性发生了显著变化,随着贮藏时间的延长,罐藏黄桃细胞组织内外物质交换达到平衡,汤汁特性维持稳定。值得注意的是,同一贮藏时间不同取样点(上、中、下层)汤汁特性无显著差异。可以认为,汤汁与黄桃细胞组分之间的传质是均匀的,可不再通过分层取样来测定罐藏黄桃质构等特性。
2.5 贮藏过程中罐藏黄桃汤汁SWSP含量的变化
贮藏过程中罐藏黄桃汤汁SWSP含量变化如图4所示,随着贮藏时间的延长,SWSP含量呈增加趋势,贮藏50 d后SWSP含量趋于稳定,这与贮藏期间汤汁渗透压等变化趋势基本一致(图3)。贮藏前期蔗糖汤汁渗透压诱导黄桃果肉细胞膨胀压改变,减弱了果胶物质与细胞壁的氢键连接作用,促使部分果胶降解溶出[27];贮藏期间,水和溶质的交换以及果胶等细胞壁物质的溶出使细胞网状结构内部的黏附力和支撑力遭到进一步破坏,组织结构发生一定程度的坍塌,促使更多果胶物质溶出,直至传质过程达到平衡。
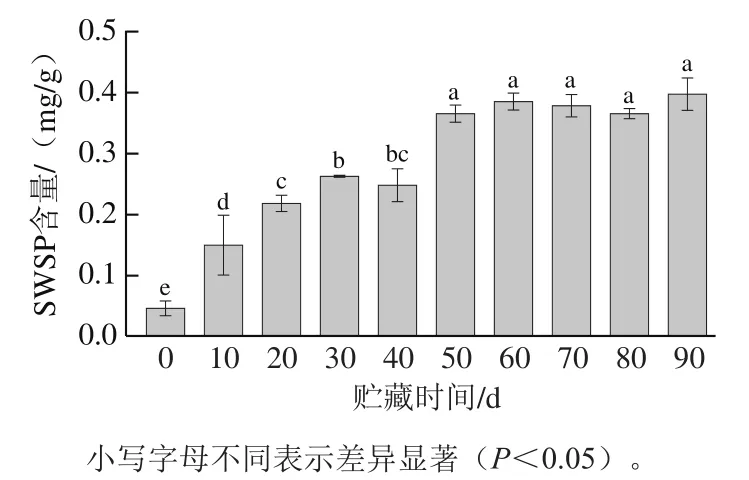
图4 贮藏过程中罐藏黄桃汤汁SWSP含量的变化Fig. 4 Changes in SWSP content of canned yellow peach syrup during storage
2.6 贮藏过程中罐藏黄桃果肉质构特性的变化
由表3可知,罐藏黄桃贮藏初期(10~30 d)的硬度、回复性均高于贮藏0 d的样品;随着贮藏时间的延长,罐藏黄桃硬度、咀嚼性和回复性呈现显著降低趋势,并于贮藏后期趋于稳定状态。贮藏期间罐藏黄桃果肉的弹性和凝聚性下降趋势缓慢。贮藏初期,蔗糖汤汁与黄桃细胞内部的渗透压力差产生了较大的驱动力,促进溶质快速扩散交换,从而实现罐藏黄桃较高的固形物获得量[28],促使其硬度增加。随着贮藏时间的延长,溶质进一步扩散交换,蔗糖的渗入可能诱导黄桃果肉果胶发生β-消除反应,诱导细胞壁多糖间的结合力下降,细胞组织结构进一步被破坏,表现为果肉软化[29]。
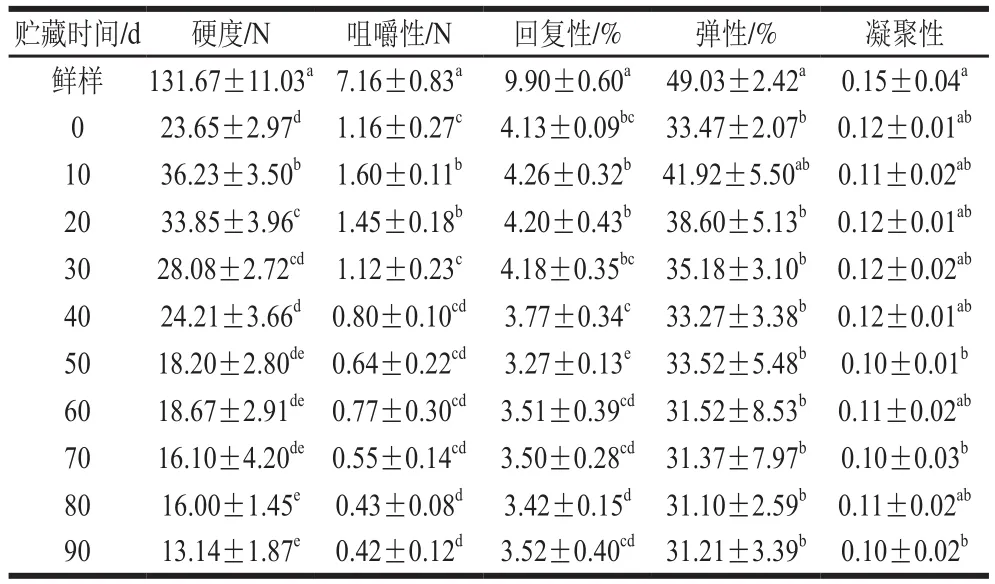
表3 贮藏过程中罐藏黄桃果肉质构特性的变化Table 3 Textural evolution of canned yellow peach flesh during storage
2.7 贮藏过程中罐藏黄桃果肉微观结构的观察结果
如图5所示,新鲜黄桃果肉细胞形态规则饱满、排列紧密,细胞壁完整,形状近似椭圆形,孔隙均匀而致密。杀菌热力作用下,细胞发生形变、细胞间隙增加。随着贮藏时间的延长,细胞间隙进一步增加、细胞形变严重,部分细胞坍塌,呈现不规则状态。渗透压力作用下,黄桃果肉脱水、细胞膨压改变,导致细胞膜脂质、中胶层(果胶)降解,细胞壁结构破坏,细胞间黏合力降低,诱导细胞发生形变、间隙增加,甚至出现破裂[30]。


图5 贮藏过程中罐藏黄桃果肉微观结构的变化Fig. 5 Changes in microstructure of canned yellow peach flesh during storage
2.8 罐藏黄桃果肉质构特性与汤汁特性相关性分析结果
如图6所示,罐藏黄桃果肉质构,特别是硬度、回复性、凝聚性、咀嚼性与b*值、浊度、渗透压、SWSP含量均呈显著负相关;果肉硬度、咀嚼性与L*值和a*值呈显著正相关;汤汁渗透压与b*值、浊度、SWSP含量均呈显著正相关。贮藏过程中,黄桃果肉细胞内外的压力差是促进汤汁溶质(蔗糖分子)扩散和流动的主要驱动力,也是导致果肉细胞形变、物理化学特性改变的重要原因,宏观表现为果肉感官和质构品质的变化。可以推测,通过调控汤汁特性,如降低果肉与汤汁之间的渗透压、抑制果胶等物质溶出可以有效改善贮藏期间罐藏黄桃质构品质。
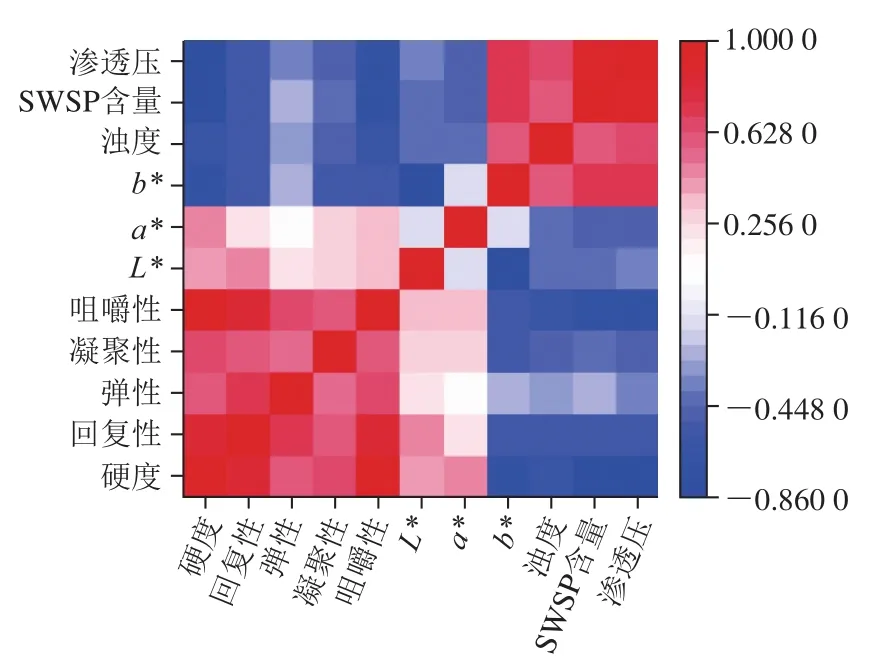
图6 罐藏黄桃果肉质构特性与汤汁特性相关性分析Fig. 6 Correlation analysis between flesh texture and syrup characteristics of canned yellow peaches
3 讨 论
实验结果表明,罐藏黄桃汤汁pH值、TSS含量在同一贮藏时间、不同取样位置无显著差异,随着贮藏时间的延长,汤汁pH值保持稳定,TSS含量、表观黏度、L*值和a*值先呈现下降趋势,在贮藏后期趋于平缓;汤汁浊度、b*值、ΔE、渗透压、SWSP含量在贮藏期间呈现上升趋势,贮藏后期趋于平缓。罐藏黄桃质构参数在贮藏期间均呈下降趋势,其中硬度和咀嚼性显著降低。果肉微观结构分析结果表明,随着贮藏时间的延长,果肉细胞发生不规则形变,细胞间隙增加、甚至坍塌,可以解释罐藏黄桃宏观质构的软化现象。汤汁特性与罐藏黄桃果肉质构参数呈现显著相关性,贮藏过程中,黄桃果肉与汤汁形成的渗透压力差是诱导传质的主要驱动力,水分和可溶性组分的扩散交换能够改变果肉细胞的微观结构,降低果肉细胞壁的支撑力和黏附力,宏观表现为罐藏黄桃果肉质构软化。综上,汤汁特性是罐藏黄桃果肉软化的重要影响因素。汤汁的水分活度与黄桃果肉的水分活度相差越大,二者之间形成的渗透压力差越大,其中水分和可溶性组分的扩散交换程度越高[31],也越易导致黄桃果肉软化的发生。汤汁溶质的自然属性,如分子质量、浓度,是影响水分活度和渗透压的重要因素[32]。目前工业生产多采用蔗糖作为汤汁用糖,可以通过调整汤汁用糖的种类、浓度等方式来改善罐藏黄桃的质构品质。
