HBsAg+/HBV-DNA-献血者的HBsAg确证及归队检测分析
2021-07-29任本春周晓真卓孝福
任本春,周晓真,卓孝福
(福建省血液中心,福建 福州 350004)
采供血机构为阻止HBV输血传播,对病毒标志物HBsAg和HBV-DNA进行筛查。HBsAg是HBV感染后的特异性血清学标志物,检测方法通常为酶联免疫吸附试验(ELISA)。由于ELISA可因cut-off设置、内源性以及外源性因素干扰而造成HBsAg假阳性[1],HBsAg ELISA试剂盒说明书提出,对检测结果反应性标本,应行中和确认试验进行确证,以排除可能的假阳性。与电化学发光法、化学发光法比较,ELISA仍可筛查出绝大部分HBsAg阳性献血者[2];中和确认试验是HBsAg确证试验,可作为判断HBsAg是否真阳性的参考标准。HBV-DNA是HBV感染4-5周后,可在血液中检出的标志物,检测方法一般包括PCR和TMA。HBV-DNA检测不仅可以缩短HBV感染窗口期,还可以检出隐匿性HBV感染(OBI)[3-6]。有些HBV感染者血液只存在HBsAg等血清学标志物,不存在或存在极低载量HBV-DNA,ELISA和NAT平行检测时,可出现HBsAg+/HBV-DNA-结果,但经过一段时间仍有部分献血者转为显性HBV感染,转变为HBsAg+/HBV-DNA+[7,8]。此外,在献血者屏蔽和归队管理工作中,会对HBsAg+/HBV-DNA-献血者进行归队检测,根据归队检测结果,评估献血者是否恢复献血资格。
为了解HBsAg+/HBV-DNA-、HBsAg可疑结果/HBV-DNA-(ELISA检测S/CO值在0.900-0.999)献血者其HBsAg的S/CO检测值与中和确认试验结果之间关系以及HBsAg+/HBV-DNA-献血者归队检测情况,探讨HBsAg+/HBV-DNA-献血者HBsAg确证的必要性及其归队策略,本研究收集两种标本⑴HBsAg+/HBV-DNA-标本,⑵HBsAg可疑结果/HBV-DNA-标本,对其进行HBsAg中和确认试验,并对HBsAg S/CO检测值、中和确认试验结果以及部分HBsAg+/HBV-DNA-献血者归队检测资料进行统计、分析,报告如下。
1 材料与方法
1.1 样本来源2014年1月-2017年3月在本中心无偿献血者269421名(次),每位献血者均抽2管标本,1管EDTA-K2抗凝真空采血管抽取5 ml用于酶免检测,1管EDTA-K2抗凝真空采血管抽取8ml用于核酸检测。HBsAg中和确认试验采用HBsAg+/HBV-DNA-及HBsAg结 果 可 疑/HBVDNA-献血者样本血浆,在-80℃保存。归队体检标本为HBsAg+/HBV-DNA-献血者后续归队留取,采集标本程序同献血者标本,用于ELISA/NAT平行检测。
1.2 试剂与仪器HBsAg试剂盒由DiaSorin S.p.A.UK branch提供。HBsAg中和确认试验试剂由DiaSorin S.p.A.UK branch Murex提供。核酸联合单人份检测试剂及HBV-DNA、HCV-RNA、HIV-RNA鉴别试剂盒由西班牙Grifols公司提供。ELISA法所用试剂均为国家批批检合格且均在有效期内使用。HBsAg质控物质由康彻斯坦生物公司提供,浓度为0.2 IU/ml。HBV-DNA标准物质由康彻斯坦生物公司提供,浓度30IU/ml。全自动加样系统MICROLAB STAR和酶免反应设备Micro Lab FAME均由瑞士Halmiton公司提供,核酸检测设备Procleix TIGRIS System由西班牙Grifols公司提供。
1.3 检测方法
1.3.1 HBsAg与病毒核酸筛查 所有标本采用平行ELISA/NAT检测模式。HBsAg采用ELISA检测。NAT采用转录介导的核酸扩增技术(TMA),采用HBV-DNA、HCV-RNA和HIV-RNA病毒联合单人份检测,反应性标本需进行鉴别试验,以区分感染病毒类别。
1.3.2 HBsAg中和确认试验 将所保存的标本复融后,进行中和确认试验。对每一标本,在HBsAg诊断试剂盒的微孔板上设置对照孔和特异孔。在对照孔和特异孔分别加入不含抗-HBs的特异性抗体试剂和样本进行反应。特异孔中的特异性抗体和微孔板中的固相抗-HBs抗体竞争样本中的HBsAg,从而使结合到微板上的HBsAg量减少;而对照孔因不存在竞争,样本中的量正常结合到微孔板,随后按HBsAgELISA诊断试剂盒使用说明书进行测定。
1.3.3 病毒核酸鉴别试验 将核酸筛查反应性标本进行HBV-DNA、HCV-RNA和HIV-RNA鉴别试验,以准确区分感染病毒类别。鉴别试验结果为HBV-DNA阳性,方可确定为HBV-DNA阳性。如果鉴别结果均为阴性,定义为不确定性。
1.3.4 归队检测HBsAg+/HBV-DNA-归队献血者按照献血者标本采集程序采集血样进行常规血清学筛查、核酸筛查以及核酸鉴别试验。
1.3.5 结果判定HBsAg S/CO值<0.9为无反应性,判为合格。S/CO值≥1为反应性,判为不合格。S/CO值在0.900~0.999之间,结果判为可疑。判为可疑结果标本进行双孔复查,两孔S/CO值均小于0.9为无反应性,只要其中1孔为反应性或可疑均判为不合格。HBsAg中和确认试验按试剂说明书要求计算中和率,以中和率50%为确证阳性。NAT试验为HBV、HCV、HIV联合单人份检测,OD值≥cut-off值判断为有反应性,经鉴别试验后区分HBV-DNA、HCV-RNA、HIV-RNA。
1.3.6 质量控制 每天进行室内控制。HBsAg质控品随同标本检测,质控值>均值-3SD试验有效。NAT检测按照试剂说明书判读结果的有效性。
1.4 统计学分析 应用SPSS20.0统计学软件对实验数据进行统计、分析,绘制ROC曲线,计算ROC曲线下面积(AUC),以AUC>0.9认为诊断有准确性。组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 HBsAg、HBV-DNA检出情况 在2014年1月-2017年3月期间检出HBsAg+/HBV-DNA-献血者标本499例,检出率为0.185%(499/269421);检出HBsAg结果可疑/HBV-DNA-献血者标本62份,检出率为0.023%(62/269421)。
2.2 HBsAg+/HBV-DNA-献血者HBsAg中和确认试验结果 对499例HBsAg+/HBV-DNA-献血者标本进行中和确认试验,确证阳性346例,确证阳性率为69.3%,假阳性率30.7%。以HBsAg中和确认试验结果为诊断参考标准,对ELISA检测的S/CO值进行分组,各组中和确认试验确证阳性率随S/CO值增加而增高,其阳性率从7.5%升高到91.2%,见表1。
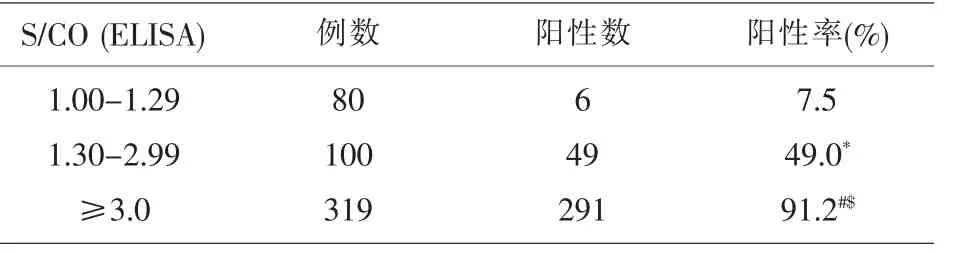
表1 499例HBsAg+/HBV-DNA-献血者HBsAg中和确认试验确证结果
2.3 HBsAg结果可疑/HBV-DNA-献血者标本中和确认试验结果 对62例HBsAg结果可疑/HBVDNA-献血者标本进行HBsAg中和确认试验,除2例为确证阳性之外,其余60例结果为阴性。
2.4 ROC曲线绘制 将ELISA S/CO值及中和确认试验结果导入SPSS20.0,进行ROC曲线分析,ROC线下面积(AUC)为0.934,以AUC>0.9认为诊断有准确性。Youdeng指数取最大时最佳截断CO值(S/CO)为1.60,比试剂厂家推荐的CO值高。最佳截断CO值时其灵敏度为95.4%,特异性为80.6%,见图1。

图1 S/CO ROC曲线
2.5 归队检测结果86例HBsAg+/HBV-DNA-献血者参加归队检测,2.4%(2/86)献血者检测结果由HBsAg+/HBV-DNA-转为HBsAg+/HBV-DNA+,67.4%(58/86)献血者检测结果由HBsAg+/HBVDNA-转为HBsAg-/HBV-DNA-,30.2%(26/86)献血者检测结果保持HBsAg+/HBV-DNA-不变。2例献血者HBV-DNA阳转情况,见表2。

表2 2例HBsAg+/HBV-DNA-转为HBsAg+/HBV-DNA+的献血者情况
3 讨论
HBV可经血液和血制品传播,是我国《血站标准操作规程》规定的强制检验项目,可采用ELISA、化学发光法筛查HBsAg及NAT筛查HBV-DNA。ELISA筛查HBsAg由于操作简单、敏感性高、成本低廉,适用于大批量标本,但也受方法学、内外源干扰因素的影响,可造成假阳性。刘孙琴[9]等报告HBsAg反应性标本必须经中和确认试验确证后方可报告HBsAg阳性。WHO颁布的《筛查献血者血液经输血传播感染的建议书》,要求血站实验室开展筛查和确认试验,分别用于血液筛查和献血者管理[10]。
2014年1月-2017年3月检出499例HBsAg+/HBV-DNA-献血者标本,检出率为0.185%(499/269421),经HBsAg中和确认验后,确认HBsAg真阳性346例,确证阳性率69.3%。这提示:⑴即使HBV-DNA检测阴性,如果不进行HBsAg检测,仍有相当部分献血者存在HBV漏检可能。因此应重视血清学HBsAg检测,⑵对于弱反应性S/CO值在1.0~1.29和1.30~2.99献血者标本,中和确认试验确证阳性率分别为7.5%,49.0%,HBsAg假阳性率分别为92.5%、51.0%。这些弱反应性献血者如果未进行中和确认试验,采供血机构会将这些献血者永久屏蔽,这不但会造成献血者流失,还会给其带来心理压力,引起抱怨和投诉,不利于血液事业的可持续发展。因此,我们认为,实验室应不断优化实验室质量管理体系,从人、机、料、法、环方面着手,制定科学的SOP,加强工作人员培训,对设备定期进行有效的维护和校准,使用前对试剂进行科学的性能评价、选择灵敏度和特异性高的HBsAg酶免试剂盒,加强检测前标本质量控制,减少标本凝块、溶血和标本污染产生,在提高检测准确性时尽量减少假阳性产生。HBsAg中和确认试验是以HBsAg酶免筛查反应性的血液标本进行的确证实验,可以满足献血者管理的需要。对于存在非特异性或生物学假阳性筛查结果应向献血者解释说明,劝其推迟献血或回归进一步随访,然后根据随访结果,做出永久屏蔽献血或可再次献血的决定。
62例HBsAg结果可疑献血者中,2例被确证为阳性。对于这类低于cut-off值一些的标本,各个实验室中和确认试验结果不一。李雪梅[11]等在46份科华试剂检测的HBsAg灰区(S/CO值0.8-1.0)标本经中和确认试验后确证2例阳性,王瑞[12]在44例灰区献血者标本(S/CO值在0.900-0.990)进行中和确认试验,结果均为无反应性。由于中和试验本身可能具有的方法学上的缺陷,加上本次2例阳性结果未进行其它检验方法和血清标志物验证及追踪检测,故仅凭中和确认试验结果无法确定其是否为HBV感染携带者。根据朱为刚等[13]研究,HBsAg浓度0.5ng/ml以下的检出率为0.27%;也有研究认为,部分血清HBsAg处于低水平状态,忽视弱反应性结果,尤其是阳性分界cut-off值以下的结果会造成人群的漏检[14];从理论上分析,一些真阳性标本其真实值S/CO为1,但由于试剂、设备、操作、环境等因素影响,检测的S/CO值出现大于1或小于1的概率为50%,真阳性标本可能发生漏检;因此对低于cut-off值一些的标本,各实验室可根据具体情况用其它方法或检测其它血清学标志物进行验证[15]。
以HBsAg中和确认试验结果为诊断参考标准,ELISA为诊断试验,绘制的ROC线下面积(AUC)为0.934,以AUC>0.9认为诊断有准确性,可以认为ELISA检测HBsAg准确性较高。利用ROC曲线最佳cut-off值(S/CO=1.6)来判定ELISA检测结果时,特异性为80.6%,灵敏度为95.4%,但会有15份S/CO小于1.6、中和确认试验阳性的标本被判断为无反应性,这可能导致阳性标本漏检。使用厂家推荐的cut-off值为诊断分界值时,灵敏度为99.4%,特异性为28.2%,其灵敏度提高,特异性降低,导致假阳性标本数量增多,影响试验的整体性能。由于血站实验室以筛检为目的,应尽可能检出HBV感染的献血者,若以厂家推荐cut-off值来判定有无反应性标准,虽可导致部分假阳性,但也可保证血液安全,降低经血传播HBV感染机会。
对86例HBsAg+/HBV-DNA-献血者归队检测结果表明,仅有2.4%(2/86)HBsAg+/HBV-DNA-献血者转为HBsAg+/HBV-DNA+,低于张宏[7]在30例HBsAg+/HBV-DNA-献 血 者 中 有13例 转 为 显 性HBV感染(HBsAg+/HBV-DNA+)的比例,也低于黄成垠等[8]报道的50%(4/8例)阳转比例。对于HBsAg+/HBV-DNA-检测结果可认为此时血液中存在HBV表面外壳蛋白,不存在或存在极低载量的HBV-DNA,以致高灵敏度的核酸扩增方法呈阴性。本研究中2例HBV-DNA阳转若排除了非特异性或假阳性因素,造成HBV-DNA阳转的原因可能为机体免疫功能下降,HBV-DNA再次复制所致[16]。值得注意的是,由表2可知,2例发生HBV-DNA阳转的献血者其HBsAg S/CO=1附近波动,提示HBV-DNA阴性、HBsAg S/CO=1附近波动的献血者也可发生HBV-DNA阳转,应引起重视。本研究中67.4%(58/86)献血者检测结果由HBsAg+/HBVDNA-转为HBsAg-/HBV-DNA-,成为HBV感染康复献血者。因此对于血液筛查结果为HBsAg+/HBVDNA-的献血者,其献血资格是否保留或淘汰需谨慎判断,以本研究结论倾向于对这类献血者进行归队检测,若归队检测合格,可恢复其献血资格。
综上所述,由于NAT检测HBV-DNA存在缺陷,存在漏检可能,因此NAT与ELISA检测呈互补作用,血站应强制筛查HBsAg。在选择HBsAg试剂时,要考虑血站实验室是以筛检为目的的检出要求,应尽可能检出HBV感染献血者,因此要选择灵敏度和特异度都较高的试剂。ELISA筛查HBsAg存在假阳性,出现HBsAg+/HBV-DNA-检测结果时有必要对献血者进行HBsAg中和确认试验,根据确证结果对献血者进行合理的解释,从而有利于献血者的管理。此外,HBsAg+/HBV-DNA-献血者可参加归队检测,根据归队检测结果评估是否恢复献血资格。
