吉西他滨治疗HER-2 阴性转移性乳腺癌疗效的影响因素
2021-07-29曹越越潘跃银
曹越越,潘跃银,2
(1.安徽医科大学附属安徽省立医院肿瘤内科,安徽 合肥 230001;2.中国科学技术大学附属第一医院肿瘤内科,安徽 合肥 230001)
乳腺癌(breast cancer)是女性最常见的恶性肿瘤,自20 世纪70 年代至今全球乳腺癌发病率逐年攀升,也是最常见的女性因癌死亡原因之一[1,2]。乳腺癌患者中约有10%的患者在确诊时即有远处转移,早期患者虽经积极有效治疗,仍有约30%的患者会出现复发或转移。转移性乳腺癌临床无法治愈[3],治疗目的是延长患者生存期和改善患者生活质量。现阶段,转移性乳腺癌的治疗原则是以内科治疗为主的综合治疗,治疗策略应主要基于以下因素制定,包括雌激素受体(estrogen receptor,ER)表达情况、孕激素受体(progesterone receptor,PR)表达情况,人表皮生长因子受体2(human epidermal growth factor 2,HER-2)表达情况,Ki-67 指数,肿瘤负荷(包括远处转移的部位和数量)和既往接受治疗情况等[4]。受益于近年来抗HER-2 靶向疗法的发展,HER-2 阳性乳腺癌患者在个体化精准治疗方案的应用下生存时间得到了显著延长,而对于HER-2阴性的转移性乳腺癌患者,根据NCCN、ESMO 转移性乳腺癌指南、中国抗癌协会乳腺癌诊治指南等在内的国内外多项权威指南,无论激素受体表达情况如何,化疗依然是其治疗中不可或缺的基础治疗手段。吉西他滨是一种胞嘧啶核苷衍生物,作用于DNA 合成期,对肿瘤细胞的复制有着明显的破坏作用[5]。多项指南均推荐吉西他滨作为单药使用,亦可与紫杉醇或卡铂联合使用治疗晚期乳腺癌[6]。目前,吉西他滨单药或联合化疗方案已在本中心广泛应用于转移性乳腺癌的治疗,但患者对吉西他滨的疗效反应差异明显。因此,吉西他滨的用药方法和用药时机亟待优化,本研究旨在探究患者年龄、转移部位、既往治疗方案、激素受体表达情况等临床病理特征对吉西他滨疗效的影响,分析吉西他滨在不同治疗线数和不同用药方法时疗效是否存在差异,现将结果报道如下。
1 资料与方法
1.1 一般资料 收集2015 年5 月~2020 年5 月在安徽医科大学附属安徽省立医院治疗的所有诊断为乳腺癌的患者。研究方案经安徽医科大学附属安徽省立医院伦理委员会根据1964 年赫尔辛基宣言(及后续修订案)批准(伦理编号:2020-P-070)。
1.2 纳入与排除标准 纳入标准:①年龄≥18 岁,女性,经组织学或细胞学病理诊断确认为乳腺癌,临床分期为Ⅳ期;②患者原发肿瘤免疫组织化学结果为HER-2 阴性/1+/2+和/或通过荧光原位杂交双探针检测判定为HER-2 阴性;③患者的东部肿瘤协作组体力状态评分为0~2 分;④患者有可测量的复发或转移性病灶;⑤患者按照目前治疗指南推荐剂量和频次接受含吉西他滨的治疗方案,包括单药和联合用药方案;⑥患者在接受吉西他滨初次治疗前及治疗期间每2~3 周期均有明确的影像学资料(CT、MRI、PET-CT 等)用于评估治疗效果。排除标准:①患者有其他器官的原发性恶性肿瘤病史;②患者有血液系统疾病、自身免疫系统疾病病史;③其他研究者认为不适合纳入研究的情况。
1.3 方法 收集患者临床资料,包括初次使用吉西他滨的年龄,是否有肺、肝、脑、骨、胸壁、内脏等部位转移;疾病病理特征,包括原发肿瘤的ER 表达情况,PR 表达情况,Ki-67 指数;既往治疗情况,包括是否接受过蒽环类药物、紫杉烷类药物治疗,是否接受过辅助放射治疗;吉西他滨的用药线数,单药或联合治疗方案等信息。所有患者自接受吉西他滨治疗后,每21 天进行1 次院内随访直至2020 年5 月31 日。研究终点是无进展生存期(progression-free survival,PFS),定义为转移性乳腺癌患者从接受吉西他滨治疗开始,到评估疾病进展或者因为任何原因的死亡之间的时间。
1.4 观察指标 分析患者一般资料,比较不同初次接受吉西他滨治疗时的年龄(<50 岁和≥50 岁)、不同雌孕激素受体表达情况(阴性和阳性)、Ki-67 指数(<30%和≥30%)、远处转移的部位(肺转移、肝转移、脑转移、骨转移、胸壁转移、内脏转移)、吉西他滨用药方案(单药和联合用药)、吉西他滨用药线数(一线方案、二线方案、三线及以后方案)对治疗效果的影响。
1.5 评价标准 根据原发肿瘤免疫组织化学染色结果中ER、PR 表达情况将患者分为阴性表达组(<1%)和阳性表达组(≥1%)。根据Ki-67 指数提示的肿瘤侵袭能力将患者分为<30%和≥30%组。疗效评价依照实体瘤疗效评价标准1.1 版分为:完全缓解(complete response,CR),所有目标肿瘤病灶完全消失;部分缓解(partial response,PR),所有目标肿瘤病灶最大径之和低于基线≥30%;疾病进展(progressive disease,PD),所有肿瘤病灶最大径之和增加≥20%,出现一个或多个新发的肿瘤病灶也视为疾病进展;疾病稳定(stable disease,SD),所有肿瘤病灶最大径之和缩小未达PR 水平,且增大未达PD 水平。
1.6 统计学方法 所有分析均使用SPSS 26.0 软件和GraphPad Prism 8.3.0 软件进行统计学计算和绘图。t检验用于比较正态分布的连续性变量,χ2检验用于比较分类变量,方差分析用于比较三组间均值。采用Kaplan-Meier 方法进行生存分析,Log-rank 法用于检验统计学差异。采用单因素和多因素COX 回归分析法,单因素分析结果P<0.15 的因素被纳入多因素分析。P<0.05 被认为差异有统计学意义。
2 结果
2.1 患者一般临床特征 研究共纳入97 例HER-2阴性转移性乳腺癌患者,患者的临床和病理特征统计具体见表1。首次接受吉西他滨化疗时患者的中位年龄为55 岁,平均年龄(49.39 ±10.28)岁,激素受体阳性患者和高Ki-67 指数患者所占比例较高,患者远处转移部位包括肝、肺、骨、脑、胸壁等,绝大部分患者在既往治疗方案中使用过蒽环类和紫杉类药物。对于吉西他滨的治疗方案,有近五成的患者应用一线方案,近三成的患者应用二线方案,联合用药较单药方案应用较多。
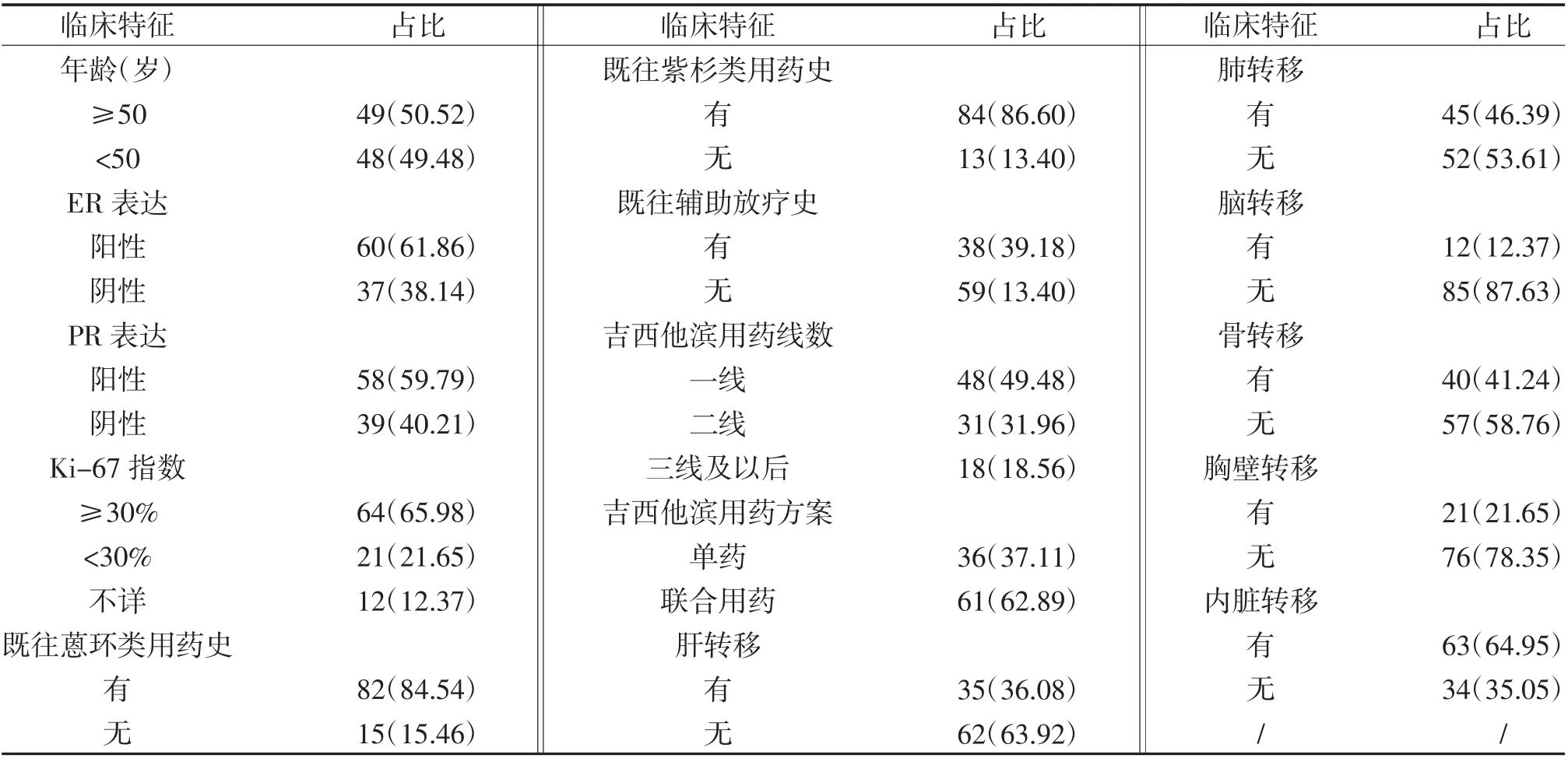
表1 患者特征统计表[n(%)]
2.2 吉西他滨治疗无进展生存期的单因素和多因素分析 本研究中97 例接受吉西他滨治疗的转移性乳腺癌患者的中位无进展生存期(median PFS,mPFS)为139 d(范围20~1191 d);单因素分析显示,骨转移和吉西他滨用药线数与PFS 可能相关(P<0.15);纳入多因素分析后结果提示此两项变量是PFS 的独立预测因素(P<0.05);Kaplan-Meier 生存分析结果提示,接受吉西他滨治疗前发生骨转移的患者PFS 较未发生骨转移的患者长,有骨转移的患者接受吉西他滨治疗后的mPFS 为191 d,而无骨转移的患者为136 d(P=0.057)。吉西他滨在三线及以后使用时,PFS 明显较一线缩短,在一线,二线,三线及以后接受吉西他滨治疗的患者的mPFS 分别为191、112 和99 d(P=0.009),见表2。

表2 无进展生存期的单因素和多因素分析
2.3 吉西他滨不同用药方法的无进展生存期比较在对吉西他滨用药方法的亚组分析中,单药治疗和联合用药的PFS 在总体患者(mPFS 分别为143 d 和168 d,P=0.966)和一线方案治疗患者(mPFS 分别为225 d 和180 d,P=0.718)中均无统计学差异。骨转移患者中,单药与联合用药的PFS 亦无统计学差异(mPFS 分别为105 d 和208 d,P=0.518);用药前存在内脏转移的患者中,联合用药较单药可延长吉西他滨治疗的PFS(mPFS 分别为175 d 和136 d,P=0.034),见图1。
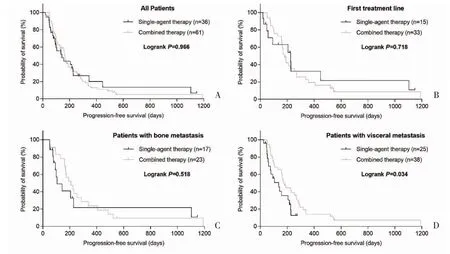
图1 单药治疗和联合用药治疗PFS 的Kaplan-Meier 生存曲线
3 讨论
乳腺癌是全球女性最高发的恶性肿瘤[7]。2020年癌症数据显示[8],在全球185 个国家中,乳腺癌是其中159 个国家最常被诊断出的癌症,是110 个国家癌症死亡的最主要原因。近年,乳腺癌新辅助治疗和辅助治疗的研究发生了巨大的进展,导致转移性乳腺癌在既往治疗方案和耐药机制方面存在一定的改变,解救治疗方案缺乏足够的循证医学证据。吉西他滨单药方案或联合方案是转移性乳腺癌的标准系统疗法[6],其在胰腺癌、非小细胞肺癌等恶性肿瘤中的疗效及耐药机制等已得到充分论证,但尚无可靠的疗效预测指标,也无足够的循证医学证据比较其各种用药方法对乳腺癌疗效的影响。故本研究旨在从患者临床特征、病理特征、治疗方法等方面探讨吉西他滨治疗转移性乳腺癌患者疗效的影响因素。
本研究中单因素分析和多因素分析显示,转移性乳腺癌患者在接受吉西他滨治疗前发生骨转移是吉西他滨疗效的独立预测因素。在接受吉西他滨治疗前没有发生骨转移患者mPFS 为136 d,而发生骨转移组的患者mPFS 为191 d。骨转移是癌症转移最常见的部位之一,恶性肿瘤的骨转移中有36%来自于乳腺癌[9],超过一半的乳腺癌新发转移以单纯骨转移的形式发生,故提高发生骨转移患者的疗效尤为重要。研究表明[10],通常激素受体阳性、HER-2 阴性、低级别肿瘤和老年患者有更高的骨转移发生倾向。在临床上,乳腺癌骨转移多表现为多发性溶骨型病变[11],主要症状为逐渐加重的局部疼痛和病理性骨折等严重并发症。乳腺癌骨转移的治疗主要目标是缓解患者疼痛,预防及恢复功能障碍,改善患者生活质量,控制肿瘤进展。据文献报道,在骨转移发生时,白血病抑制因子受体(LIFR)水平降低,且与患者的预后和缺氧基因的活性呈显著负性相关[12]。LIFR 丢失可以使原本处于休眠状态的乳腺癌细胞能够下调休眠基因和肿瘤干细胞相关基因的表达,并进一步使其在骨骼中增殖和特异性定植[13]。由此推测,表达LIFR 基因的这部分癌细胞通过丧失了部分恶性增殖转移的能力,获得了更强的细胞干性,耐药性等能力,以此达到在患者体内长期生存的效果,高表达LIFR 的患者临床表现为不易转移,耐药,而低表达的患者则表现为易转移,药物敏感,这是骨转移患者接受吉西他滨治疗PFS 长于无骨转移患者的一种可能的机制。
本研究结果显示,在97 例HER-2 阴性转移性乳腺癌患者中,单药方案和联合方案治疗之间的PFS 无统计学差异,在一线方案治疗患者和骨转移患者的亚组分析中也得出了同样的结论。但特殊的是,在有内脏转移的患者中,吉西他滨联合治疗相比单药治疗可达到更长的PFS,这与研究者在临床上观察到的现象一致。许多临床研究都集中于吉西他滨不同用药方案的患者生存期的差别。与单药治疗相比,联合用药通常有着更高的总缓解率(overall response rate,ORR),同时也有着更高的不良反应发生率,并且联合用药对PFS 和OS 的影响仍存在争议[14,15]。序贯使用单药能降低患者需要减小剂量的可能性,使每种药物都能以其最大耐受剂量进行给药,从而避免重叠毒性作用[16]。研究表明[17],吉西他滨联合用药与单药相比,OS 方面无显著差异,且联合用药组的3 级和4 级贫血,中性粒细胞减少和血小板减少的发生率明显更高。本研究结论与上述研究结论基本一致,尽管由于临床病历中有关不良反应的记录稍有欠缺,此项研究中未将不良反应发生率纳入研究中,但考虑到患者后线解救治疗的方案选择,研究者仍建议临床医生在应用吉西他滨治疗HER-2 阴性转移性乳腺癌时,应优先考虑单药治疗;若患者合并内脏转移,则优先考虑联合用药治疗。
有研究将既往接受过蒽环类治疗的晚期乳腺癌患者随机分至吉西他滨+多西他赛序贯卡培他滨组或卡培他滨+多西他赛序贯吉西他滨组[18],结果显示两组患者一线治疗的疾病进展时间(TTP)、总生存期及客观缓解率均无差异,但前组的二线治疗TTP及总TTP 较后组分别延长2.2 个月和5.1 个月(P<0.05),并且吉西他滨作为二线方案组的3/4 级非血液学毒性也更明显。本研究结果提示吉西他滨作为一线、二线、三线及以后治疗方案的mPFS 分别为191、112 和99 d,差异有统计学意义(P<0.05),在单因素和多因素分析中早期治疗也显示出了与较长PFS 一定的相关性。建议在应用吉西他滨治疗时应尽量选择早期用药。
综上所述,HER-2 阴性转移性乳腺癌患者接受吉西他滨治疗时,治疗前存在骨转移和吉西他滨的早期应用是较长PFS 的独立预测因素。单药与联合用药在一线治疗方案以及骨转移亚组的患者中疗效相似,仅在内脏转移的患者中联合用药能有效延长吉西他滨治疗的PFS。
