纳米抗体筛选和表达技术研究进展
2021-07-28王译晨宋莎莎张麦收王加才
朱 光,王译晨,宋莎莎,张麦收,王加才
(1.山东畜牧兽医职业学院,山东潍坊 261061;2.潍坊市兽药制剂研发重点实验室,山东潍坊 261061)
传统抗体由2 条重链和2 条轻链组成,其中重链包括1 个可变区(variable region of heavy chain,VH)和3 个 恒 定 区(constant region of heavy chain,CH),轻链包括1 个可变区(variable region of light chain,VL)和1 个恒定区(constant region of light chain,CL)。重链之间通过二硫键共价连接,轻链CL 区与重链CH1 结构域通过非共价作用连接形成稳定的抗体分子。1993 年,Hamers-Casterman 等[1]偶然在骆驼血清中发现一种不同于传统免疫球蛋白G(immunoglobulin G,IgG)的新型抗体。这类抗体天然缺失轻链和重链CH1,由CH2、CH3、铰链区和重链可变区(variable domain of heavy chain of heavy-chain,VHH)组成,被称为重链抗体(heavy chain antibodies,HCAbs),但其仍具有完全的抗原结合能力。尽管不清楚HCAbs 的进化优势,但研究人员已迅速认识到分离VHH 的重要性及其广泛的适用性[2-3]。VHH 并非天然存在于骆驼血液中,它只是HCAbs N 端的可变区,又被称为单域抗体(single domain antibody,sdAb)。sdAb 直径约2.5 nm,高约4 nm,因结构简单和尺寸小,也被称为纳米抗体(nanobody,Nb)。
Nb 由4 个框架区(framework regoin,FR)和3 个互补决定区(complementarity-determining region,CDR)构 成。VHH 的FR 与 人 类VH 有80%以上的序列同源性,且它们的三维结构可以重叠[4]。将Nb FR2 区第37、44、45 和47 位的4个疏水性氨基酸替换为亲水性氨基酸,会有助于增强Nb 的溶解性和稳定性[5]。尽管VHH 与VH 的氨基酸序列相似,但与VH 相比,VHH 只有3 个CDR 参与抗原结合,而传统抗体有6 个CDR 决定抗原识别位点[6],且VHH 的CDR3 平均长度为17个氨基酸残基(人源VH 的CDR3 平均为12 个残基),而较长的CDR3 既增加了作用表面积,又可以识别抗原表面的缝隙表位,但这些表位对传统抗体的抗原性通常较低。CDR3 半胱氨酸可与CDR1或CDR2 半胱氨酸形成二硫键,从而增加VHH 的稳定性[7]。
Nb 很容易被生产和改造,并且有良好的组织穿透性,其识别凹陷抗原位点的能力归因于它们较小的尺寸以及较长的CDR3 环快速穿透缝隙表位的能力。另外,随着现代分子生物学技术的发展,Nb 越来越多被用于靶向酶、跨膜蛋白或分子间相互作用研究,其在分子成像、诊断试剂、药物靶向释放和疾病治疗方面具有潜在的应用前景。本文介绍了Nb 的特性、筛选技术和表达方式,以及在动物疫病诊断或治疗方面的应用,以期为相关领域研究提供技术支持。
1 特性
1.1 相对分子质量小
Nb 相对分子质量为15 kDa,比传统IgG(约150 kDa)及其片段Fab(约50 kDa)和scFv(约25 kDa)要小的多[8],是目前已知的最小抗原结合单位,因此与IgG 及其片段相比,Nb 具有独特的优势。
1.2 特异性和亲和力高
不同于传统抗体,Nb 尽管只有3 个CDRs,但其CDR3 比单克隆抗体的VH 结构域更长,从而表现出更强的特异性与亲和力。另外,晶体学研究[9]表明,Nb 的抗原结合环具有更大的结构谱系。
1.3 可进一步改造加工
基于不同目的,通过基因重组技术将标记蛋白(如GFP 荧光蛋白、Luciferease 等)与Nb 融合表达有助于实时追踪检测,从而扩大其应用范围;与单价Nb 相比,串联表达多特异性Nb 可以同时靶向多种类型靶标,从而提高Nb 的特异性和亲和力[10-11]。另外,经改造加工的嵌合抗体可显著增强治疗效果和延长半衰期。
1.4 稳定性和可溶性高
Nb 在溶解度、耐热和抗水解等方面都有独特的优势。CDR3 的折叠和FR2 区域亲水性氨基酸的含量使它们在水溶液中溶解度升高,且不易发生聚集[12]。Nb 构象稳定且耐高温,37 ℃存放1 周后仍保持抗原结合能力,90 ℃高温孵育变性后不会聚集,待温度冷却后仍然可以折叠为天然构象,具有良好的可逆性[13]。此外,Nb 在极端的pH、蛋白酶及去垢剂存在的条件下均表现出高稳定性。目前已经开发出了在细胞内表达的针对细胞内蛋白的重组Nb,在杀灭细胞内病原体或治疗神经退行性疾病等方面作用显著[14];另外,抗水解和在极端条件下的强稳定性使它们适合于口服给药。同时,Nb 所具有的高稳定性使其在诊断检测方面拥有广阔的应用前景[15]。
1.5 组织渗透性强和易清除
由于细胞间的被动扩散速率取决于分子大小,且与分子大小成反比,因此Nb 与传统IgG 相比,其组织渗透性得到显著提高,从而具有穿过血脑屏障的能力。Nb 可以靶向特定的肿瘤细胞表面,成为肿瘤靶向治疗手段之一。Nb 相对分子质量小,在体内容易被清除,但可以通过添加聚乙二醇,与白蛋白Nb 偶联或与常规抗体的Fc 片段融合等方法延长半衰期。然而,对于一些特定用途,Nb 能被肾脏快速代谢的特点避免了对机体的影响。
1.6 具有识别缝隙表位能力
抗体晶体学研究[16]表明,在大多数情况下,抗原结合表面为平面或凹陷面,但Nb 能结合到抗原的裂缝和凹槽中。VHH 的CDR1 区域具有更好的延展性且CDR3 区域暴露面积更广,较长的CDR3 具有充当VL 的作用。这些结构变化使得Nb 既可以结合抗原表面,也使得Nb 具有结合传统抗体所不能识别的抗原缝隙表位的能力。
1.7 免疫原性弱
Nb 相对分子质量小,其序列与人类VH 同源性高,且在体内能被快速清除的特点,决定了Nb的低免疫原性。
1.8 生产简便
单克隆抗体作为一种多聚体蛋白,结构复杂,需要经过翻译修饰后才具有生物学功能,因此适合在真核系统中表达。此外,单克隆抗体制备需要融合、亚克隆等复杂操作以及漫长的筛选和纯化过程。而Nb 具有的优势决定了其生产的简便性:(1)结构简单,在没有修饰以及Fc 结构域存在的情况下仍具有活性,适合在细菌和酵母中大量表达;(2)可以从展示文库中通过高通量快速筛选获得具有强特异性和高亲和力的候选抗体分子。
2 筛选方法
2.1 噬菌体展示
噬菌体展示技术是将外源基因导入噬菌体载体,使其与噬菌体外壳蛋白融合表达并随噬菌体组装在其头部完整展示的技术,是一种强大且实用的蛋白质分子相互作用研究工具[17-18]。
20 世纪90 年代初,噬菌体展示技术在特异性Nb 的淘选过程中得到广泛应用[19]。1997 年,Arbabi 等[4]通过噬菌体展示技术筛选到了第1 株Nb。为了获得特异性强、亲和力高的抗体,一般要将抗原免疫驼科动物4~5 次,从而刺激机体产生成熟的靶向抗原特异性抗体。获得特异性抗体的操作流程包括:采集外周血分离淋巴细胞(peripheral blood mononuclear cell,PBMC),提取RNA,逆转录合成cDNA;用巢式PCR 扩增VHH 基因并构建至噬菌体展示载体,转化至大肠杆菌;利用辅助噬菌体使抗体展示于噬菌体表面,洗脱并扩增与靶抗原特异性结合的重组噬菌体,并通过大量扩增、沉淀、溶解等操作获得重组噬菌体;经过3~5 轮生物富集筛选后,即可获得特异性抗体。
获得特异性Nb 的首个关键步骤是制备抗原免疫动物。但这种方法不仅繁琐而且成本较高,也不适用于高致病性、毒性或免疫原性弱的抗原分子抗体筛选。Comor 等[20]报道了一种筛选技术,可最大限度减少实验动物的使用。从未免疫的健康羊驼血液中分离PBMC,然后在体外与抗原孵育72 h,最后收集PBMC 提取总RNA,并通过噬菌体展示淘选Nb。这不仅大大降低了免疫动物所需成本,还避免了为获得抗原特异性抗体而构建多样化合成文库的相关工作。同时体外条件下,包括细胞表面抗原在内的各种免疫原可以很容易致敏PBMC,并可在短时间内获得抗原特异性Nb,这对通过体外免疫筛选Nb 有很好的指导意义。
2.2 酵母双杂交
1989 年,Fields 建立了酵母双杂交体系。该体系已被应用于真核细胞中基因转录研究。真核生物中有两个独立的结构域,可以特异性结合到基因上游的转录起始点。这两个转录激活因子是相互独立的,分别为BD 和AD。在酵母双杂交系统中,构建一种已知的蛋白质基因序列和BD 结构域序列的重组载体,称为“诱饵”;构建一个未知的蛋白基因序列和AD 结构域序列组成的载体,称为“猎物”。如果诱饵和猎物之间没有相互作用,BD 和AD 就不会被激发,报告基因也不能被激活和表达。在宿主细胞中,如果诱饵和猎物相互作用并且表达,那么BD 和AD 将与激活序列结合,下游报告基因也因此被激活表达[21]。酵母双杂交技术在蛋白质相互作用研究中扮演着重要角色,已被广泛应用于多个研究领域。
酵母双杂交是从免疫文库中筛选出高亲和力Nb 的有效手段,其文库构建与噬菌体展示过程基本相同。文库筛选要先构建带有抗原基因的诱饵质粒,然后将诱饵菌与文库菌混合杂交,待杂交产物在显微镜下观察到三叶草样杂合体时,离心收集菌体涂布于选择性平板,如菌落生长且发蓝,则初步鉴定为阳性克隆;将文库质粒与诱饵质粒一同转化至感受态细胞中进行验证,对共转验证阳性的质粒进行测序,即可得到特异性Nb 的核苷酸序列。Gao 等[22]通过酵母双杂交技术成功得到了7 株抗新城疫病毒 HN 蛋白的Nb,经验证7 株Nb 均可以特异性识别病毒和HN 蛋白,并且具有抑制新城疫病毒血凝素活性的作用,其中5 株 VHH 抗体还具有一定的中和活性,可在感染早期抑制病毒在宿主细胞上增殖。
2.3 mRNA 展示
通过体内展示筛选Nb 在一定程度上受转化效率影响。mRNA 展示作为体外展示技术,具有筛选效率高、操作简便等特点,其原理是通过共价键将核酸序列与其编码的蛋白质连接起来,形成mRNA-蛋白质融合体。如图1 所示,将dsDNA 文库中的序列体外转录形成mRNA,模拟tRNA 氨基酰基的嘌呤霉素连接子进入核糖体A 位点,通过抑制蛋白质翻译,使mRNA 的3'端与多肽的羧基端共价结合;利用肽键形成多肽链,最终得到mRNA-蛋白质融合体,实现了基因型和表型的结合[23]。通过标签将mRNA-蛋白质融合体纯化后,反转录形成cDNA-mRNA-蛋白质复合体,然后将其加入到包被有抗原的固相载体上,洗涤去除未结合的复合物;将特异性复合物从固相中洗脱下来,加酶使cDNA 脱离并利用PCR 扩增基因,TA 克隆后对序列进行分析。
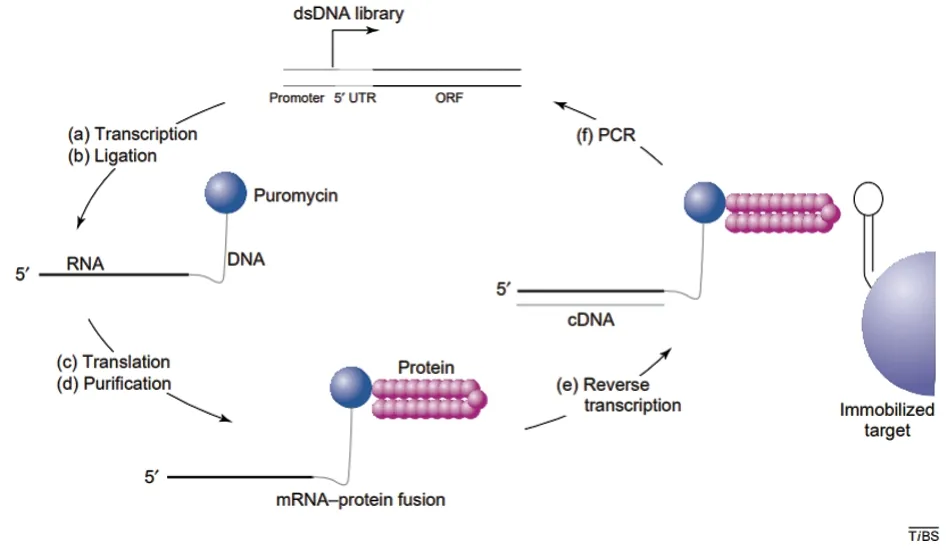
图1 mRNA 展示技术示意图[26]
mRNA 展示技术共价结合非常稳定,可以在严苛的抗原结合条件下进行,以确保筛选到高度特异、稳定的结合对象[24]。例如全长的跨膜蛋白需要去垢剂进行溶解,并包含大量的疏水性区域。Doshi 等[25]首次通过mRNA 展示筛选到针对人类全长葡萄糖转运蛋白GLUT-1 的Nb,其筛选过程只需要10 μg 纯化的靶抗原以及20 μg 的mRNA,筛选的Nb 与抗原的平衡解离常数平均Kd 值为(22.3±11.5)nmol/L。
2.4 高通量测序和质谱分析
该方法基于对免疫抗原骆驼淋巴细胞VHH cDNA 文库的高通量测序,并结合来自骆驼血清高亲和力的VHH 区域质谱(MS)鉴定,直接从骆驼血清中识别高亲和力的Nb 序列,因此不需要在体外构建展示文库,省去了体外展示抗体的步骤,因而能快速筛选到大量针对特定抗原多个表位的Nb。
Fridy 等[27]从免疫的骆驼外周血提取淋巴细胞总RNA 并反转录为cDNA,然后进行巢式PCR扩增VHH 序列,再进行高通量测序并建立特异性抗体序列数据库;通过抗原偶联树脂亲和纯化HCAbs,并用木瓜蛋白酶消化切割恒定区,洗脱回收亲和力最高的VHH 片段;凝胶纯化后的条带经胰蛋白酶消化后,用液相色谱-质谱(LC-MS)和串联质谱(MS)分析,在未构建展示文库的条件下,通过该筛选方法,快速筛选到了针对绿色荧光蛋白(GFP)的高亲和力Nb。
3 表达
对筛选得到的特异性Nb 序列需要进行表达,以便更好地研究其功能。
3.1 原核表达
利用大肠杆菌进行重组蛋白表达是目前实验室最常用的表达方式。原核表达操作相对简便、产量大、生产成本低,对细菌已经有广泛的研究基础,表达系统非常成熟。但原核表达也有一些缺点:大肠杆菌表达的重组蛋白带有内毒素,对动物机体有害;大肠杆菌结构简单,缺乏翻译后修饰,从而影响蛋白功能。
Nb 不同于传统抗体,没有Fc 及其N 端寡糖,结构相对简单,能利用原核系统表达。Nb 通常是在大肠杆菌细胞质完成组装后分泌到周质中。与细胞质相比,周质更适合Nb 表达。它是氧化性区域并存在许多伴侣蛋白和异构酶,可以促进二硫键形成和蛋白正确折叠。大多数含有二硫键的蛋白首先在胞质中产生,然后借助N 末端前导序列并通过普通分泌途径分泌到周质空间[28-29]。这样就可以通过添加信号肽使Nb 分泌到周质,并利用渗透休克法增强外膜的通透性,使Nb 从周质中释放,从而降低裂解细胞形成的杂蛋白含量,有利于得到高纯度Nb。已有文献[29]利用大肠杆菌周质间隙表达Nb,其中一些Nb 产量可以达到每升几十毫克。但由于周质中伴侣蛋白含量相对较少,大部分的VHH 表达量仍处在较低水平,另外胞质Nb 的聚集和转运似乎也是影响周质表达产量的因素。
与周质表达相比,胞质表达获得的Nb 大多是以包涵体形式存在,通过完全变性再复性的方式能够实现Nb 重折叠和二硫键形成。细胞质中有2 种硫氧还蛋白和3 种谷胱甘肽,在硫氧还蛋白还原酶和谷胱甘肽还原酶的作用下维持还原状态,但硫氧还蛋白和谷胱甘肽在氧化状态下能够催化蛋白二硫键形成[30]。为了促进二硫键形成和正确折叠,已经开发了在硫氧还蛋白和谷胱甘肽还原途径中有缺陷的双突变菌株,例如Origami(Novagen)、Rosetta-gami(Novagen)[31-32]。
培养基成分对VHH 在大肠杆菌中的表达有重要影响。考虑到培养基中相当高的细胞密度,使用营养更为丰富的EnPresso 和TB 培养基获得的Nb产量比普通LB 培养基高5~10 倍[33]。此外,结合不同的纯化方法可以提高纯化效率和获得率[34-35],其他一些因素也可以影响VHH 产量,包括培养温度、摇床速度和诱导浓度[36-37]。
3.2 酵母表达
酵母作为简单的真核生物,能够表达可溶、正确折叠和带有简单糖基化的外源蛋白,并分泌到培养基中。毕赤酵母是最成功的酵母表达系统之一。该酵母在高密度发酵中不积累有毒乙醇,也不像酿酒酵母那样分泌大量内源蛋白至培养基。甲醇诱导型AOX1 启动子调控严密,是毕赤酵母与其他系统相比最显著的优势,适合于外源蛋白的高效表达。Rahbarizadeh 在2006 年首次使用毕赤酵母系统表达Nb,成功表达了2 个抗黏蛋白(MUC1)的Nb,并通过添加诱导剂和优化一系列条件,使产量达10~15 mg/L。由于缺乏Fc,大多数VHH 不包含糖基化位点,然而大约10%的VHH 含有潜在糖基化位点,相对分子质量比预测的Nb(13~15 kDa)稍大[38]。Nb 糖基化可以增强VHH 的毒性和病毒中和能力[39],但有时也会降低与抗原结合的能力[40-41],其影响需要进一步研究,未来的研究应该尽可能减少不必要的糖基化。
3.3 哺乳动物细胞表达
哺乳动物细胞仍是生产功能性抗体的最佳表达系统,大多数治疗性抗体都是利用哺乳动物细胞表达的。目前人类批准使用的单克隆抗体药物都是由CHO、SP2/0、NSO 等细胞生产。一方面单抗生产需要真核细胞表达以保证其功能的完整性,另一方面哺乳动物细胞生产的抗体免疫原性小、安全性高。CHO 细胞生长周期短且能适应无血清培养基的悬浮培养,在摇瓶中表达Nb 的产量高达100 mg/L[42];与CHO 细胞产生的稳定表达相比,HEK-293 细胞通常可以进行瞬时转染表达,提供一些实验室表达参数,但这些参数在早期阶段需要进行鉴定,因此HEK-293 更适合在实验室花费较少情况下进行前期表达条件摸索[43]。能有效促进正确翻译后修饰的哺乳动物细胞是抗体表达中最广泛使用的表达系统,但其生产成本比其他表达系统要高得多。
3.4 植物表达
植物细胞具有易转化、高产量、安全,能够进行翻译后修饰等特点,是理想的蛋白表达宿主。植物表达系统能够大量表达具有高亲和力的VHH,且成本较低,这意味着植物细胞表达系统某种程度上可以替代哺乳动物表达系统。另外植物表达还具有其独特特点——抗体在一些可食用植物组织中表达后可以口服[44]。通常植物中异源蛋白的表达有3 种方法:整合至基因组稳定表达、瞬时转染表达和质体基因组表达。通过农杆菌渗透法表达VHH 是最常用的方法[45]。烟草是最常见表达VHH 的植物,其表达VHH 的平均产量高达总可溶性蛋白的1%[46],而拟南芥种子是表达口服VHH更方便的载体[47]。此外,其他植物生产系统,如水稻种子和马铃薯也成功表达了VHH。与基因组稳定表达相比,使用病毒载体瞬时表达在某些情况下获得了更高的产量[48-49]。
4 动物疫病防治中的应用
近年来,Nb 被广泛应用于生物医药等领域,能够特异性识别并结合生物分子,可作为特异性生物探针或医药载体,在人类疾病诊断和治疗方面具有广阔的应用前景,而在动物疫病防治中也有着巨大潜力。
Sheng 等[50]通过噬菌体展示技术筛选到9 株针对新城疫病毒NP 蛋白的Nb。他们将Nb 直接跟辣根过氧化物酶(HRP)融合表达,构建了真核表达载体,并转染至HEK-293T 细胞表达,同时基于Nb-HRP 复合物,建立了cELISA 检测方法。该cELISA 方法省时且敏感,可以在1 h 内完成检测,并且比HI 试验和市面上商品化试剂盒还要灵敏。Du 等[51]将筛选到的1 株针对猪流感病毒NP蛋白的Nb 和生物素受体肽融合,原核表达并纯化后体外连接生物素,建立了阻断ELISA 检测方法并用于猪流感血清学检测,证实该方法敏感性强且生产成本低廉。Gao 等[22]通过酵母双杂交技术筛选到7 株新城疫病毒 HN 蛋白的Nb,并证实这些筛选到的Nb 均可以特异性识别病毒和HN 蛋白,且具有抑制新城疫病毒血凝素活性的作用,其中的5 株VHH 抗体还具有一定的中和活性,可在感染早期抑制病毒在宿主细胞内增殖。Zhang 等[52]将前期筛选到的1 株针对猪繁殖与呼吸综合征病毒(PRRSV)nsp9 的Nb 和猪IgG Fc 融合,使用毕赤酵母表达系统表达出嵌合抗体 Nb6-pFc,并验证其可通过内吞作用进入PRRSV 靶细胞 PAM 细胞并发挥抗病毒作用,这为抗PRRSV 药物开发提供了理论基础。
通过免疫学和分子生物学技术筛选到的特异性针对病原的Nb,是单体形式,易于改造,具有可标记辣根过氧化物酶或生物素等物质的特性,可以用来建立病原检测方法;将Nb 和易感动物IgG Fc 融合,延长半衰期或以多价形式表达,可以成为抗病毒治疗的有效方式。
5 小结
Nb具有相对分子质量小、亲和力强、稳定性高、组织渗透性强、免疫原性低、生产周期短等特点,已在免疫、诊断、疾病治疗、材料、结晶学等领域得到广泛应用。通过噬菌体展示、酵母双杂交等技术,能够快速筛选到特异性的Nb,同时针对具有高度亲和力的Nb,可以利用多种表达系统实现高效表达。每一种筛选方法和表达系统都各有优缺点,没有统一的评价标准,在选择筛选方式和表达系统时,应以实验室条件为基础,充分了解筛选对象的结构、功能和用途,根据不同目的选用合适的方法。
从免疫文库中筛选Nb 仍然是首选。特异性Nb 在免疫文库中较为丰富,但缺点是每一种新抗原都必须制备新的免疫文库,因此有人开发了天然文库,从非免疫库快速筛选特异性Nb。而要确保文库库容多样性,其前提是从不同的骆驼个体采集大量血液样本。只有将文库与筛选方式相结合,才能有效筛选到亲和力高、特异性强的Nb。
原核表达是常用的Nb 表达系统,其操作相对简单、产量大、生产成本低,但要去除表达的重组蛋白内毒素;酵母表达可以直接收集培养基上清纯化,杂蛋白含量少,但可能存在过度糖基化问题;植物宿主可以大量表达Nb,但基因操作过程繁琐,且分离纯化Nb 也相对困难;利用哺乳动物细胞生产抗体是最常用的方式,但生产成本相对较高。近年来,Nb 已被应用于动物疫病诊断中,随着对Nb研究的不断深入,相信其在动物疫病防治中将发挥重要作用。
