口腔白斑病癌变的血管生成基因芯片检测及表达验证
2021-07-28吴苏宁杨溪刘伟
吴苏宁 杨溪 刘伟
口腔白斑是最重要的口腔黏膜潜在恶性疾病,是口腔鳞状细胞癌的重要来源[1],调查显示国内白斑患者的癌变率为4%~18%[2-4]。上皮异常增生是白斑重要的病理特征,从无异常增生、轻-中-重度异常增生到癌变进程各阶段较明确,白斑的发生发展到癌变是肿瘤发生的良好研究模型。血管生成是肿瘤发生的标志事件之一,《自然》系列杂志发表通过抗血管生成预防癌症发生和发展的综述[5],表明肿瘤血管生成早于组织形态学如上皮异常增生改变之前。虽然单个或几个血管生成相关蛋白表达在白斑癌变中进行研究具有一定意义[6-8],但是高通量的组学研究可能更具有意义。本文作者利用人转录组芯片研究口腔白斑患者病损发生发展中的血管生成基因表达谱,并验证关键基因的表达。
1 材料与方法
1.1 基本材料
标本来源纳入转录组芯片研究的患者组织包括3例正常口腔黏膜,8例口腔白斑,6例口腔早期鳞癌(T1-2N0M0),收集于2014年9月~2014年12月上海第九人民医院口腔颌面头颈肿瘤科。纳入8例口腔白斑分为4例无/轻度上皮异常增生,4例中-重度上皮异常增生,分别归为本研究中的低危白斑和高危白斑。纳入差异基因的验证表达研究的患者组织包括6例正常黏膜,12例口腔白斑,12例口腔早期鳞癌,收集于2018年6月~2018年12月上海第九人民医院颌面头颈肿瘤科。以上组织病理学诊断由上海第九人民医院口腔病理科医师确认。组织样本为活检或手术后标本,放入装有RNAlater液的冻存管,离体后液氮浸没15 min,放入-80℃冰箱保存。所有患者术前均未进行化疗、放疗及激素等治疗,且无自身系统性疾病和癌症史。正常黏膜、口腔白斑和鳞癌3组间的年龄和性别等因素无统计学差异。本研究获得上海第九人民医院伦理委员会批准(批号:[2012]21),研究对象均知情同意。
1.2 方法
1.2.1 总 RNA提取和质检 按照 TRIzol试剂盒(15596型号,Invitrogen公司,美国)常规提取组织中总RNA,利用NanoDrop 2000分光光度计(ND2000型,Thermo Scientific公司,美国)测定浓度及 A260/A280,琼脂糖凝胶电泳检测RNA完整性。纳入本研究的组织样本NanoDrop ND-2000定量并经 Agilent Bioanalyzer 2100(安捷伦2100,Agilent Technologies公司,美国)检测RNA完整性,检测显示RNA的A260nm/A280nm比率均在 1.8和 2.1之间,A260nm/A230nm值均大于1.8,显示RNA质量良好,符合实验要求。
1.2.2 转录组芯片研究 样本的标记、转录组学芯片的杂交以及洗脱检测按照Affymetrix GeneChip®Hu-man Transcriptome Array(HTA)2.0标准流程执行。首先,总 RNA反转录成双链 cDNA,再进一步合成cRNA,接着对cRNA进行第二轮反转录合成cDNA,片段化并与生物素标记后与芯片杂交,洗脱和染色后利用Affymetrix Scanner3000(Affymetrix,美国)扫描得到原始图像。采用Affymetrix GeneChip Command Console软件处理提取原始数据和Expression Console软件对芯片进行gene level的标准化,标准化算法为RMA。后续分析分成基因表达分析使用的软件为Genespring软件。差异基因利用t检验的P值和倍数变化值进行筛选,筛选的标准为上调或者下调倍数变化值≥2.0且P值<0.05。接着,对差异基因进行Gene ontology(GO)功能分析,以判定差异基因主要影响的生物学功能。最后,对差异基因进行非监督层次聚类,展示差异基因在不同样本间的表达模式。
1.2.3 荧光定量 PCR(qRT-RCR) 利用 HiScript II Q RT SuperMix for qPCR(+gDNA wiper)将待测 RNA逆转录成cDNA。采用Roche LCPDS2软件设计基因引物(表1)。利用QuantiFast®SYBR®Green PCR Kit试剂盒(Qiagen,Germany)在 LightCycler®480Ⅱ型荧光定量PCR仪(Roche,Swiss)上进行反应。体系:2×QuantiFast®SYBR®Green PCR Master Mix,5μL;10 μmol/L Forward primer,0.2μL;10μmol/L Reverse primer,0.2μL;cDNA,1μL;Nuclease-free H2O,3.6 μL。PCR程序:95℃5 min;95℃10 s,60℃ 30 s,40个循环。循环结束后利用熔解曲线检测产物特异性:从60℃缓慢升温至97℃,每℃采集5次荧光信号。GAPDH作为内参,采用2-ΔΔCt法测定相对表达水平,设置3个重复孔,计算其均数和标准差。

表1 RT-qRCR验证血管生成关键基因的引物序列Tab 1 Primer sequence for angiogenic genes
1.3 统计学处理
采用SPSS 17.0统计软件进行分析,采用方差分析比较正常黏膜、白斑和鳞癌3组间基因定量表达均数差别的显著性检验,以P<0.05为有统计学差异。
2 结 果
2.1 口腔白斑发生发展中的血管生成基因表达谱
本研究将口腔白斑发生发展的节点分为低危(无/轻度异常增生)白斑、高危(中-重度异常增生)白斑和早期鳞癌。经Affymetrix HTA2.0转录组芯片检测,低危白斑有855个异常变化两倍以上特有的转录本基因,高危白斑有399特有基因,高危白斑发展到早期鳞癌有797个特有基因。白斑各阶段的差异基因进行GO功能分析。按照GO生物学作用分类,筛选出生物学作用为血管生成(Angiogenesis)的基因(图1)。

图1 从白斑发生发展各阶段全部基因中筛选出血管生成基因Fig 1 Angiogenic genes screened from all genes in the develop-ment and progression of leukoplakia
从正常黏膜发展到低危白斑有7个异常变化两倍以上基因,从低危黏膜发展到高危白斑有8个基因(表2)。从高危白斑发展到鳞癌有151个基因,占比18.9%,聚类分析表达谱见图2。
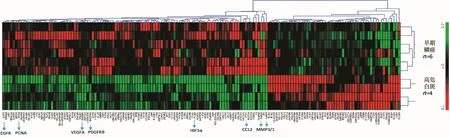
图2 口腔高危白斑发展到早期鳞癌的血管生成基因表达谱Fig 2 Angiogenic gene expression profile of high-risk leukoplakia to early SCC

表2 白斑发生发展进程中的血管生成差异表达基因Tab 2 Angiogenic genes in the development and progression of leukoplakia
2.2 白斑癌变血管生成关键基因的验证
本研究的芯片验证关注于从高危白斑发展到早期鳞癌的血管生成关键基因,选择正常黏膜、口腔白斑和鳞癌的独立样本对VEGFA、PDGFRB、MMP1和MMP3行荧光qRT-RCR的验证表达研究,结果显示VEGFA、PDGFRB、MMP1和MMP3的mRNA在正常黏膜、口腔白斑和鳞癌中的相对表达量均呈阶梯式升高(图3),这与转录组芯片结果基本一致。
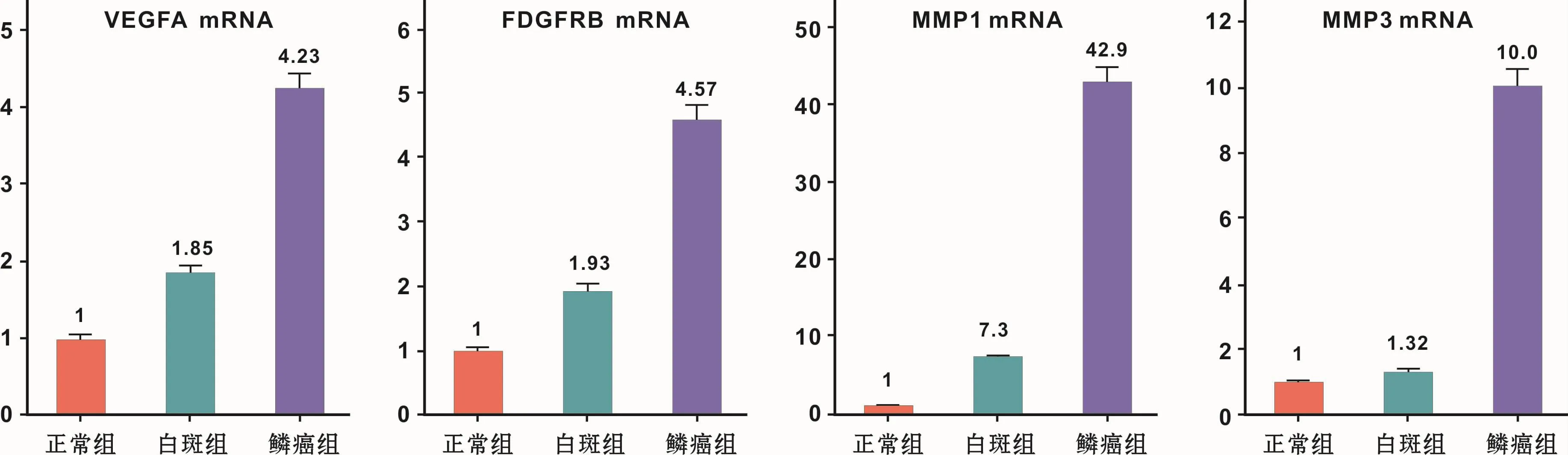
图3 qRT-PCR验证血管生成基因VEGFA、PDGFRB、MMP1和MMP3在正常黏膜、白斑和鳞癌中的差异表达(P<0.05)Fig 3 qRT-PCR confirmation of the differential expression of VEGFA,PDGFRB,MMP1 and MMP3 in normalmucosa,leukoplakia and SCC(P<0.05)
3 讨 论
口腔黏膜白斑癌变进程是由多基因异常参与的组织细胞结构和功能改变的多步骤过程,高危白斑的早期诊断及危险评估尤为重要。目前,临床上常用视诊、触诊、常规病理学进行口腔癌前病变的诊断和评估,而细胞基因改变发生于组织形态学改变之前,研究白斑发生发展进程中基因组学改变对癌变早期诊断及分子机制方面具有重要作用。组学研究比单个或几个分子在口腔白斑及鳞癌中表达研究更有意义[6-10]。本研究选取的Affymetrix HTA2.0芯片是新一代全转录组芯片,该芯片设计了近700万条探针,可以检测超过28万条全长转录本,包括超过24万条编码转录本RNA和超过4万条非编码转录本RNA。
纳入转录组芯片的阶梯式病例设置是本研究的特色。针对口腔白斑的发生发展设置四组病例,设置为正常黏膜(n=3)-低危白斑(n=4)-高危白斑(n=4)-早期鳞癌(n=6)模拟白斑癌变的多步骤进程,研究结果可反映白斑癌变不同阶段的分子生物学特性。王娟等[11]对正常黏膜(n=3)和白斑(n=3)进行的Affymetrix U133 plus 2.0基因芯片研究,张德保等[12]对正常黏膜(n=10)和白斑(n=10)进行的Agilent基因组学芯片研究,陈显久等[13]对白斑(n=3)和鳞癌(n=3)进行的SupperArray基因芯片研究。而本研究的芯片病例设置为白斑发生发展的各阶段,这是区别于既往的对白斑的芯片研究的特色之处。
血管生成是肿瘤发生的标志事件之一。研究表明肿瘤超过1~2 mm3须依赖血管生成和氧气,肿瘤发生是由于在肿瘤内部的细胞不受控的快速分裂增殖,导致大量细胞聚集在一起,却没有血管可以带来养分和氧气,肿瘤内部的细胞通常会陷入低氧环境中,从而通过 HIF1α开启或增强一系列基因的表达,通过VEGF等基因上调促进血管生成,包括促进能量物质无氧酵解的酶,导致癌细胞规避失巢凋亡并启动迁移机制的信号通路[5]。段宁等[14]对白斑(n=4)和鳞癌(n=4)进行单核苷酸多态性芯片研究,异常基因主要位于第3,5-9,11,13-15,17,18染色体,本项目筛选出的血管生成基因位点亦多位于这些染色体(表2)。
本研究中转录组芯片筛选出白斑发生发展各阶段的血管生成基因。作者发现S100A7和PDPN分别是低危白斑和高危白斑的异常基因,Kaur等[15]发现S100A7是预测癌变的标记物,本项目先前的研究提示PDPN亦可能是癌变标记物[16]。VEGFA、PDGFRB、CCL2、EGFR、MMP1/3等是从高危白斑发展到早期鳞癌阶段的关键基因,qRT-PCR实验结果亦显示VEG-FA、PDGFRB、MMP1和MMP3基因发生显著上调。国外学者报道VEGFA和EGFR免疫表达与白斑进展和癌变相关[17-18],CCL2与口腔鳞癌中的血管生成有关[19],MMP1的免疫表达在白斑和正常组织有显著差异,但作为癌变诊断指标证据不足[20]。
目前,血管生成基因在口腔癌变进程中分子机制研究很少,本研究结果提示VEGFA等基因上调促进血管生成在癌变过程中具有重要作用,白斑癌变微环境中VEGFA等激活的信号通路和分子机制值得进一步研究。总体上,本文以血管生成为论点,为白斑发病和癌变的分子机制、寻找白斑早期诊断的分子标记的深入研究提供新依据,为白斑的发生发展机制和标志性癌变基因探针的筛查奠定了基础。
