生后早期高氧暴露对卵清蛋白诱导支气管哮喘模型小鼠的影响
2021-07-28朱海艳郑亚斐胡晶晶包天平田兆方
王 维,朱海艳,郑亚斐,胡晶晶,包天平,田兆方
南京医科大学附属淮安第一医院新生儿科,淮安市小儿呼吸重点实验室,江苏 淮安 223300
支气管哮喘(哮喘)是儿童最常见的慢性呼吸道疾病之一[1]。我国目前儿童哮喘患者约有3 000万,且患病率正呈现快速上升趋势[2]。哮喘的致病可追溯到婴幼儿期,70%~80%的儿童哮喘发病于5 岁以前[3]。文献报道早产[4]、生后氧疗及支气管肺发育不良(bronchopulmonary dysplasia,BPD)与儿童哮喘的发生有关。儿童哮喘以咳嗽、喘息、肺部炎症和气道高反应性(airway hyperresponsiveness,AHR)为主要特征,而早产儿,尤其是患有BPD的早产儿也经常出现类似哮喘的反复喘息、气道阻塞和AHR等症状[5-6],其肺功能检查主要表现为1秒用力呼气容积(forced expiratory volume in one second,FEV1)和第1 秒用力呼气量占用力肺活量的百分比(FEV1/FVC)降低[7],由此被诊断为哮喘的风险增加[8],但具体原因并不清楚。早产儿及BPD 患儿生后经常需要氧气支持治疗,已有动物研究证实新生小鼠早期高氧暴露可损害小鼠的气道发育,造成气道炎症和AHR的增加[9],而这与哮喘的发病密切相关。本实验即利用BALB/c小鼠在生后早期高氧暴露基础上建立卵清蛋白(ovalbumin,OVA)诱导的支气管哮喘小鼠模型,并将之与单纯哮喘模型进行比较,以研究生后早期高氧暴露对OVA诱导的支气管哮喘模型小鼠的影响。
1 材料和方法
1.1 材料
自南京医科大学医药动物实验中心购入出生时间相差30 min 以内的新生BALB/c 小鼠(SPF 级)32只,饲养于南京医科大学附属淮安第一医院动物实验中心,环境温度恒定(24±2)℃,相对湿度60%~70%,昼夜光照各12 h,自由饮水及采食,饮水及饲料由动物中心提供。为减少性别对本组研究的干扰,参照文献全部选用雌性小鼠。实验所需FO-2型氧浓度测定仪购自无锡法斯达医学设备有限公司,氧气由淮安圣泰气体有限公司提供。本实验经南京医科大学附属淮安第一医院医学伦理委员会批准。
1.2 方法
1.2.1 动物分组
32 只雌性BALB/c 新生小鼠,记录出生体重后随机分为4 组:空气+PBS 组、高氧+PBS 组、空气+OVA组和高氧+OVA组,每组8只。
1.2.2 生后早期高氧暴露
高氧+PBS组及高氧+OVA组新生小鼠出生后4 h内置于65 cm×45 cm×70 cm 自制密闭塑料氧箱[氧浓度分数(FiO2)≥95%,由氧气瓶持续供氧,氧流量3~4 L/min]中,由FO-2型氧浓度测定仪持续监测,连续暴露7 d;空气+PBS组及空气+OVA组新生小鼠则饲养于同环境室内空气(FiO2=21%)中。每日开箱1 h,记录小鼠体重,补充饮水和饲料,更换垫料,并将空气组母鼠与高氧组母鼠轮换,以防止母鼠氧中毒。7 d 后将高氧+PBS 组及高氧+OVA 组小鼠移出氧箱,与空气+PBS组及空气+OVA 组小鼠一同饲养于室内空气中,待其6周龄后以OVA 诱导支气管哮喘模型。
1.2.3 OVA诱导支气管哮喘模型的建立
参照文献的方法[10],于第43日龄、50日龄、57日龄分别给予空气+OVA组与高氧+OVA组新生小鼠腹腔注射混悬致敏液[OVA 1 mg/mL+Al(OH)31 mg/mL]100 μL 进行致敏;空气+PBS 组及高氧+PBS 组新生小鼠腹腔注射等量PBS。于新生小鼠第58日龄起,将空气+OVA 组与高氧+OVA 组新生小鼠分别置于雾化箱中,雾化吸入激发液(1%OVA)予以激发,连续7 d,每次30 min;空气+PBS组及高氧+PBS组用等量PBS雾化吸入替代。
1.2.4 标本采集
小鼠于第65日龄用10%水合氯醛0.04 mL/10 g腹腔注射麻醉,固定四肢,剪开皮肤暴露胸腔,1 mL注射器肝素冲管抗凝后心尖部取血,1 600g离心10 min后留取血清。继续解剖,分离暴露气管,由气管上1/3处置入1 mL 注射器针头并固定,抽取1 mL无菌生理盐水对气管、支气管及肺泡进行灌洗,反复抽吸3次,保证回收率在75%以上,回收的支气管肺泡灌洗液(broncho alveolar lavage fluid,BALF)4 000 r/min 离心后分离上清与沉淀,沉淀立即进行白细胞分类计数,上清置于-80 ℃等待进行细胞因子检测。灌洗结束后留取右肺中叶进行肺组织病理检查。
1.2.5 ELISA 检测小鼠血清IgE 及BALF 中细胞因子水平
采用ELISA 检测各组小鼠血清中IgE 水平和BALF 中白细胞介素(interleukin,IL)-5、IL-12、IL-13水平。ELISA 试剂盒购自NeoBioscien 公司,实验步骤严格按照试剂盒说明书操作。
1.2.6 BALF细胞分类计数
将留取的BALF 沉淀涂片,自然晾干,于4%中性多聚甲醛溶液中固定10 min,苏木精-伊红(HE)染色,光镜200 倍视野下随机选取4 个视野进行细胞分类计数(至少计数300个细胞)。
1.2.7 肺组织标本病理检查
将留取的小鼠右肺中叶固定于4%中性多聚甲醛中,经梯度乙醇脱水、二甲苯透明、浸蜡包埋制成蜡块。切片后经HE染色、脱水、透明、封片,在显微镜下观察,计算气道壁厚度占气道总面积比值以及辐射状肺泡计数值(radical alveolar counts,RAC),并拍照进行图像采集。
1.3 统计学方法
采用SPSS 21.0 统计软件对数据进行统计学分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 小鼠一般生长状况
出生时,空气+PBS组、高氧+PBS组、空气+OVA组和高氧+OVA 组小鼠体重无明显差异;7 日龄时,高氧+PBS 组、高氧+OVA 组体重相较于空气+PBS组、空气+OVA 组明显减轻,且毛色杂乱,自主活动减少;6周龄时空气+PBS组、空气+OVA组之间及高氧+PBS 组、高氧+OVA 组之间体重无明显差异,高氧+PBS 组、高氧+OVA 组体重仍较空气+PBS 组、空气+OVA组明显减轻,自主活动仍减少,但毛色杂乱程度减轻,外观几乎无差别。空气+OVA组及高氧+OVA组小鼠OVA致敏激发后出现明显呼吸急促,口唇发绀,烦躁、抓耳挠腮等表现。65 日龄处死时各组体重无明显差异(表1)。
表1 各组小鼠体重比较Table 1 Body weight of mice in each group (g,)
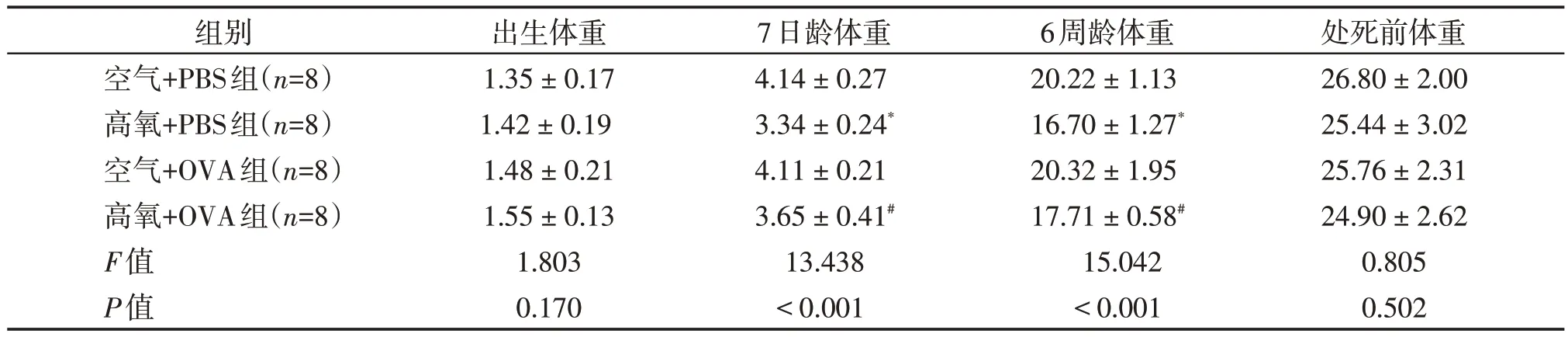
表1 各组小鼠体重比较Table 1 Body weight of mice in each group (g,)
与空气+PBS组比较,*P<0.05;与空气+OVA组比较,#P<0.05。
2.2 小鼠肺组织病理检查
空气+PBS 组支气管及肺泡结构正常;高氧+PBS组肺泡直径明显增大,数量减少,可见肺泡间隔断裂及少量炎性细胞浸润;空气+OVA 组肺泡大小分布较均匀,数量正常,但支气管壁明显增厚,柱状上皮增生肥大,支气管内见明显炎性细胞浸润;高氧+OVA 组支气管壁则更为明显增厚,柱状上皮增生肥厚,支气管管腔狭窄,可见明显炎性细胞浸润,肺泡数量较多,大小不一(图1)。空气+OVA 组、高氧+OVA组可见支气管壁面积占气道总面积比值增加(P<0.05),高氧+PBS 组、高氧+OVA 组可见RAC明显减少(P<0.05,图2)。

图1 各组小鼠支气管及肺泡病理变化(HE)Figure 1 Pathological changes of lung tissue in each group(HE)

图2 各组小鼠支气管壁面积占气道总面积比值及肺组织RAC值Figure 2 Ratio of wall thickness to airway area and RAC in each group
2.3 小鼠血清IgE水平
各组小鼠血清IgE 水平差异具有统计学意义(F=40.709,P<0.05)。空气+OVA 组血清IgE 含量[(11.84±2.89)ng/mL)]相对于空气+PBS 组[(3.55±0.91)ng/mL]明显增高(P<0.05);高氧+OVA组血清IgE 含量[(15.63±3.57)ng/mL]相对于空气+OVA 组[(11.84±2.89)ng/mL]明显升高(P<0.05),但空气+PBS 组[(3.55±0.91)ng/mL]与高氧+PBS 组[(4.38±2.26)ng/mL]IgE水平无差别(P>0.05,图3)。
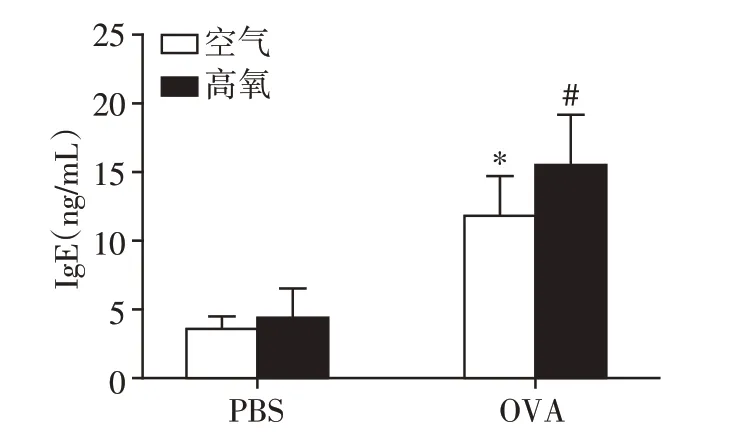
图3 各组小鼠血清IGE含量比较Figure 3 Serum IgE of mice in each group
2.4 小鼠BALF细胞计数
各组小鼠BALF 白细胞分类计数结果显示:与空气+PBS 组相比,高氧+PBS 组白细胞总数明显上升(P<0.05),分类计数后嗜酸性粒细胞、淋巴细胞、单核细胞计数虽有上升,但差异不具有统计学意义。与空气+PBS组相比,空气+OVA 组白细胞总数及嗜酸性粒细胞计数均明显升高(P<0.05);此外淋巴细胞计数增加,单核细胞计数降低,但差异都不具有统计学意义。与空气+OVA组相比,高氧+OVA组白细胞总数、嗜酸性粒细胞计数、淋巴细胞计数、单核细胞计数均显著增加(P<0.05,表2)。
表2 各组小鼠支气管肺泡灌洗液白细胞总数及分类计数比较Table 2 Total WBC count and differential count in BALF in each group (×104个/mL,)

表2 各组小鼠支气管肺泡灌洗液白细胞总数及分类计数比较Table 2 Total WBC count and differential count in BALF in each group (×104个/mL,)
与空气+PBS组比较,*P<0.05;与空气+OVA组比较,#P<0.05。
2.5 小鼠BALF 中细胞因子IL-5、IL-12、IL-13 水平检测
与空气+PBS 组相比,空气+OVA 组小鼠BALF中IL-5、IL-12 和IL-13 水平均明显升高(P<0.05);高氧+OVA 组相对于空气+OVA 组,IL-5、IL-13 水平升高,而IL-12水平降低(P<0.05,表3)。
表3 各组小鼠支气管肺泡灌洗液中IL-5、IL-12、IL-13水平比较Table 3 IL-5,IL-12,IL-13 measurements in BALF in each group (pg/mL,)

表3 各组小鼠支气管肺泡灌洗液中IL-5、IL-12、IL-13水平比较Table 3 IL-5,IL-12,IL-13 measurements in BALF in each group (pg/mL,)
与空气+PBS组比较,*P<0.01;与空气+PBS组比较,#P<0.05;与空气+OVA组比较,ΔP<0.01。
3 讨论
支气管哮喘是由多种细胞(如嗜酸性粒细胞、肥大细胞、T淋巴细胞、中性粒细胞、气道上皮细胞)和细胞成分参与的气道慢性炎症性疾病,其典型的临床特征有气道炎症、气道重塑和气道高反应性等[11]。经典的OVA 诱导的支气管哮喘模型小鼠表现为血清IgE 水平升高,肺组织中嗜酸性粒细胞大量浸润和明显的气道结构重塑。本研究中空气+OVA组相对于空气+PBS 组BALF 中嗜酸性粒细胞明显增加,血清IgE 水平升高,肺组织病理切片中可观察到明显的气道狭窄和管壁厚度增加以及炎症细胞的大量浸润,提示本实验在空气+OVA 组中成功复制了经典的支气管哮喘模型。同时,参照本课题组生后早期高氧损伤致C57BL/6小鼠BPD模型的经验[12],采用出生后4 h 内置于95%以上高氧环境中暴露7 d 的方法,通过比较高氧+PBS 组和空气+PBS 组肺组织病理可以发现,前者小鼠肺泡数量明显减少,大小不匀,肺泡壁断裂增加,RAC值降低,由此验证了本课题组C57BL/6 小鼠BPD 模型在BALB/c 小鼠上的一致性。同时,本实验在此基础上另外设置高氧+OVA组,在生后早期高氧暴露基础上再进行OVA诱导支气管哮喘模型的建立,以探究生后早期高氧暴露对支气管哮喘模型小鼠的影响。
本研究发现,高氧+OVA组相对于空气+OVA组小鼠支气管壁明显增厚,气道壁厚度占气道总直径比例明显升高,气道狭窄明显,提示生后早期高氧暴露可以促进支气管哮喘对小气道的结构重塑。同时,高氧+OVA 组相对于空气+OVA 组,其肺组织切片中支气管壁周围存在更多的炎细胞浸润,血清IgE 水平明显升高,BALF 中白细胞总数增加明显,分类计数后发现嗜酸性粒细胞、淋巴细胞及单核细胞均增加,嗜酸性粒细胞及淋巴细胞增加尤为显著,提示生后早期高氧暴露的哮喘模型小鼠气道炎症反应更为明显。
支气管哮喘与早产[4]、生后氧疗及BPD 病史[8]密切相关。BPD 患儿更容易出现慢性咳嗽、反复喘息等症状,也更容易患有慢性喘息性疾病或被诊断为哮喘。从婴儿期到成年期,BPD 对患儿肺功能的损害持续存在,表现为类似哮喘的FEV1和FEV1/FVC降低,呼气峰流速(PEF)降低,呼吸道气流阻滞等症状[7,13-15]。
气道重塑是哮喘的重要特征之一。哮喘患者的气道重塑涉及气道壁的全层结构,包括气道上皮、基底膜、固有层、平滑肌和血管[16],其主要特征包括气道基底膜增厚[17],平滑肌细胞增生[18],杯状细胞化生和黏蛋白分泌增多[19],细胞外基质增加和胶原蛋白沉积[20-21]。动物实验研究发现,生后早期高氧暴露同样造成了相似的小鼠气道结构损伤和重塑现象。Kumar 等[9]经实验证实,高氧可以促进小鼠气道柱状上皮增生和肥大、气道壁厚度和平滑肌厚度增加,细胞外基质中胶原蛋白沉积及肺部血管生成增加。这与本研究在单纯高氧和单纯哮喘小鼠中观察到的现象相符合。另外,本研究比较空气+OVA 组与高氧+OVA 组后发现生后早期高氧暴露进一步加重了支气管哮喘小鼠的气道结构损伤与重塑,主要表现为气道柱状上皮增生肥大,基底膜增厚,气道管腔狭窄,气道壁厚度及其占气道总直径比例增加等都更为明显,这可能是高氧暴露造成的气道结构重塑和损伤与哮喘造成的气道结构重塑相叠加的结果。研究发现,IL-13可抑制气道成纤维细胞中弹性蛋白的表达,引起气道壁硬化和气道塌陷从而引起气道阻塞[22],这与本实验中高氧+OVA组BALF中IL-13含量增加相一致。此外,高氧暴露带来的气道结构损伤可能迁延不愈直至小鼠成年期[17],这也与临床上BPD患儿2岁[23]、3岁[24]、6岁[25]、11岁[26]、19 岁[7]及成年期[27]肺功能持续受损表现相一致,临床上BPD患儿哮喘发病率的增加可能与此相关。
气道炎症反应增加亦是哮喘的重要特点之一。哮喘患者常表现为由嗜酸性粒细胞、肥大细胞、淋巴细胞、巨噬细胞及多种细胞因子驱动的气道慢性炎症反应。动物实验研究发现小鼠高氧暴露早期也可出现肺组织中白细胞和单核细胞数量增加的急性炎症反应表现[28],并且至15周龄时炎症仍未缓解但转变为淋巴细胞为主的慢性炎症[9],这与本研究观察到的高氧暴露后小鼠65日龄时BALF中淋巴细胞的增加相一致。同时我们发现经高氧暴露后再建立哮喘模型的小鼠BALF中淋巴细胞增加的现象更为明显,而CD4+、CD8+T淋巴细胞在哮喘气道炎症的发生中起着重要作用。
哮喘患者中可以观察到支气管周围淋巴细胞浸润和支气管肺泡灌洗液中活化CD4+T 细胞增加[29]。CD4+T 淋巴细胞中的Th1 和Th2 与哮喘的发生密切相关。经典观点认为哮喘的炎症反应增加是由于体内Th1/Th2 失衡所致,哮喘患者中Th2 占优势而Th1 相对较弱[30]。Th1 分泌γ干扰素,Th2 分泌IL-4、IL-5、IL-13 等细胞因子,两者处于相互制衡的关系而保持细胞因子的分泌相对稳定。本研究发现高氧暴露后哮喘模型小鼠BALF 中IL-5 及IL-13 含量升高较为明显,提示高氧暴露可能促进了Th2 的活化和细胞因子分泌;而IL-12是Th0向Th1分化的重要诱导因子,本研究中IL-12明显降低,提示高氧可能抑制了Th0 向Th1 的分化。由此我们推测,生后早期高氧暴露可能加剧了OVA 诱导的哮喘模型小鼠中Th1 向Th2 的偏移,增加了Th2 细胞因子的分泌。Th2分泌的细胞因子如IL-4、IL-5、IL-13可参与气道嗜酸性粒细胞募集,通过刺激B细胞分化,增加IgE 产生,诱发肥大细胞脱颗粒释放组胺等导致哮喘气道炎症反应的发生。
另外,除了CD4+T细胞,CD8+T细胞在过敏性哮喘中也具有重要作用[31]。哮喘患者气道上皮细胞存在分泌IL-13 的CD8+T 淋巴细胞[32]。CD8+T 细胞缺失的小鼠诱导OVA 哮喘模型后,其BALF 中嗜酸性粒细胞、IL-13 水平及AHR 表现均明显降低[33]。BPD 患儿生后氧气补充治疗和缺氧状况导致体内氧化应激失常,可诱导线粒体产生大量线粒体活性氧(mitochondrial reactive oxygen species,mROS)[34],mROS 可通过抑制浆细胞样树突状细胞(plasmacytoid dendritic cells,pDCs)抗原吞噬小体中酸性溶酶体蛋白酶活性保护抗原不被过度水解从而提高pDCs的抗原提呈作用,由此促进CD8+T细胞免疫应答的增强[35]。CD8+T细胞致敏后产生的效应记忆性CD8+T细胞是体内IL-13的产生来源之一,可显著增加OVA 致敏哮喘模型小鼠BALF 中IL-13 水平[36]。另外,BPD 患儿因肺泡发育受阻常存在缺氧现象,低氧条件可激活缺氧诱导因子,促进CD8+T 细胞向分泌IL-13 的Tc2 细胞的分化,从而提高体内的IL-13水平。IL-13可通过促进浆细胞合成IgE[37],促进嗜酸性粒细胞向肺部迁移[38],增加气道上皮细胞通透性[39],促进杯状细胞化生[40]等参与气道炎症反应的发生。本研究观察到高氧暴露后哮喘模型小鼠BALF 中IL-13水平相较于单纯哮喘组明显升高,由此推测生后早期高氧暴露导致的氧化应激失常和后续持续缺氧状态使得肺组织中IL-13升高可能是哮喘模型小鼠气道炎症反应增加的原因之一。
气道高反应性亦是支气管哮喘的特征之一。Regal 等[41]发现高氧+OVA 处理的新生小鼠对乙酰胆碱激发产生的气道高反应性相对于单纯哮喘的新生小鼠明显增加,其气道阻力基线水平和引起支气管收缩的最低激发剂量均与单纯哮喘模型小鼠有明显差别。但本研究未就高氧+OVA组小鼠进行气道功能评估,此方面还需更多研究以证实。
有趣的是本研究发现经OVA 诱导哮喘模型的建立后,小鼠原本的高氧肺损伤症状似乎得到了减轻,肺泡数量增加,RAC升高,肺泡发育停滞状况似乎得到了改善,受限于本研究样本量较小,此现象还需要进一步的研究证实。
综上,本实验通过在生后早期高氧暴露基础上进行OVA诱导支气管哮喘模型的建立,证实生后早期高氧暴露可能通过参与气道重塑作用和增加气道炎症反应从而导致哮喘的发生。
