西葫芦9-顺式-环氧类胡萝卜素双加氧酶CpNCED2基因的克隆及其干旱响应模式研究
2021-07-28刘建汀曾美娟温文旭陈敏氡叶新如朱海生温庆放
刘建汀 曾美娟 温文旭 王 彬 陈敏氡 叶新如 朱海生 温庆放
(福建省蔬菜遗传育种重点实验室/福建省农业科学院作物研究所/福建省蔬菜工程技术研究中心,福建福州 350013)
西葫芦(Cucurbita pepoL.) 为葫芦科(Cucurbitaceae)南瓜属(Cucurbita)一年蔓生草本植物,染色体组型为2n =2x =40。西葫芦生长周期短,耐储运,含有较多的维生素C、葡萄糖等营养物质,具有除烦止渴、润肺止咳等功效,是我国冬春季节设施栽培主要蔬菜种类之一。生产过程中,连续高温天气容易形成干旱环境胁迫,影响西葫芦生长发育、水分代谢、抗氧化系统平衡以及光合作用等,导致其产量严重下降[1-2]。持续的干旱胁迫会导致叶片中的脱落酸(abscisic acid,ABA)迅速增多,引起气孔关闭,造成叶片净光合速率、蒸腾速率、气孔导度及胞间CO2浓度等光合指标下降,光合作用能力降低[3]。目前西葫芦干旱胁迫相关的研究主要集中在生理生化水平[4-5],但仍不清楚西葫芦对干旱响应的生理机制及其调控机理。
9-顺式-环氧类胡萝卜素加双氧酶蛋白(9-cisepoxycarotenoid dioxygenase,NCED)是内源ABA 合成的限速酶,在植物体中以基因家族的形式存在,其表达量的变化常与ABA 的含量密切相关[6-8]。研究表明,响应干旱等逆境胁迫能够诱导NCED的表达从而调控内源ABA 合成[9-11]。花生(Arachis hypogaea)在干旱胁迫条件下,随着内源ABA 含量的明显增加,AhNCED1 基因表达量显著上调,将AhNCED1 基因转化至拟南芥突变体(129B08/nced3) 后,拟南芥中AhNCED1 基因超量表达,可恢复其在干旱胁迫下ABA的积累进而增强拟南芥抗干旱能力[12]。小麦(Triticum aesivum)中TaNCED基因受ABA、聚乙二醇(polyethylene glycol,PEG)和干旱胁迫显著上调表达,将TaNCED基因在拟南芥中过表达可以提高其对干旱胁迫的耐受性[13]。在NCED基因响应玉米[14]、拟南芥[15]、柑橘[16]和百脉根[17]等植物干旱胁迫的研究中发现,干旱胁迫可以诱导NCED基因表达和内源ABA的积累,且在一定范围内,该基因表达与ABA 积累会随干旱时间延长而明显增强,表明NCED基因在提高植物抗旱能力方面具有重要作用。
目前,国内外关于西葫芦NCED基因克隆和功能分析的报道较少[18-19]。本研究前期在田间育种过程中发现1 个对干旱胁迫较为敏感的西葫芦组合——福美6 号,并从构建的转录数据库中筛选出1 条潜在与ABA 合成相关的NCED基因全长序列[20]。在此基础上,本研究拟测定西葫芦干旱胁迫后叶片光合参数、水势以及ABA 含量的变化,分析西葫芦NCED的基因序列特征和表达模式,以期了解西葫芦NCED基因在干旱胁迫中的作用,为进一步揭示西葫芦干旱胁迫的分子机制提供理论依据。
1 材料与方法
1.1 材料与处理
西葫芦福美6 号品种由母本M016 和父本F031杂交选育而成。试验选取50 粒饱满的西葫芦种子,清洗干净后用次氯酸钙溶液(100~200 mL·L-1)消毒10 min,用清水洗净残留的次氯酸钙,于福建省农业科学院福清东张基地蔬菜育苗大棚内,播种于50 孔穴盘中,托盘(28×54 规格)中每天浇水量为1 L。待西葫芦幼苗生长至两叶一心时期,选取生长良好、大小均一的幼苗停止供水进行干旱处理(0、1、2、3 和4 d),于每日上午9:00 测定叶片的水势、光合参数,每个处理3次重复。采集叶片立即用液氮速冻,-80℃保存,共采集5 组材料,15 个样品,用于后续ABA 含量测定和荧光定量PCR 试验材料。
1.2 试验试剂
TaqDNA Polymerase、dNTPs、pMD18-T simple 购自北京全式金生物技术有限公司,HiScript©ⅡSelect RT SuperMix for qPCR (+gDNA wiper)反转录试剂盒购自大连宝生物公司,基因扩增试剂盒Phanta Max Master Mix、荧光定量试剂盒ChangesQTMUniversal SYBR qPCR Master Mix、DL2000 plus DNA marker 购自南京诺唯赞生物科技有限公司,通用植物总RNA 提取试剂盒购于北京百泰克公司,胶回收试剂盒、质粒提取试剂盒购于美国Omega 公司,其他生化试剂和常规试剂均为超纯或分析纯级。
1.3 基因生物信息学分析
使用 DNAMAN Version 9 软件和 ProtParam(https:/ /web.expasy.org/protparam/)对蛋白一级结构进行预测;利用Prabi 在线软件(https:/ /npsa-prabi.ibcp.fr/)对蛋白进行二级结构分析;利用Wolf Psort 在线软件(https:/ /www.genscript.com/psort/wolf_psort.html)进行蛋白亚细胞定位预测;使用SWISS-MODEL(https:/ /swissmodel.expasy.org/interactive)进行蛋白模板比对,spdbv 软件构建该蛋白三级结构模型,VMD 软件进行蛋白模型呈现;利用MEGA 7 软件最大似然法构建进化树,1 000 次重复。
1.4 西葫芦CpNCED2 基因克隆
参考试剂盒说明提取西葫芦样品的总RNA 及合成cDNA 第一链。参考前期转录组测序库中搜索到的NCED基因全长序列,设计开放阅读框架(open reading frame,ORF)全长克隆引物,正向扩增引物CpNCED2-F:GCTTCTTCCCCTTCTCCTCCTTGTCTCG 和反向扩增引物CpNCED2-R:TCTGGAAAAGGCACCACAACAAAA TAAG,PCR 扩增产物经1.0%琼脂糖电泳、纯化、回收后,pMD18-T 载体进行连接、转化,PCR 检测后的阳性克隆进行测序验证。
1.5 基因定量引物设计及分析
采用在线引物设计软件(https:/ /sg.idtdna.com)设计基因CpNCED2-Fq:5′-ACCATCAATGACGGCTCT -3′,CpNCED2-Rq:5′-ACTCCGGTTCCCTTCTTAT-3′,并使用本研究前期克隆获得的CpActin作为西葫芦荧光定量PCR 内参基因[20-21]。参照试剂盒说明书,配制25 μL 的反应体系,在QuantStudio 7 Flex 实时荧光定量PCR 仪(美国ABI 公司)上进行扩增,反应体系:2 μL cDNA 模板,10 μL ChamQ Universal SYBR qPCR Master Mix,0.4 μL 正向引物CpNCED2-Fq (10 μmol·L-1),0.4 μL 反向引物CpNCED2-Rq (10 μmol·L-1),加ddH2O 至25 μL。PCR 反应条件:95℃预变性30 s,95℃变性5 s,60℃退火30 s,40 个循环。以上反应均重复3 次。在Excel 软件中采用2-ΔΔCt法分析处理数据并得出目的基因的表达情况。
1.6 西葫芦光合参数及叶片水势的测量
利用GFS 3000 光合测量仪(WALZ,德国)测量西葫芦叶片光系统Ⅱ最大量子效率(maximal quantum efficiency of photosystem Ⅱ,Fv/Fm)、净光合速率(net photosynthesis,Pn)、非光化学淬灭系数( nonphotochemical quenching,NPQ)和光化学电子传递效率(electron transfer efficiency,ETR)4 个光合指标。测量程序:首先将西葫芦叶片暗适应30 min,然后使用饱和脉冲光(12 000 μmol·m-2·s-1)测量暗适应后叶片的最大荧光(Fm);在叶片恢复正常光照10 min(800 μmol·m-2·s-1,光饱和点)后分别测定光合参数Fv/Fm、Pn、NPQ 和ETR,3 次重复。叶片水势的测量采用小叶流法,测定时间为早上9:00 左右,每个处理测定10 片。
1.7 西葫芦叶片ABA 含量的测定
参考Xiao 等[22]的方法。试验基于AB Sciex QTRAP 6500 LC-MS/MS 平台进行:利用超高效液相色谱(ultra performance liquid chromatography,UPLC)和串联质谱(mass spectrometry,MS/MS)对所有样本ABA 进行定性定量分析并采集数据;分别配制0.5、1、5、10、50 和100 ng·mL-1不同浓度的ABA 标准品溶液,获取各个浓度标准品的对应定量信号的质谱峰强度数据,绘制ABA 的标准曲线;将检测到的所有样本ABA的积分峰面积比值代入标准曲线线性方程进行计算,得到实际样本中ABA 的绝对含量。按照公式计算ABA 含量:
ABA 含量(ng·g-1)=B*C/100/D
式中,B 为样本中激素积分峰面积比值代入标准曲线得到的浓度值,ng·mL-1;C 为复溶时所用溶液的体积,μL;D 为称取的样本质量,g。
利用SPSS 19.0 数据处理软件中单因素方差分析法对上述基因表达、叶片水势、光合参数以及ABA 含量进行差异显著性分析。
2 结果与分析
2.1 西葫芦CpNCED2 基因的获得
前期对西葫芦叶片进行了转录组测序,获得25.5 Gb 有效数据,经组装和拼接得到高质量的Unigenes 序列83 650 条(序列平均长度为722.16 nt),其中Nr 注释获得12 893 条Unigene,并从中筛选(条件为E 值<10-5)得到一条全长为1 941 bp 的cDNA 序列,包含1个完整的ORF 和47 bp、127 bp 的上游和下游非编码区[23-24](图1)。同源性分析发现,该基因序列与NCBI已公布的中国南瓜(Cucurbita moschata,XM _023070380.1,E 值为0) 的核酸序列相似性高达98.15%,通过RT-PCR 扩增基因ORF 全长,经测序验证后,将该基因命名为CpNCED2(图2)。

图1 西葫芦CpNCED2 基因全长序列及其编码的蛋白分析Fig.1 Full-length sequence of the CpNCED2 gene of Cucurbita pepo and its encoded protein analysis

图2 CpNCED2 基因PCR 扩增产物Fig.2 PCR amplified product of CpNCED2 gene
2.2 基因序列的生物信息学分析
2.2.1CpNCED2 基因及其编码蛋白的一级结构分析序列分析表明,CpNCED2 基因cDNA 全长1 941 bp,ORF 为1 767 bp,分子式C2946H4556N814O861S18。利用EditSeq 5.01 和ProtParam 软件对西葫芦CpNCED2和中国南瓜、印度南瓜、丝瓜、甜瓜、黄瓜、葡萄和可可编码同源蛋白的组成成分及理化性质进行分析(表1)。结果表明,这些植物中NCED 蛋白的氨基酸残基数为588~613 个,理论相对分子质量为65.73~68.71 kDa,等电点(pI)为6.66~8.23。CpNCED2 基因编码蛋白的碱性氨基酸数略多于酸性氨基酸数,脂肪族氨基酸数明显多于芳香族氨基酸数。不同植物NCED 中氨基酸理化性质较为一致,存在的差异可能与蛋白非保守区域的氨基酸差异有关。分析发现,蛋白质总平均疏水性(grand average of hydropacthicity,GRAVY)为-0.3 左右,均属亲水性蛋白质。
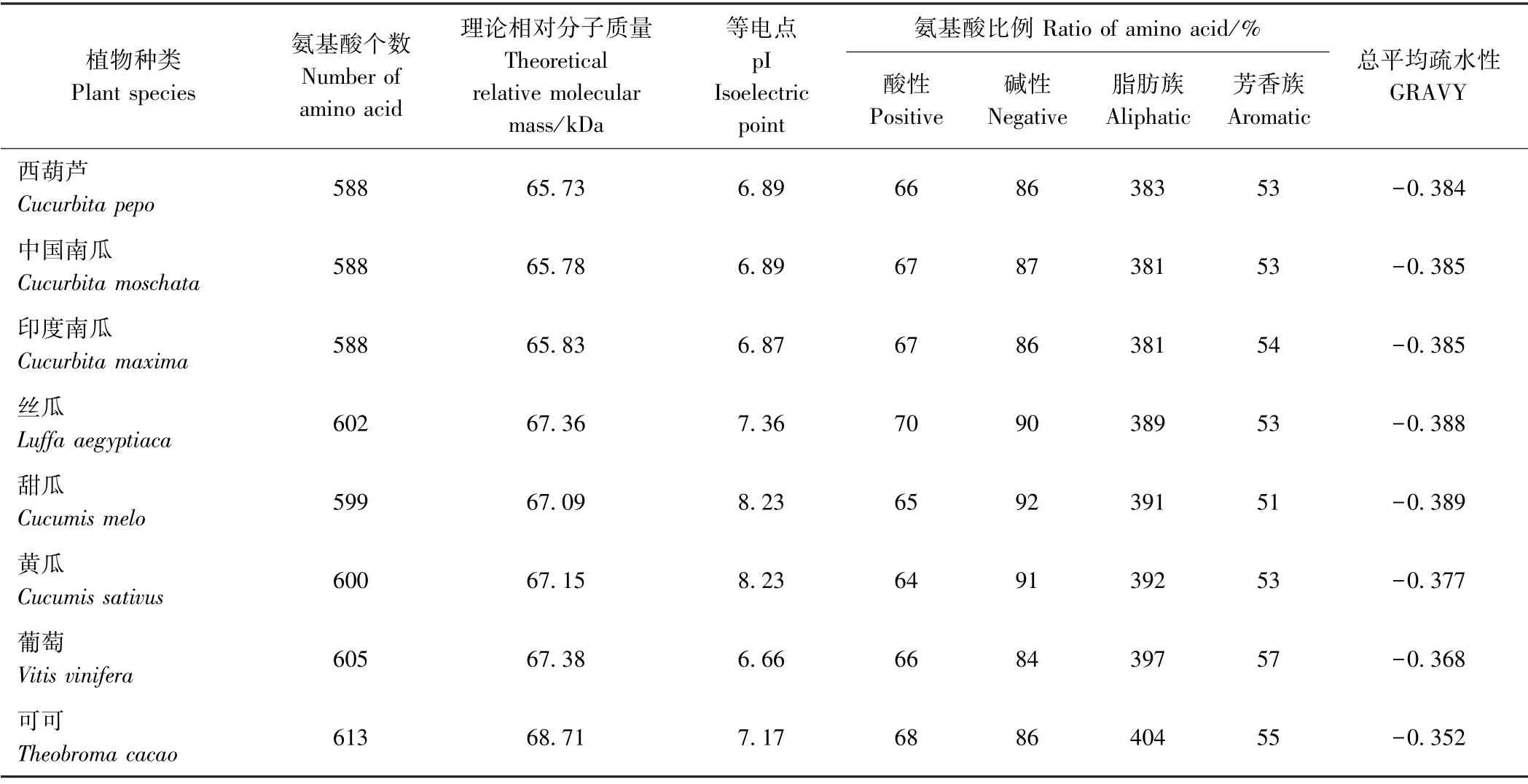
表1 不同植物来源NCED 的氨基酸组成成分及理化性质分析Table 1 The comparison of composition and physical and chemical characterization of amino acid of NCED from different plant species
2.2.2 CpNCED2 蛋白的二级、三级结构分析 西葫芦CpNCED2 蛋白二级结构分析显示,该序列中α-螺旋结构占比20.27%、β-折叠占比7.31%、β-转角占比72.62%(图3-A)。该蛋白三级结构如图3-B 所示,模型RF(ramachandran favoured)值为91.05%。

图3 CpNCED2 蛋白二级(A)和三级(B)结构预测Fig.3 Prediction of secondary(A) and tertiary(B)structure of CpNCED2
2.2.3 CpNCED2 蛋白的同源比对与进化分析 将西葫芦编码氨基酸序列与GenBank 数据库中其他植物NCED 序列进行比对,结果表明西葫芦CpNCED2(XP_023543156.1)与其他物种NCED 序列具有较高的同源性,其中与中国南瓜(XP_022926148.1)、印度南瓜(XP_022978939.1)、丝瓜(APO14274.1)、香瓜(XP_008439625.1)和黄瓜(XP_004134911.1)蛋白序列相似度较高,分别为99%、99%、85%、85%和84%,具有高度的保守性。Pfam 分析发现,CpNCED2 氨基酸序列含有4 个保守组氨酸位点(His284、His333、His398和His575)和2 个NCED 蛋白保守结构域(281~289和333~340 位)(图4)。

图4 CpNCED2 与其他物种中的同源蛋白的多重比对Fig.4 Multiple sequence alignment of CpNCED2 with other homologous sequences
对西葫芦和15 个物种的NCED 序列进行系统进化分析,西葫芦NCED 与甜瓜、黄瓜和丝瓜等葫芦科作物的NCED 蛋白同聚一类,亲源关系较近,与巴西橡胶树、木薯和麻风树等大戟科的NCED 蛋白亲缘关系较远,聚类结果与植物系统分类一致(图5)。
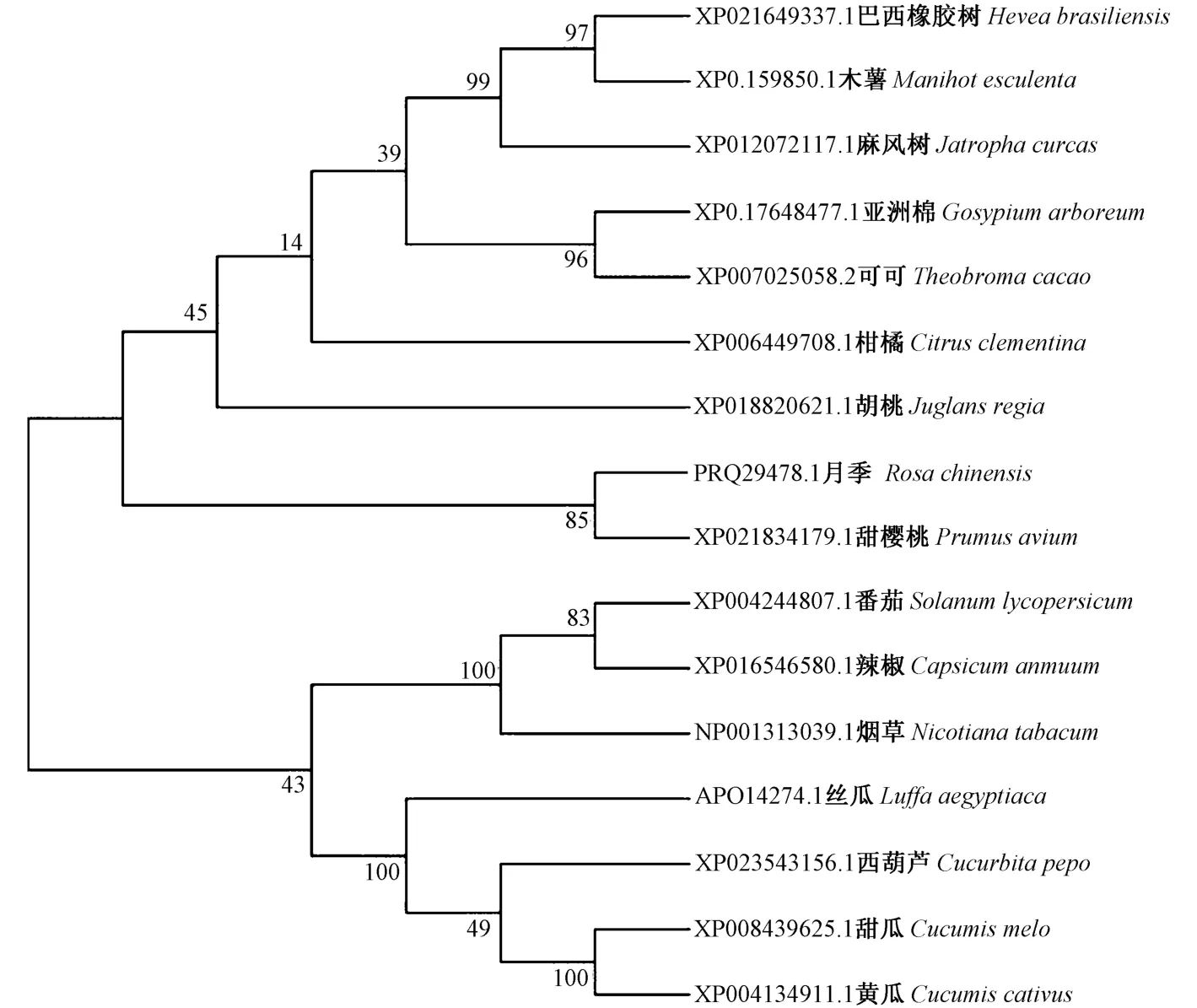
图5 NCED 蛋白分子进化分析Fig.5 Molecular phylogenetic analysis of NCED protein
2.3 干旱条件对西葫芦叶片光合特性的影响
采用小叶流法测定了西葫芦叶片中的水势变化,由图6可知,随着干旱胁迫的产生,西葫芦叶片的水势在停止浇水后0、1、2、3、4 d 逐渐降低,并达到显著差异水平(P<0.05)。
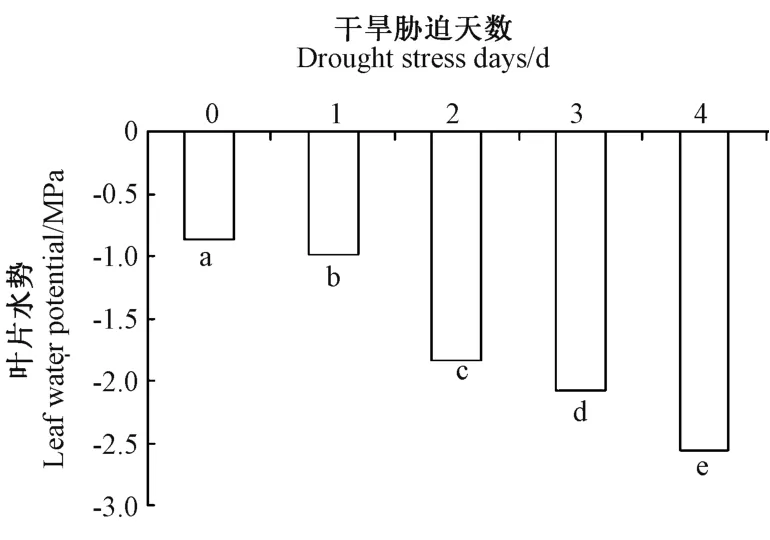
图6 干旱胁迫下西葫芦叶片水势变化Fig.6 The water potential changes in Cucurbita pepo leaves under drought stress
光合参数测定结果表明,干旱胁迫后1、2、3、4 d西葫芦叶片的Pn、Fv/Fm、NPQ 以及RTR 呈明显下调趋势,并达到显著差异水平(P<0.05),表明干旱胁迫后叶片的光合作用能力明显下调(图7)。

图7 干旱胁迫对西葫芦叶片光合特性的影响Fig.7 Determination of photosynthetic parameters of Cucurbita pepo under drought stress
2.4 干旱胁迫下西葫芦叶片中的ABA 含量变化
通过配置6 种不同浓度梯度ABA 标准品溶液,获取各个浓度梯度标准品对应信号的质谱峰强度数据,以标准品浓度(ng·mL-1)为横坐标,外标/内标峰面积比为纵坐标,得到标准曲线线性方程y=0.039 19x-0.001 80(相关系数R=0.997 43,权重=1/x)(图8)。

图8 ABA 测量的标准曲线Fig.8 The standard curve of ABA measurement
设定2.00E-01 和1 000 ng·g-1作为定量上限和下限,将西葫芦干旱处理(0、1、2、3、4 d)叶片ABA 的峰值代入标准曲线线性方程计算得到ABA 的绝对含量。结果表明,随着干旱胁迫天数的增加,西葫芦叶片中的ABA 含量逐渐升高,并达到了显著差异水平(P<0.05)(图9)。
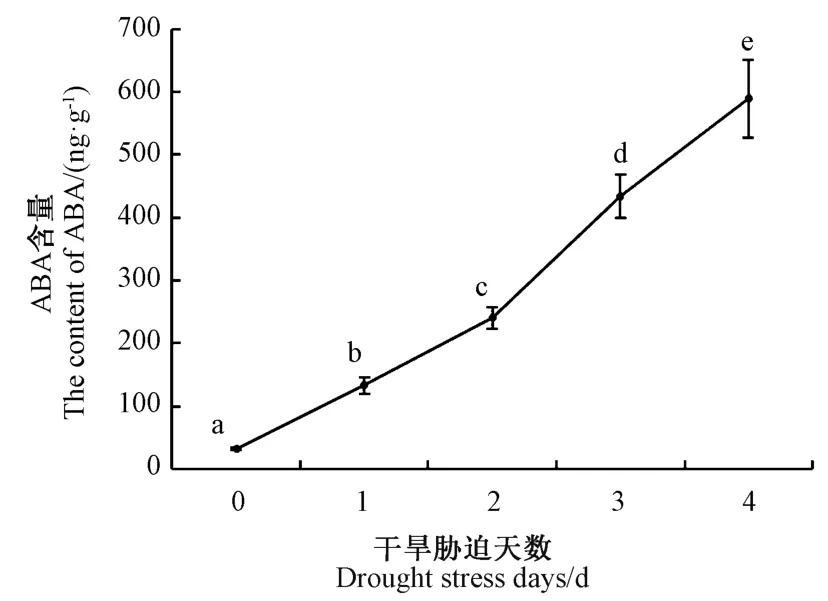
图9 干旱胁迫条件下西葫芦叶片ABA 含量的变化Fig.9 The ABA content of Cucurbita pepo leaves under drought stress
2.5 CpNCED2 基因在西葫芦干旱胁迫中的表达分析
荧光定量PCR 分析结果表明,伴随西葫芦干旱胁迫的产生,CpNCED2 基因在停止浇水后0、1、2、3 和4 d 呈现先上调后下调的表达趋势,1、2、3 和4 d 的表达量均高于0 d,基因表达量在3 d 时达到最高,上调倍数达到8 倍左右,达到显著差异水平(P<0.05)(图10)。
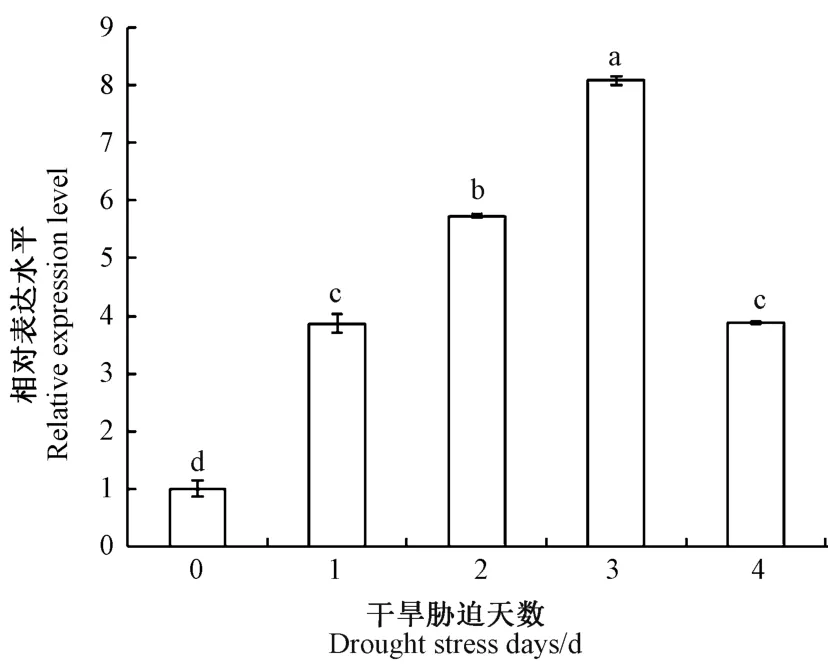
图10 干旱胁迫下西葫芦CpNCED2 的表达分析Fig.10 Expression analysis of CpNCED2 in Cucurbita pepo under drought stress
3 讨论
NCED基因在1997年首先从玉米ABA 缺失突变体viviparousl4(vpl4)中分离鉴定出来[14],随后从菜豆[25]、鳄梨[26]、拟南芥[27]、草莓[28]和苹果[10]等物种中被陆续克隆出来。目前,GenBank 上已经登录了西葫芦NCED基因家族片段,但国内外对于西葫芦NCED基因克隆和功能分析的研究报道较少。本研究从前期西葫芦转录组数据库中筛选得到1 条全长为1 941 bp 的cDNA 序列,与南瓜中NCED 的核酸序列相似性达到98.15%,包含1 个1 767 bp 的ORF,基因编码蛋白在Nr 中的功能注释为NCED(E 值为0)。同源性分析表明,西葫芦CpNCED2 与同为葫芦科的中国南瓜、印度南瓜和丝瓜等的NCED 蛋白序列具有很高的同源性,相似性均在85%以上,表明NCED 蛋白在进化过程中的保守性。蛋白系统进化分析表明,西葫芦CpNCED2 与甜瓜和黄瓜等葫芦科作物的NCED 蛋白亲源关系较近,聚为一类,与巴西橡胶树、木薯和麻风树等大戟科的NCED 蛋白亲缘关系较远。对CpNCED2 蛋白进行BLASTp 和Pfam 分析发现,CpNCED2 具有2 个高度保守的结构域,含有4 个保守组氨酸位点和2 个NCED 蛋白保守结构域,属于典型的RPE65 超级家族,亚细胞定位预测该蛋白在叶绿体中[29],表明CpNCED2 蛋白主要在叶绿体中起作用[30]。
叶片是植物光合作用的重要场所,水分的缺乏对其光合作用具有重要影响。研究表明,长期干旱胁迫显著降低辣椒、黄瓜等作物叶片中叶绿素含量,使其气孔导度(stomatal conductance,Gs)、光化学猝灭系数(qP)、天线色素捕光效率(Fv/Fm)以及光合作用关键酶RuBP 羧化酶活性明显下降,减缓淀粉等糖类物质运输,形成对光合作用反馈调节,从而显著降低Pn,影响植株的生长发育[31-33]。Ors 等[34]通过减少正常浇水量的67%对西葫芦幼苗进行干旱胁迫处理,发现25 d 后叶片蒸腾速率(Tr)、Gs、Pn 和植株鲜重分别下降62%、62%、69%和63%。Pn、Fv/Fm、NPQ 和ETR 等光合参数可作为衡量西葫芦叶片干旱胁迫程度的重要指标[35]。本研究结果发现,随着西葫芦干旱胁迫产生,停水处理0、1、2、3、4 d 后叶片中水势逐渐降低,其叶片中相应的光合指标Pn、Fv/Fm、NPQ 和ETR 也呈明显下调趋势,表明干旱胁迫对西葫芦叶片光系统造成了严重破坏,并导致叶片光合作用能力下降。
前人研究表明,ABA 对于植物迅速、有效地响应逆境胁迫具有重要作用,是干旱胁迫应答基因调控网络中的重要组成。NCED 是植物ABA 生物合成途径的关键限速酶,该基因的表达模式直接影响ABA 代谢合成,从而影响植物抵抗干旱等环境胁迫能力。植物中NCED基因能够响应干旱胁迫的产生,快速形成上调表达模式,与干旱程度显著相关。马铃薯(Solanum tuberosum)中[36],StNCED1 表达量在干旱胁迫后表现出先降低后升高趋势。糜子(P.miliaceumvar.compactrm)中[29],PmNCED1 的表达量随着PEG 胁迫时间延长而升高。水稻(Oryza sativa)中[37],OsNCED3基因的表达受干旱胁迫诱导,复水处理后其表达快速下调。本研究结果表明,伴随西葫芦叶片干旱胁迫的产生,其体内ABA 含量显著升高,CpNCED2 基因在停止浇水后0~4 d 内呈现先上调后下调的表达趋势,3 d时上调倍数达到8 倍左右,ABA 含量和CpNCED2 基因表达量的变化趋势基本一致。CpNCED2 基因在4 d时出现下调表达趋势,可能由于干旱胁迫后造成严重缺水,西葫芦叶片过度萎蔫,其中细胞内酶活性降低,导致体内mRNA 含量降低而引起总体基因表达量下降。综上所述,推测CpNCED2 基因能够快速响应干旱胁迫的产生,并在西葫芦叶片ABA 合成过程中起着重要调控作用,但相关研究结果还需要做进一步功能验证。
4 结论
本研究从西葫芦转录组数据库筛选出一条CpNCED2 基因,其全长1 941 bp,编码蛋白与中国南瓜和印度南瓜同源性均高达99%,具有高度的保守性。CpNCED2 编码的蛋白含有4 个保守组氨酸位点和2 个NCED 蛋白保守结构域,属于典型的NCED家族基因。分析发现,随着干旱胁迫天数的增加,西葫芦叶片中水势逐渐降低,Pn、Fv/Fm、NPQ 和ETR 等叶片光合指标显著下降,ABA 含量逐渐升高,CpNCED2 基因呈显著上调表达。因此,推测CpNCED2 基因在西葫芦干旱胁迫应答以及ABA 代谢合成过程中具有重要的调控作用。
