Th17/Treg失衡与毛细支气管炎发病关系研究
2021-07-28徐家新丁周志
徐家新,李 娟,王 磊,丁周志,周 瑞
毛细支气管炎是婴幼儿时期常见的下呼吸道感染性疾病,可由多种病毒感染引起,如呼吸道合胞病毒(RSV)、鼻病毒、腺病毒等[1],未来可能发展为支气管哮喘。其中仅最常见的RSV感染就可造成每年3 310万次急性发病、320万次住院治疗和11.82万例患儿死亡[2],且缺乏有效的特异性治疗措施,危害极大。毛细支气管炎发病机制至今未明[3],目前研究最多的是免疫学发病机制,其中Th17/Treg失衡参与哮喘的发病,但是否参与关于毛细支气管炎的研究相对较少。调节性T细胞(Treg)是免疫抑制T细胞,可分泌白细胞介素(IL)-10和IL-35等免疫抑制因子,对多种免疫细胞发挥抑制作用。辅助T淋巴细胞(Th17)是T淋巴细胞亚群的一种,属于促炎细胞,能够分泌IL-17等发挥作用,现有研究发现Th17可能参与毛细支气管炎的发病机制和免疫过程[4]。本研究通过检测毛细支气管炎患儿体内Th17、Treg以及相关细胞因子的水平,探讨Th17/Treg及细胞因子在疾病发生发展中的作用,为临床病情预判和治疗寻找靶点提供依据。
1 资料与方法
1.1 一般资料 选取我科2019年10月至2020年2月收治的毛细支气管炎患儿83例,其中男58例,女25例,年龄3.43(1.97,6.27)个月。诊断标准参照《儿科学》人民卫生出版社第9版和《诸福棠实用儿科学》第8版:(1)年龄在2岁以下;(2)以喘息和肺部哮鸣音为临床特征;(3)胸部X线检查可见不同程度的肺充气过度或斑片状浸润影,或者支气管周围炎及肺纹理增粗。排除标准:患慢性肺疾病(支气管肺发育不良)、先天性呼吸道发育异常、先天性心脏病、入院前4周应用丙种球蛋白和激素史、免疫功能缺陷和神经肌肉疾病等。本研究通过本院伦理委员会批准(批号:BYYFY-2020KY017),并告知患儿监护人研究相关情况,签署相关知情同意书。
病例组分组:患儿病情严重程度分组标准参照毛细支气管炎诊断、治疗与预防专家共识(2014年版)[5]。病例组分为轻症组(42例)、中症组(21例)和重症组(20例)。统计其年龄、性别、住院时间、出生方式、喂养方式、是否早产。同期健康体检儿童30名为对照组,其中男22名,女8名,年龄(4.38±2.84)个月。2组年龄、性别具有可比性。
1.2 试剂与仪器 HumanTh17/Treg Phenotyping Kit,IgG1-APC(APC标记的鼠抗人同型对照IgG1),IgG1-PE(PE标记的鼠抗人同型对照IgG1),溶血素、Foxp3固定/破膜剂、刺激剂/蛋白转运抑制剂、RPMI1640培养液采购自美国BD公司。检测仪器FACS Canto流式细胞仪(美国BD公司)。IL-6、IL-10、IL-17和IL-35试剂采购自上海酶联生物科技有限公司。血常规检测仪器希森美康XT-4000i。C反应蛋白(CRP)检测仪器自动生化分析仪COBAS8000。降钙素原(PCT)检测仪器免疫定量分析仪QMT8000,肝素结合蛋白(HBP)检测仪器Jetistar 3000。
1.3 方法 2组均于清晨采集空腹外周血静脉血3 mL行血常规、Treg、Th17、IL-6、IL-10、IL-17和IL-35检测,病例组另外采集外周血3 mL检测CRP、PCT、HBP。
流式细胞检测:抽取所有研究对象外周血各500 μL于试管中,用于流式细胞检测Th17、Treg细胞。
剩余外周血离心,分离血浆,-80 ℃保存,严格按照试剂盒说明操作,以所测标准品的吸光度值为横坐标,标准品的浓度值为纵坐标,在坐标纸上或用相关软件绘制标准曲线,并得到直线回归方程,将样品的吸光度值代入方程,计算出IL-6、IL-10、IL-17和IL-35的水平。
1.4 统计学方法 采用单因素方差分析、LSD检验。偏态分布计量资料以M(P25,P75)描述,采用Kruskal-Wallis检验和Mann-WhitneyU检验及Pearman相关分析和logistic回归分析。
2 结果
2.1 对照组和病例组一般资料及相关指标检测结果的比较 病例组各组Th17、Th17/Treg、IL-6、IL-17较对照组升高,而Treg、IL-6、IL-10较对照组降低,差异均有统计学意义(P<0.05);性别、年龄、白细胞计数、中性粒胞计数、淋巴细胞计数、嗜酸细胞计数、CRP、PCT、HBP各组差异均无统计学意义(P>0.05)(见表1~2)。
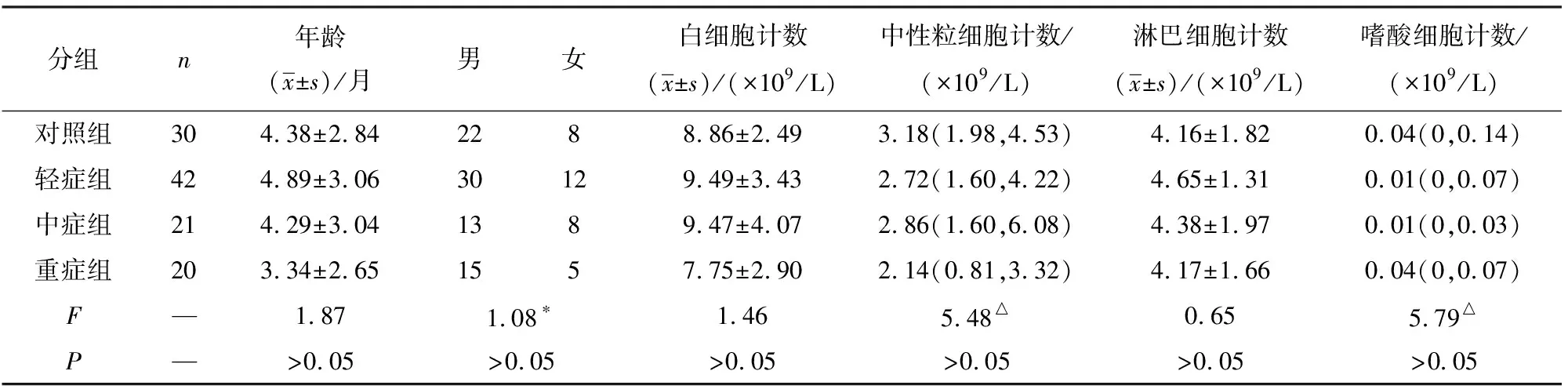
表1 对照组和病例组之间一般资料比较[M(P25,P75)]
2.2 病例组间各组相关指标比较 重症组Th17、Th17/Treg、IL-6、IL-17较中症组和轻症组均增高,Treg、IL-10、IL-35较轻症组降低,差异均有统计学意义(P<0.05);中症组和轻症组间差异无统计学意义(P>0.05);CRP、PCT、HBP、住院时间、早产率、剖宫产率、喂养方式各组差异均无统计学意义(P>0.05)(见表2~3)。

表2 对照组和病例组之间各项实验指标比较[M(P25,P75)]
2.3 病例组Th17、Treg和细胞因子间Pearson相关分析 病例组Th17与Th17/Treg、IL-17、IL-6呈正相关,与IL-35呈负相关;Treg与IL-10、IL-35呈正相关,与Th17/Treg负相关;Th17/Treg与IL-17、IL-6之间呈正相关,与IL-10、IL-35负相关;IL-17与IL-6呈正相关,与IL-35呈负相关(P<0.05~P<0.01)(见表4)。
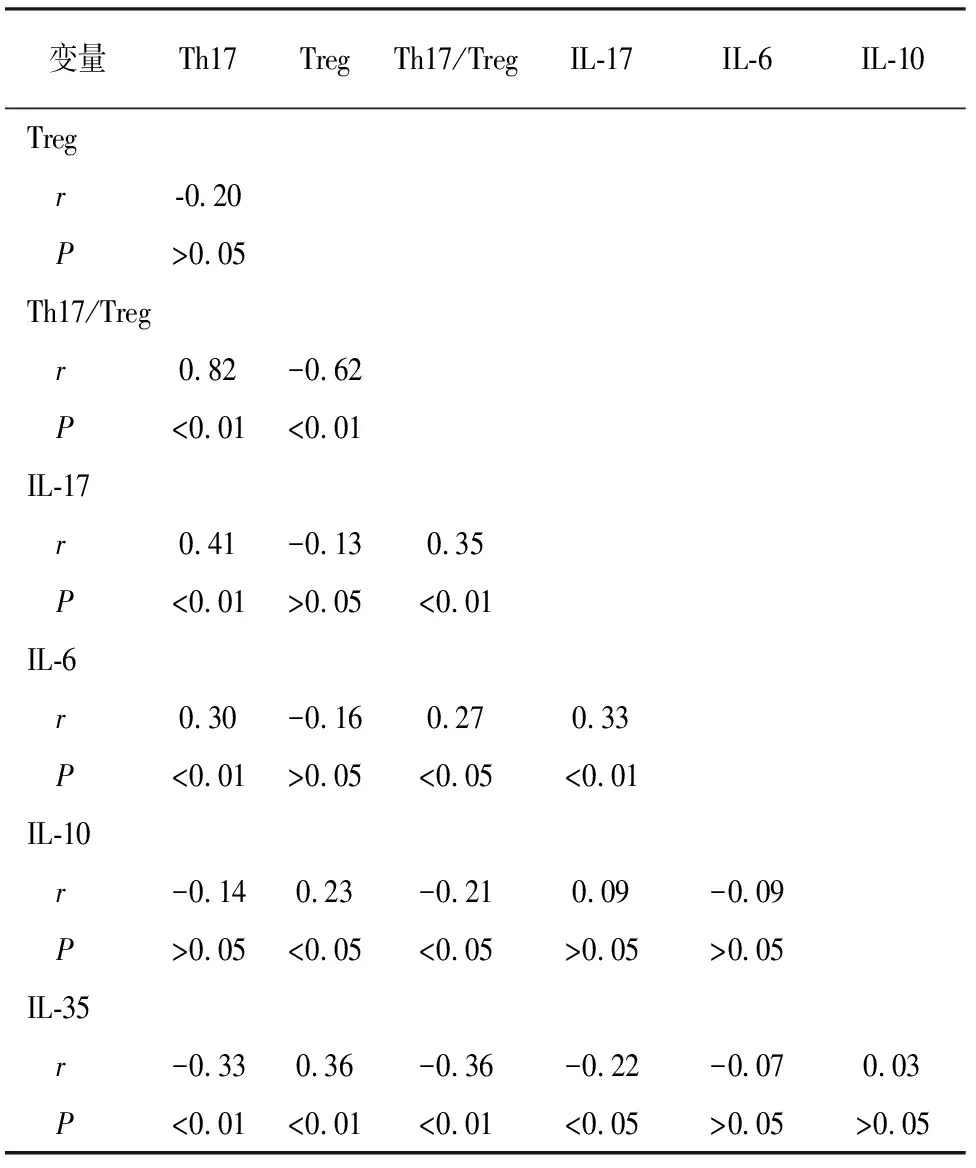
表4 Th17、Treg及相关细胞因子之间相关性分析
2.4 重症毛细支气管炎的危险因素分析 以重症、非重症为因变量,Th17/Treg、IL-17、IL-6、IL-10、IL-35为自变量,进行logistic回归分析,结果显示Th17/Treg、IL-17和IL-6是毛细支气管炎的重症危险因素(P<0.05~P<0.01)(见表5)。

表5 重症毛细支气管炎危险因素logistic回归分析
3 讨论
毛细支气管炎是以喘息、吸气性三凹征、肺部可闻及哮鸣音和细湿啰音为主要临床特征的急性下呼吸道感染疾病,在6月龄以下的婴儿中具有较高病死率,病理生理以中性粒细胞快速浸润、黏液分泌过多和CD8+T细胞反应延迟为特征,其中RSV感染最为常见。有研究[6]发现人RSV毛细支气管炎患儿发展为哮喘的概率约为正常患儿的3倍。关于毛细支气管炎的具体发病机制尚不完全清楚,但存在多种免疫异常反应,且与哮喘的发病有着相似的免疫学机制,其中Th17/Treg失衡被认为可能是其主要发病机制。

表3 病例组间临床资料和实验指标比较[M(P25,P75)]
Th17和Treg细胞均是辅助T细胞家族中的成员,Th17主要起到促炎的作用,而Treg是抑制免疫的调节细胞,它们在分化上相互拮抗,功能上相互对立,Th17/Treg的平衡对机体的免疫稳态起到重要的作用。Th17细胞能分泌多种细胞因子如IL-17、IL-6、IL-22等参与炎症反应,其中最主要的效应因子是IL-17,通过诱导其他炎性细胞因子的表达来调节炎症细胞的局部浸润,从而引起组织损伤。在动物实验中[7],有学者在RSV感染的小鼠肺泡灌洗液中发现IL-17明显增高,并引起气道内黏液分泌增加。IL-17通过直接上调人气管和支气管上皮细胞株中黏液基因MUC5B的转录而促进黏液的产生。Th17在CD8+T淋巴细胞上与IL-17RA结合,从而导致IL-17的产生,削弱了它们降低病毒载量和减少肺部感染细胞数量的能力。中和抗IL-17抗体可减少黏液分泌和IL-13的产生并增加病毒清除的能力,进一步支持了过量IL-17在促进病理中的作用[8]。袁林等[9]对比了健康儿童和毛细支气管炎患儿体内细胞因子的变化,结果显示毛细支气管炎患儿血清IL-17较对照组增高,研究说明Th17和IL-17的促炎作用在毛细支气管炎的发病和疾病发展中起着重要的作用。而IL-6在Th17的分化调控中起着重要的作用。感染促使机体分泌大量IL-6,与TGF-β协同激活Th17分化的关键因子维甲酸类孤核受体γt(RORγt),诱导Th17增殖[10]。过度分化的Th17继续分泌IL-6和IL-17,使得机体免疫进一步失衡,加剧炎症反应。在本研究的结果中可以发现,毛细支气管炎患儿Th17比例、IL-6和IL-17较对照组增高,重症组较轻症组增高,与以上研究结果大致相同,并且三者之间相互呈现正相关关系,说明毛细支气管炎患儿体内Th17及其细胞因子明显增高,抑制病毒清除和加剧炎症,重症病例更加明显。
Treg细胞不仅抑制过度增生和病理性T细胞反应,而且限制Th2型免疫反应,并对新生小鼠的病毒增殖起抑制作用[11]。因此,Treg细胞不仅能在RSV感染期间驱动适当的抗病毒反应,而且能抑制疾病的发展。在缺乏Treg的小鼠体内形成的过度炎症环境可直接导致T效应细胞异常活化,并将其归巢到呼吸道外的多种组织部位,从而延长病程[12]。Tregs可以通过直接细胞-细胞接触阻断TCR信号和IL-2信号来抑制传统的T细胞增殖[13],还可以产生IL-10和TGF-β来抑制其他T细胞亚群的发育和功能。其中IL-10可抑制RSV感染小鼠的疾病和炎症,研究[14]发现IL-10是控制急性病毒性肺感染炎症反应的关键,IL-10缺乏小鼠的T细胞不能自我调节IFN-γ的产生,这可能导致IL-10缺乏小鼠RSV感染后期免疫损伤的加剧。IL-35是IL-12异二聚体细胞因子家族的新成员,可通过抑制Th2相关细胞因子,如IL-17 等的产生,限制Th2细胞增殖,从而逆转Th2细胞依赖性气道高反应。Treg 细胞主要通过产生IL-35,将Th17细胞阻滞在G1期,而不是诱导细胞凋亡,从而抑制Th17细胞分化和IL-17因子释放来发挥免疫抑制作用,并具有诱导iTr35(IL-35诱导的CD4+Treg细胞)增殖的能力[15]。动物实验中小鼠体内IL-35水平升高可显著诱导Treg细胞和Th2增强,而体外研究提供了相似的结果,提示IL-35对T细胞亚群的进化具有免疫抑制作用。IL-35显著抑制CD4+T细胞增殖和IL-2释放,增加Treg细胞和IL-10[16]。临床研究中,唐艳丽等[17]发现毛细支气管炎患儿Treg细胞比例以及血清IL-4、IL-10水平在治疗前明显低于对照组,治疗后较前明显升高。本研究与其研究结果基本一致,Treg、IL-10、IL-35在病例组和对照组间有差异,病例组明显降低,重症组愈加显著,说明Treg增殖抑制和IL-10、IL-35的分泌减少在本病的免疫机制中起着重要的作用。IL-35与Th17/Treg、Th17和IL-17呈负相关,说明IL-35可能是抑制Th17和IL-17的重要因子。通过logistic回归分析,我们探讨了重症与轻症毛细支气管炎相关因素,最终发现Th17/Treg、IL-17和IL-6是毛细支气管炎发展为重症的独立危险因素。
综上所述,Th17/Treg免疫失衡,特别是Th17及其分泌的促炎因子IL-17、IL-6的过度增殖和分泌降低了机体对病毒清除能力,气道内黏液增多,炎症反应加剧,可能是导致毛细支气管炎患儿病情的加重并延长住院时间的重要因素。而IL-35可能是抑制Th17和IL-17的细胞因子,成为一种针对毛细支气管炎免疫失衡新的治疗和预防策略。
