卵巢癌风险预测模型(ROMA)指数鉴别卵巢肿块良恶性的价值
2021-07-27郭玉娥徐广鲜卜祥静
郭玉娥 徐广鲜 李 静 卜祥静 陈 莉
(银川市妇幼保健院妇科,宁夏 银川 750001)
卵巢肿块是女性常见病,在近20%的卵巢肿块女性中发现,其中15%~20%是卵巢癌[1],而卵巢恶性肿瘤具有临床转移早、发现时已为晚期、治疗效果差等特点[2],但随着影像诊断技术的发展,卵巢肿块可在没有任何症状时得以发现,其中一些为生理性囊肿并不需要治疗,因此,发现卵巢肿块后进一步鉴别其良恶性已是临床亟待解决的问题。CA125是最早用于卵巢癌检测的肿瘤标志物,但特异性差,卵巢癌风险预测模型(risk of ovarian malignancy algorithm,ROMA)将患者的绝经因素与CA125、HE4结果经过计算得出对绝经前后妇女卵巢癌高低风险百分比,二者联合提高了对卵巢癌诊断的灵敏性和特异性[3-8],本研究以超声检查发现卵巢包块的女性为研究对象,测定CA125、HE4血清值并根据公式生成ROMA值,根据手术后的病理结果作为金标准,评估ROMA在鉴别卵巢肿块良恶性的临床价值。
1 资料与方法
1.1 一般资料 患者来自2015年6月至2016年12月收治于本院的卵巢肿块患者200例分为4组,卵巢囊肿组(组1)50例,卵巢子宫内膜异位囊肿组(组2)53例,卵巢良性肿瘤组(组3)62例,卵巢恶性肿瘤组(组4)35例。卵巢恶性肿瘤患者排除既往有卵巢癌及其他部位恶性肿瘤,所有病例行腹腔镜或开腹手术,并经病理检查确诊。留取患者年龄、绝经状态、术前血清CA125及HE4数值,术后病理结果,卵巢癌患者做手术病理分期。
1.2 方法 患者晨起抽取空腹肘静脉血3 mL以检测血清CA125、HE4浓度,测试仪器为全自动电化学发光免疫分析仪COBAS6000E601,CA125及HE4酶联免疫分析试剂盒由瑞士罗氏诊断产品有限公司提供,步骤按说明书严格操作,CA125≥35 U/mL为阳性。截断值根据说明书的推荐,绝经前:ROMA>11.4%,HE4≥92.1 pmol/L提示上皮性卵巢癌高风险,ROMA<11.4%,HE4<92.1 pmol/L提示上皮性卵巢癌低风险。绝经后:ROMA>29.9%,HE4≥121 pmol/L提示上皮性卵巢癌高风险,ROMA<29.9%,HE4<121 pmol/L提示上皮性卵巢癌低风险。超声应用美国GE公司生产的VolusonE8彩色超声诊断仪,经腹探头频率为3.5~5 MHz,阴式超宽探头频率5~9 MHz,经腹或经阴扫描子宫及双附件区。发现卵巢包块后记录其大小、形态、边界、回声,同时测量包块有无血流,若有血流者其峰值速度以及相关指标情况。
1.3 ROMA ROMA计算公式:预测指数(PI)的计算公式如下:绝经前女性:PI=-12.0+2.38×LN(HE4)+0.0626×LN(CA125)绝经后女性:PI=-8.09+1.04×LN(HE4)+0.732×LN(CA125)将计算出的PI值代入公式:ROMA值(%)=(PI)/[1+exp(PI)]
1.4 统计学方法 采用SPSS23.0进行统计学分析。分类资料采用χ2检验,定量资料采用方差分析、多重比较的最小显著法(LSD)或duncan法,并经方差齐性检验。通过ROC曲线及AUC评价诊断效能(ROC曲线下面积<0.70,提示诊断准确度较低;在0.7~0.9提示示诊断准确度中等;>0.90提示诊断准确度较高)。通过Kappa系数衡量ROMA与术后病理诊断的吻合程度(Kappa系数<0.4,提示吻合度较弱;Kappa系数0.4~0.7,提示吻合度一般;Kappa系数>0.7,提示吻合度较强)。
2 结果
2.1 疾病分布特征 4组年龄17~70岁,平均年龄(37.41±11.46)岁;200例患者中,绝经前175例,绝经后25例。术后病理结果:良性卵巢包块165例(82.50%),恶性卵巢恶性肿瘤35例(17.50%)。卵巢囊肿组年龄与其他3组比较有统计学意义(P=0.000)。
2.1.1 卵巢囊肿组50例(组1)包括卵巢单纯囊肿30例,卵巢黄体囊肿11例,卵巢卵泡囊肿9例。年龄17~54岁,平均年龄(34.89±10.02)岁。绝经前47例(94.00%),绝经后3例(6.00%)。
2.1.2 卵巢子宫内膜异位囊肿组53例(组2)包括绝经前52例(98.11%),绝经后1例(1.89%)。患者年龄22~52岁,平均年龄(33.65±7.10)岁。
2.1.3 卵巢良性肿瘤组62例(组3)绝经前51例(82.26%),绝经后11例(17.74%);卵巢浆液性腺瘤15例(24.19%),卵巢黏液性腺瘤10例(16.13%),卵巢纤维卵泡膜瘤1例(1.61%),卵巢成熟性畸胎瘤36例(58.06%)。患者年龄19~70岁,平均年龄(37.18±12.95)岁。
2.1.4 卵巢恶性肿瘤组35例(组4)包括绝经前25例(71.43%),绝经后10例(28.57%)。患者年龄23~62岁,平均年龄(47.26±10.63)岁。依据2013国际妇产科联盟(FIGO)手术病理分期标准进行病理分期,Ⅰ~Ⅱ期卵巢癌21例(60.00%),Ⅲ~Ⅳ期卵巢癌14例(40.00%);病理类型:卵巢浆液性腺癌23例(65.71%),卵巢黏液性腺癌6例(17.14%),卵巢子宫内膜样腺癌1例(2.86%),卵巢透明细胞癌1例(2.86%),卵巢纤维肉瘤1例(2.86%),卵巢未成熟性畸胎瘤1例(2.86%),卵巢颗粒细胞癌1例(成人型)(2.86%),转移性卵巢癌1例(胃癌转移)(2.86%)。
2.2 各组ROMA水平及检出率比较 组4患者ROMA指数中位数为63.88,与其他3组中位数比较差异均有统计学意义(P=0.000),组1、组2与组3组组之间血清ROMA指数的中位数差异无统计学意义(P=0.712)。根据计算软件提供的绝经前、绝经后临界值,高于临界值者归入高风险(检出阳性),反之,归入低风险(检出阴性)。165例卵巢良性病变及35例卵巢恶性肿瘤组ROMA检出率见表1。组4与其他3组ROMA检出率差异均有统计学意义(χ2=120.6,P=0.000),组1、组2与组3,3组间ROMA检出率差异均无统计学意义(P=0.120、P=0.160、P=0.820)。其中卵巢良性病变患者中,划入CA125高风险的41例患者在ROMA组37例为低风险90.3%(37/41)。卵巢恶性肿瘤组中,划入CA125低风险的6例患者在ROMA组5例(83.3%)为高风险。

表1 各组ROMA中位数及检出率比较
2.3 绝经前与绝经后ROMA水平及检出率比较 卵巢恶性肿瘤组及卵巢良性病变组绝经前后中位数见表2。卵巢恶性肿瘤组,绝经前与绝经后ROMA两组间中位数差异无统计学意义(F=3.579,P=0.067)。卵巢良性病变组,绝经前与绝经后ROMA中位数差异均无统计学意义(F=0.001,P=0.975)。35例卵巢恶性肿瘤患者中,绝经前24例(68.6%),划入ROMA高风险组21例(87.5%),3例划入ROMA低风险组;绝经后组11例(31.4%),划入ROMA高风险组10例(90.9%),1例划入ROMA低风险。165例卵巢良性病变患者中,绝经前152例(92.1%),划入ROMA高风险组11例(7.2%),141例划入ROMA低风险组;绝经后13例(7.9%),13例在ROMA均划入低风险。卵巢恶性肿瘤组与良性病变组绝经前后ROMA检出率差异均有统计学意义(χ2=89.761,P=0.000;χ2=20.264,P=0.000)。见表2。

表2 卵巢良恶性肿物绝经前后ROMA中位数及检出率比较
2.4 ROMA与卵巢癌病理分型的关系 35例卵巢恶性肿瘤患者中,卵巢浆液性腺癌23例,卵巢黏液性腺癌6例,其他卵巢肿瘤6例(卵巢子宫内膜样腺癌、卵巢透明细癌、卵巢纤维肉瘤、卵巢未成熟性畸胎瘤、卵巢颗粒细胞瘤),其ROMA中位数分别为84.2、23.45、18.93,卵巢浆液性肿瘤组与其他组ROMA中位数差异有统计学意义(F=57.725,P=0.000),黏液性肿瘤组与其他组ROMA差异无统计学意义(F=4.527,P=0.638);各组ROMA划入高风险比例。见表3。
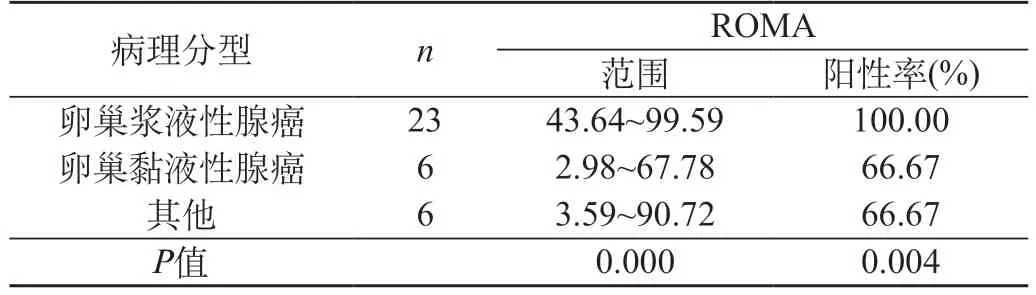
表3 ROMA与卵巢癌病理分型的关系
2.5 ROMA与卵巢癌分期的关系 早期恶性肿瘤(Ⅰ~Ⅱ期)ROMA中位数分别为49.85,晚期卵巢恶性肿瘤(Ⅲ~Ⅳ期)中位数为81.72,早期卵巢恶性肿瘤ROMA中位数与晚期的比较,差异有统计学意义(F=4.431,P=0.043)。早期卵巢恶性肿瘤中ROMA检出率80.9%,晚期检出率为92.9%。早期卵巢恶性肿瘤及晚期卵巢恶性肿瘤ROMA检出率差异无统计学意义(χ2=0.972,P=0.324)。见表4。

表4 ROMA与卵巢癌分期的关系
2.6 血清CA125、HE4和ROMA工作曲线分析 卵巢癌以术后病理结果为标准,卵巢恶性病变为病例组,卵巢良性病变为参考组,绘制ROC曲线图比较卵巢癌的诊断效能:ROMA的AUC为0.924,95%CI0.848~1.000(绝经前AUC为0.858,绝经后AUC为0.986),结果显示ROMA的鉴别诊断效能较好,在特异度为90%、95%、98%时,ROMA检测对应的敏感度为88.6%、85.7%、85.7%。特异度设定为75%时,卵巢包块患者ROMA诊断敏感度为91.4%,其中绝经前患者敏感度为79.2%,绝经后为100%。见图1。

图1 血清CA125、HE4和ROMA受试者工作特征曲线
2.7 ROMA对卵巢恶性肿瘤诊断价值的比较 ROMA对卵巢恶性肿瘤诊断的特异度、敏感度、阳性预测值、阴性预测值、准确率见表5。无论是绝经前还是绝经后,ROMA的灵敏度和阴性预测值、准确率也处于一个高的水平。

表5 ROMA对卵巢恶性肿瘤的诊断价值
2.8 绝经前、后盆腔包块中ROMA术后病理比较 200例卵巢包块患者中,绝经前176例(卵巢良性病变152例,恶性肿瘤24例),绝经后24例(卵巢良性病变13例,恶性肿瘤11例),其ROMA与术后病理符合情况见表6。ROMA与术后病理的吻合度进行比较:绝经前,Kappa=0.62,P=0.000,有统计学意义,吻合度一般;绝经后Kappa=0.832,P=0.000,有统计学意义,吻合度强。见表6。

表6 绝经前后盆腔包块中ROMA与术后病理比较
3 讨 论
2009年,Moore等通过logistic回归分析建立的相应的数学模型,即卵巢恶性肿瘤风险预测模型(ROMA)。ROMA未关注血清CA125及HE4的临界值,仅将实际检测到的血清CA125、HE4浓度,根据绝经状态输入至相应的公式,得到罹患卵巢恶性肿瘤的风险概率。
本研究显示:卵巢恶性肿瘤组患者ROMA中位数为63.88,与其余3组病变组中位数差异均有统计学意义(P=0.000)。早期卵巢恶性肿瘤ROMA中位数为49.85,晚期为81.72,差异有统计学意义(P<0.043)。卵巢恶性肿瘤组与良性病变组绝经前后ROMA检出率差异均有统计学意义(P=0.000)。以卵巢良性病变为对照组,绘制ROC曲线,结果显示:在特异度为90%、95%,98%时,ROMA检测对应的敏感度为88.6%、85.7%、85.7%。特异度设定为75%时,对于所有盆腔包块患者,ROMA诊断敏感度为91.4%(绝经前敏感度为79.2%,绝经后敏感度100%)。ROMA的敏感度为90.91%,灵敏度高时可减少漏诊率,提高诊断率。ROMA的阴性预测值绝经前为81.25%,绝经后为92.31%,阴性预测值高时,其可信度更高,可以更多的排除患者罹患恶性肿瘤的可能,避免不必要的手术。ROMA的AUC为0.924(绝经前为0.858,绝经后为0.986),HE4的AUC为0.908,ROMA与术后病理诊断吻合系数(绝经后)Kappa=0.832,二者吻合度强,ROMA的检测提高了区分卵巢癌患者和非卵巢癌患者的鉴别能力,尤其是绝经后患者。
在ROMA诊断体系中,ROMA具有较高的敏感性,对卵巢良恶性的鉴别诊断上有较高的临床价值,ROMA检测只需抽取空腹肘静脉血,操作简便,检测方法客观,创伤小,有强的可重复性,更适宜临床的广泛应用,可合理分流卵巢包块患者,为术前评估提供重要的参考价值。
