EDTA滴定法测水总硬度实验方法
2021-07-27胡莹露
吴 丹, 胡莹露
(1.浙江大学生物系统工程与食品科学学院,杭州310027;2.杭州陆恒生物科技有限公司,杭州310016)
0 引 言
钙、镁是人体中必不可少的微量元素,在人们的日常饮食饮水问题上既要保证钙镁元素的摄入,也要防止过量[1]。而我国的水质硬度总体偏高[2],尤其是在一些北方地区,水质硬度过高会造成生产设备的破坏,对人体健康的危害以及诸多人们在日常生活中的不便[3],因此对水质硬度的检测尤为重要。
水体中构成水质硬度的金属离子主要有钙、镁、铁、铝等金属离子,而除钙离子和镁离子之外,其他金属离子含量甚微,故通常将钙、镁含量的总和称为水的总硬度[4]。目前水硬度的检测方法已逐渐趋于成熟化,具体方法有EDTA滴定法、分光光度法、离子色谱法、原子吸收法等[4-7],人们最常采用的方法是我国的环境标准分析方法中的EDTA滴定法,该法操作简单易于实现,其原理[8]是在pH10的条件下,铬黑T与钙镁离子络合,呈现紫红色,滴加EDTA二钠同溶液中的钙、镁离子进行络合,直至终点,铬黑T被完全游离出来,溶液由紫红色转变为铬黑T本身的天蓝色。对于蓝色终点的判断往往取决于操作者判断颜色的经验,存在较大的主观性,且不同环境中钙镁离子浓度不同,以及铬黑T溶液的稳定性较低,分析结果的重现性和精确性往往会存在一定的误差。
为了探究EDTA滴定法在测定不同浓度钙镁离子含量时的精确性问题,本文探讨了EDTA滴定法中不同滴定条件下的精确性问题,并用于自来水和河水的检测。同时介绍了一种置换分光光度法测总硬度,为解决EDTA滴定法在实际操作过程中针对不同硬度水质检测精确度不够的检测问题提供一些新想法。
1 实验部分
1.1 试剂配制及仪器
不加EDTA二钠镁的pH=10氨性缓冲溶液:将16.9 g氯化铵溶于143 mL氨水,用水稀释至250 mL(另外相同的氨性缓冲溶液中加EDTA二钠镁1.25 g,用于配制加EDTA二钠镁的缓冲溶液)。
含1 mmol/L EDTA和1 mmol/L镁离子的氨性缓冲溶液:将16.9 g氯化铵,93.1 mg EDTA,61.6 mg分析纯七水硫酸镁,溶于143 mL氨水,稀释定容至250 mL容量瓶。
10/5/2 mmol/L的EDTA二钠标准溶液:准确称取3.725 g在80°C下干燥2 h的EDTA二水合物,溶于适量水后定容至1 L容量瓶。
10/5/2 mmol/L钙标准溶液:准确称取1.000 9、0.500 5、0.200 2 g在150°C下干燥2 h的碳酸钙于烧杯中,先用少量水润湿后,缓慢加入4 mol/L的盐酸至碳酸钙完全溶解,再用适量水稀释后静置,定容至1 L容量瓶。
10/5/2 mmol/L镁标准溶液:准确称取2.033、1.016 5、0.406 6 g六水合氯化镁,溶于适量水中,定容至1 000 mL容量瓶。
固体铬黑T(EBT)粉末试剂:将0.5 g铬黑T与100 g氯化钠充分研磨混合,过40~50目筛。
1.5 mmol/L EBT显色剂溶液:69.2 mg铬黑T和150 mg盐酸羟胺溶于适量无水乙醇,100 mL容量瓶定容。
自来水(杭州江干区朝阳工业园)、河水(杭州江干区朝阳工业园,若河水中含有大量微小颗粒物,采样后应尽快用0.45μm孔径的过滤器过滤)。
将配制好的10 mmol/L的钙、镁离子进行稀释配制浓度为0.5~5.0 mmol/L的钙、镁离子标液(对应碳酸钙硬度为50~500 mg/L)。
以上所有用到的试剂均为分析纯试剂;紫外分析仪DR3900,哈希水质分析仪器上海有限公司。
1.2 试验方法
10/5/2 mmol/L的EDTA二钠标准溶液的标定分别用10/5/2 mmol/L的钙标准溶液进行标定。测定操作方法参考GB/T 7477-87[8],准确移取50 mL待测试样于250 mL锥形瓶中,加4 mL缓冲溶液和50~100 mg铬黑T干粉指示剂,不断振摇下用各浓度的EDTA标准溶液进行滴定,溶液由紫红色刚好变为天蓝色为滴定终点,滴定时间控制在5 min内。由于取用的自来水和河水中干扰离子浓度较低,本工作所有试验均未加掩蔽剂。对氨性缓冲溶液进行加EDTA二钠镁和不加EDTA二钠镁处理,考察EDTA二钠镁的添加对测定钙、镁离子溶液时的精确度的影响,并分别对钙标液和镁标液进行单独滴定。适当稀释EDTA浓度对不同浓度的钙镁离子进行滴定并进行加标回收率计算,考察不同浓度EDTA二钠溶液在测定钙、镁离子以及钙镁混合标液含量时的准确度。
实验中所有钙离子、镁离子浓度均转化为碳酸钙浓度计算。钙、镁总量用下式进行计算:

式中:c2为EDTA浓度,mmol/L;v2为滴定中消耗的EDTA的体积,mL;v1为试样体积,mL。
配制浓度梯度为0~5 mmol/L镁离子标准溶液用于制作分光光度法工作曲线,在波长520 nm下测定其吸光度,以镁离子浓度为纵坐标,吸光度为横坐标,绘制标准曲线。加标实验以自来水和河水直接配制加标标液,加标标液中钙/镁为3∶1,计算回收率。
2 实验结果
2.1 EDTA二钠镁对滴定精确度的影响
用5 mmol/L的EDTA溶液和缓冲溶液1、2对浓度梯度的钙离子和镁离子的进行单独滴定,滴定结果列于表1、2。EDTA滴定过程中,溶液中主要存在的平衡关系[9]如下所示:
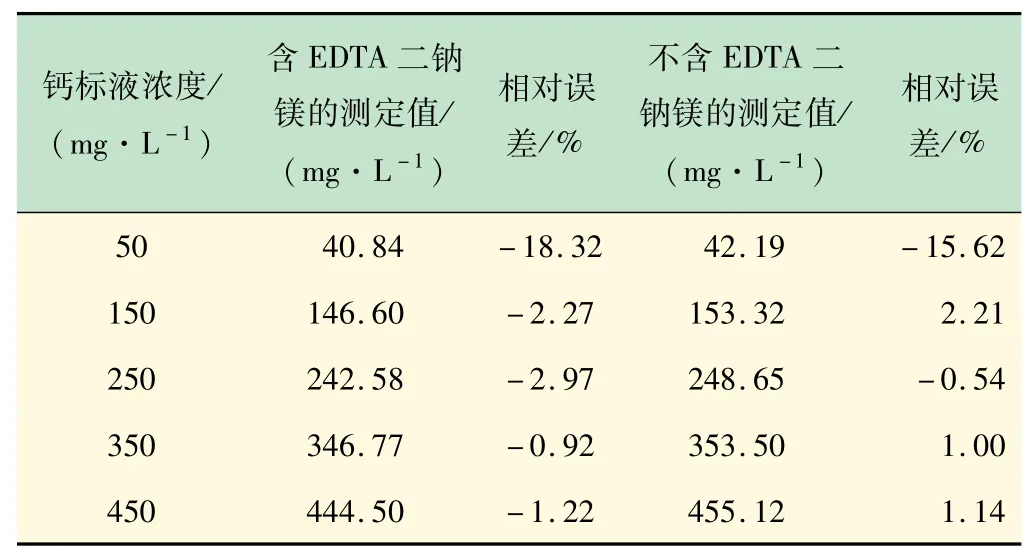
表1 钙标液浓度测试结果
化学计量点前

化学计量点时
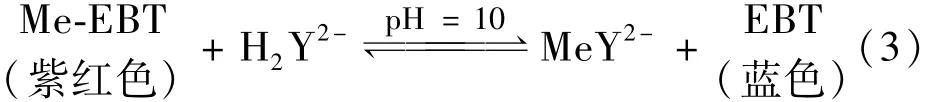
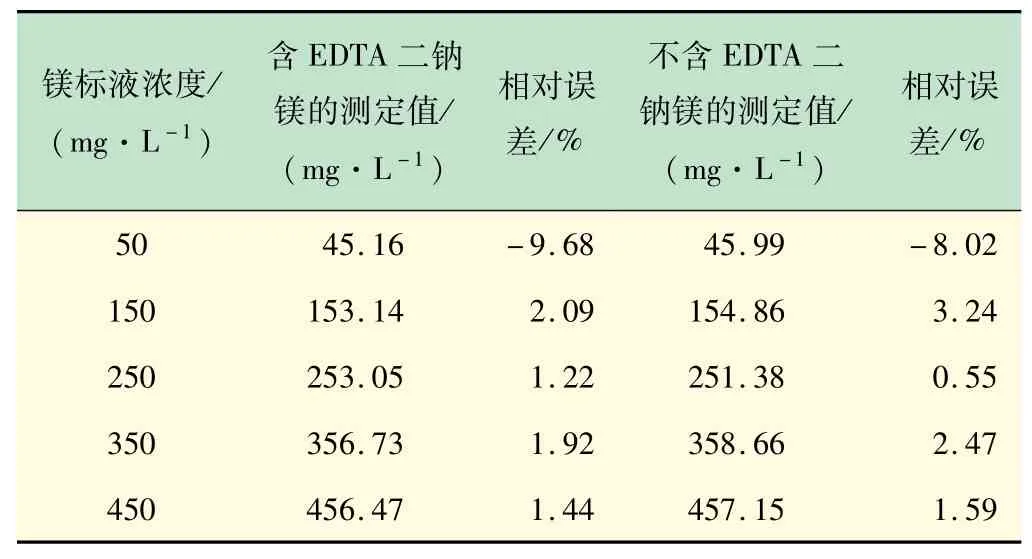
表2 镁标液浓度测试结果
滴定反应在化学计量点之前主要以式(2)进行,EDTA加入后,先与溶液中游离的钙镁离子反应,即将到达化学计量点时,反应由式(3)所示。该过程中,溶液红色逐渐变浅,然后变成紫色,到达等当点时,溶液变为天蓝色。
由表1、2计算结果可知,滴定结果的相对误差在钙镁离子浓度较低时较大。溶液中EDTA二钠镁对结果测定误差的影响较小,其主要作用在于增加终点变色的灵敏性。
在不添加EDTA二钠镁的钙标液滴定实验过程中,测定过程终点不敏锐,未到滴定终点即出现蓝色,天蓝色终点很难观察,很考验操作者对观察蓝色的能力。而加入EDTA二钠镁后,生成的铬黑T-镁的络合物使滴定终点变得明显。其主要原因在于,当水样中不含镁离子或者镁离子含量很少时,水中的钙离子在未到滴定终点时,EBT-Ca就已经大部分解离[10],呈现紫色和蓝色的复合色(深蓝色),只有当EDTA完全将钙离子络合,溶液才呈现天蓝色。
我国的地下水和地面水以及民用自来水的硬度主要以钙离子硬度为主,因此在滴定过程加入少量镁可有效提高终点颜色转变的敏锐性,减小读数误差。
2.2 不同水样的加标回收检验
在实际水样分析实验中,样品的真实值往往不能精确计算,一个分析方法的准确度通常可以通过测量标准物质或以标准物质做回收率等方法来进行评价。
用5 mmol/L的EDTA溶液对纯水、自来水和河水等不同水样进行加标回收实验,计算结果列于表3。
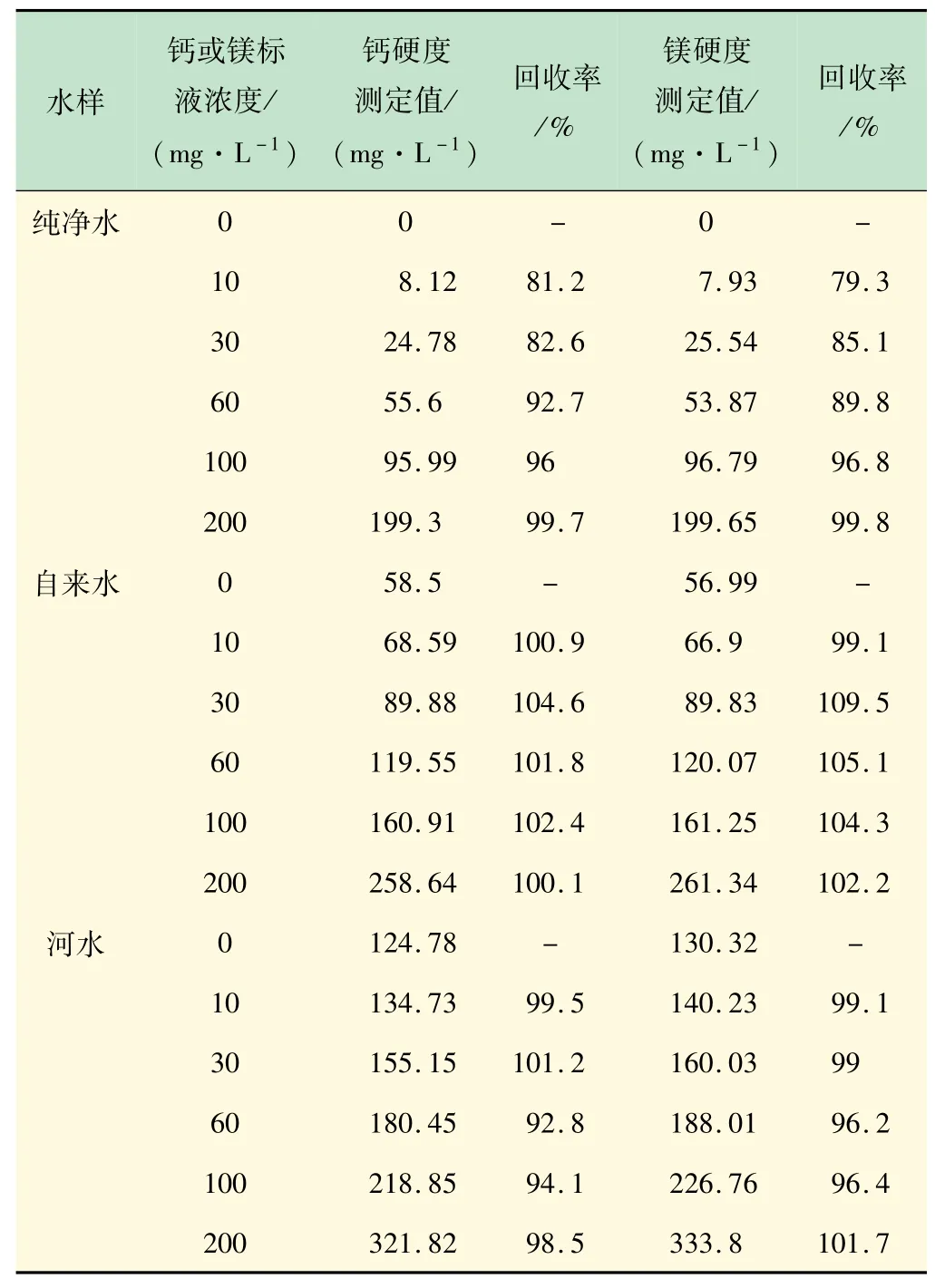
表3 不同水样的加标回收试验
以回收率在90%~110%范围为允许限,回收率小于90%说明该方法用于此浓度下的测定的结果有较大误差。由表3可知,自来水和河水的钙、镁离子加标实验回收率在90%~110%之间,其测定结果在允许的误差范围之内,而纯净水在低浓度下(小于60mg/L)的回收率偏低,高浓度下能够正常检测。
天然水样主要由钙硬度和镁硬度同时构成水的总硬度。以钙镁比为3∶1的标液配制纯净水加标溶液,测试在不同添加水平时,对3种方法(即采用3种不同浓度EDTA进行滴定)的平均回收率进行系统分析。纯净水中的两个不同硬度添加水平分别为25和55 mg/L。
由F检验可知,在置信度为90%下,每组实验的精密度并无显著性差异(见表4)。而由t检验可知,只有在较高添加水平下的2和5 mmol/L两个方法之间不存在显著性差异(t<t0.05,10),此时回收率良好,其他实验组之间均存在显著性差异(t>t0.05,10)。其中2 mmol/L的EDTA滴定低浓度的钙镁离子得到的结果要好于5、10 mmol/L的EDTA。说明在一定误差范围内,该测定方法可能存在可检测的钙镁硬度临界下限值。
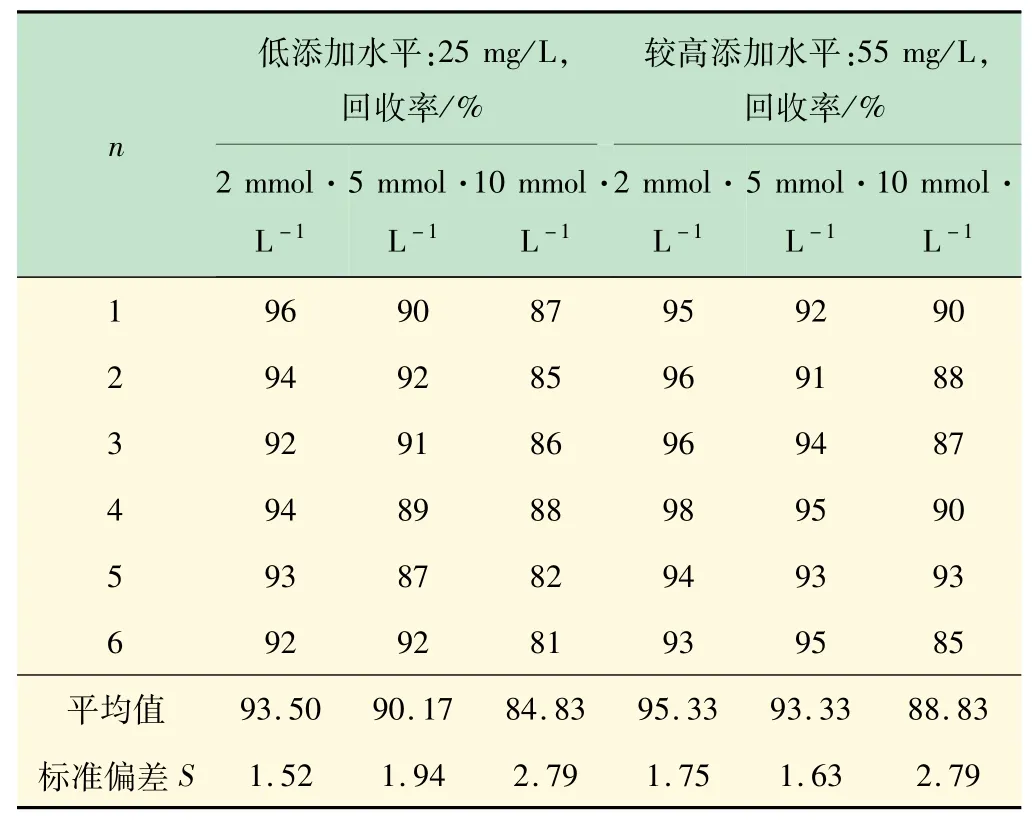
表4 不同浓度EDTA滴定结果对比
2.3 钙、镁离子回收率达标浓度临界下限值探索
由上述结果可知,EDTA标准溶液的浓度可能是导致可检测钙镁离子含量允许限的因素之一,以下探究了不同浓度EDTA标准液滴定下的钙镁离子回收率达标浓度临界下限值,结果如图1所示。
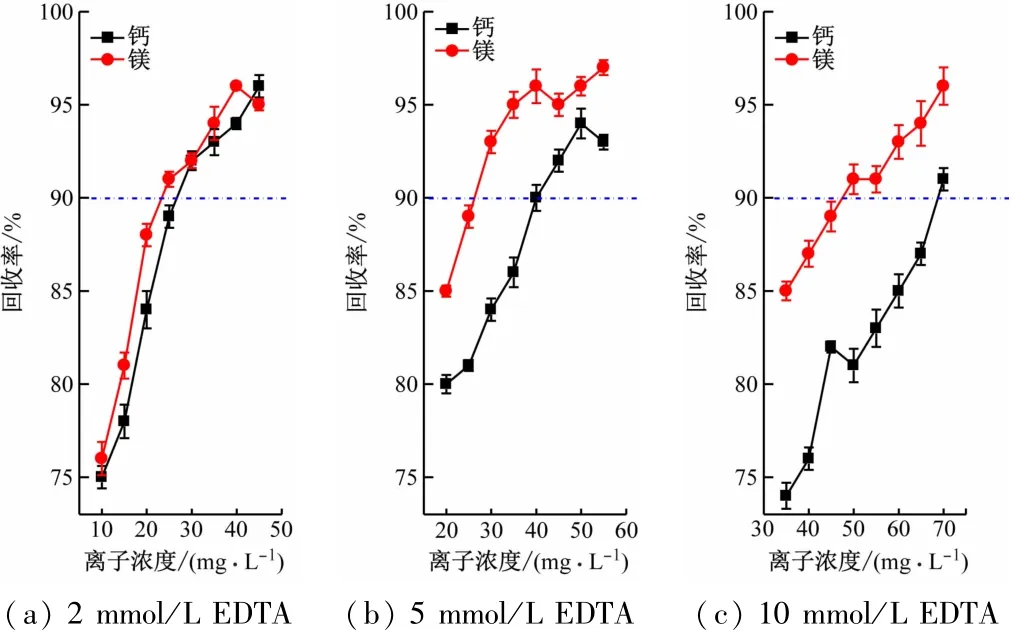
图1 不同浓度EDTA滴定钙镁离子回收率测试
以90%以上回收率为合格线,由图1可知,用不同浓度EDTA滴定钙、镁离子回收率达标浓度临界下限值不同,即在允许误差范围内可进行滴定的钙镁离子浓度不同。单独滴定的钙离子由于灵敏度不如镁离子,故镁离子的可测定临界下限值更低一点。高浓度(10 mmol/L)的EDTA在滴定50 mg/L浓度以下的钙镁离子时,回收率明显偏低,而此时若适当降低EDTA浓度,则可以保持较低的测定误差。2 mmol/L EDTA可滴定最低钙、镁离子硬度浓度为25 mg/L左右。
综上所述,在测低硬度水质,特别是小于50 mg/L的水质时,适当降低国标法中EDTA的浓度可提高EDTA滴定法测定水质硬度的准确性。想要在更低硬度(<20 mg/L)以下的水质有较高的精确度时,则需选择原子吸收分光光度法[11]或紫外分光光度法[12]等更精密的方法。
2.4 EDTA络合滴定法混标滴定准确度
实际水样测定中,溶液都是以钙镁离子混合形式存在,且不同水质的钙镁比例不同,低浓度下(<50 mg/L)的钙镁离子的混合标准溶液的滴定误差结果如表5所示。
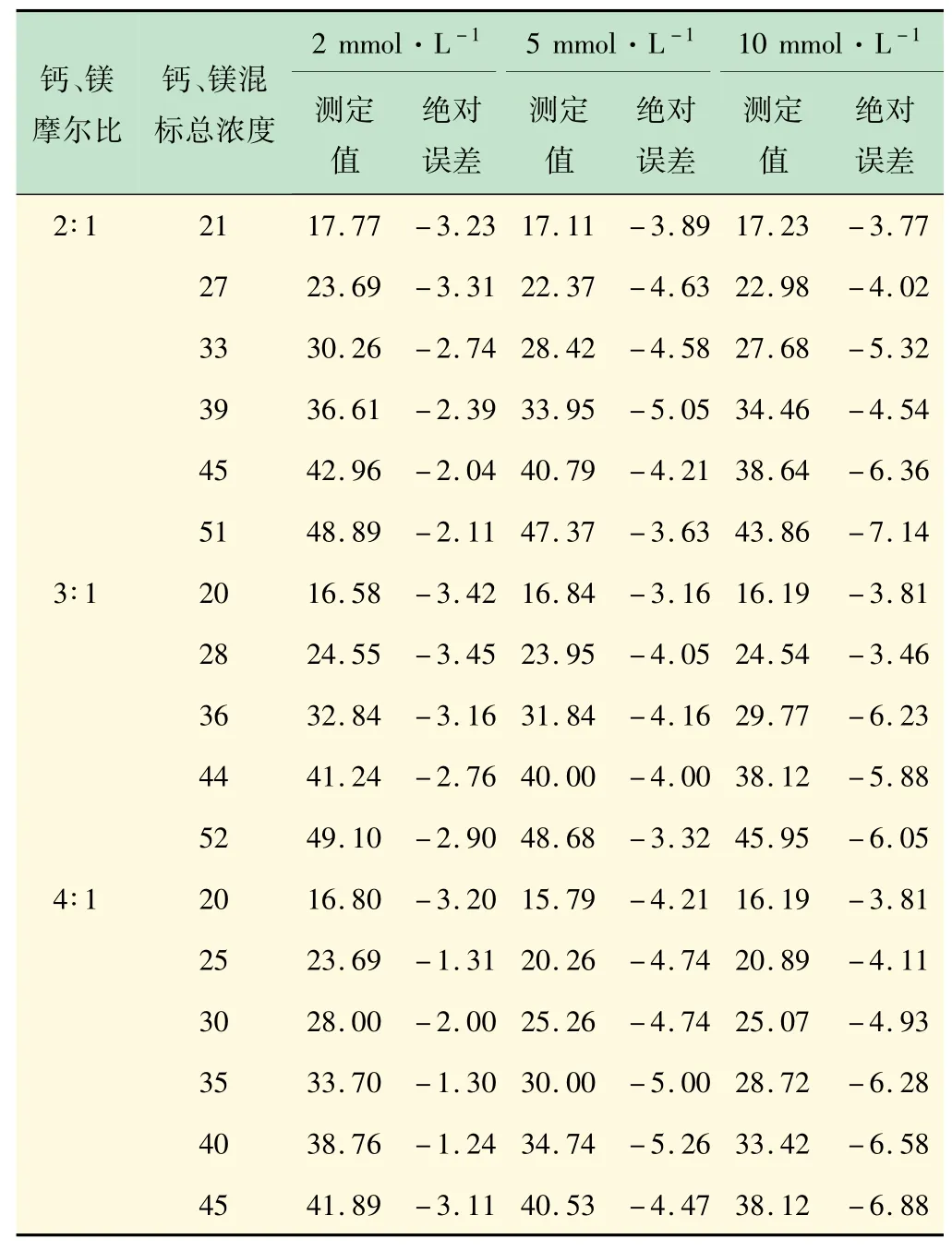
表5 不同浓度EDTA滴定混标溶液误差mg/L
不同浓度的EDTA溶液测定同一范围硬度的混标溶液时,所产生的误差不同。2、5、10 mmol/L的EDTA溶液滴定钙镁混合溶液的误差分别为1.0~3.5、3.0~5.5、3.5~7.5 mg/L之间,进一步说明在测定低硬度水样时,适当降低EDTA浓度可有效提高滴定准确度。由不同钙镁比溶液的测定结果看出,测定误差受钙镁比例的影响较小。
该EDTA滴定法不适用于海水等盐含量较高的水质,当溶液中钠离子含量过高,也会消耗小部分EDTA导致滴定结果偏大。且一般实际水样中往往含有少量Fe3+、Cu2+、Zn2+等干扰离子,它们与铬黑T络合呈现红色,其稳定常数通常极大,测定时极易导致滴定终点时颜色变化不够敏锐,造成指示剂封闭,不能进行正常滴定,此时可在滴定前先加入适量的三乙醇胺和硫化钠或者氰化物等掩蔽剂使干扰离子得到快速掩蔽。
2.5 铬黑T-紫外分光光度法测水总硬度
水中钙、镁可分别与铬黑T络合生成紫红色配合物,在紫外下具有最大吸收波长,定量钙、镁与指示剂作用具有一定的光吸收,因此可通过测定钙镁离子与指示剂络合后的吸光度制作工作曲线计算得到水的总硬度。然而MgEBT和CaEBT在最佳吸收波长下的摩尔吸光系数显然不同[13,14],不可直接用于测定水的总硬度。
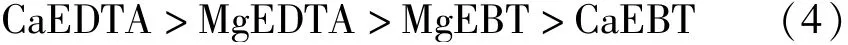
由于EDTA在溶液中与钙、镁离子络合后的稳定性存在如下关系:因此,在待测定的溶液中加入定量的镁时,可将与指示剂络合的钙离子全部替换成镁离子,从而从测定总硬度的多组分(钙、镁混合浓度)变成单组分(镁总浓度),提高光度法测定水总硬度的准确度,其反应式为[15]:

取11根10 mL的比色管,加入0.1 mL 0~5 mmol/L镁离子标液,0.8 mL含1 mmol/L EDTA和1 mmol/L镁离子的氨性缓冲液,0.6 mL EBT溶液,去离子水稀释至刻度,在波长520 nm下测定其吸光度,绘制标准曲线,如图2所示。
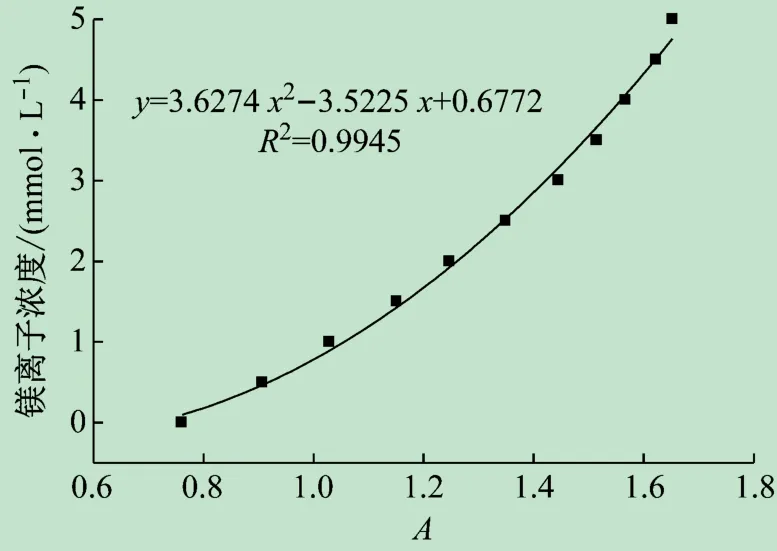
图2 镁离子标液的工作曲线
取两支10 mL比色管,与上述测定方法一致,取河水和自来水0.1 mL进行测试,并计算加标回收率,得到结果如表6所示。
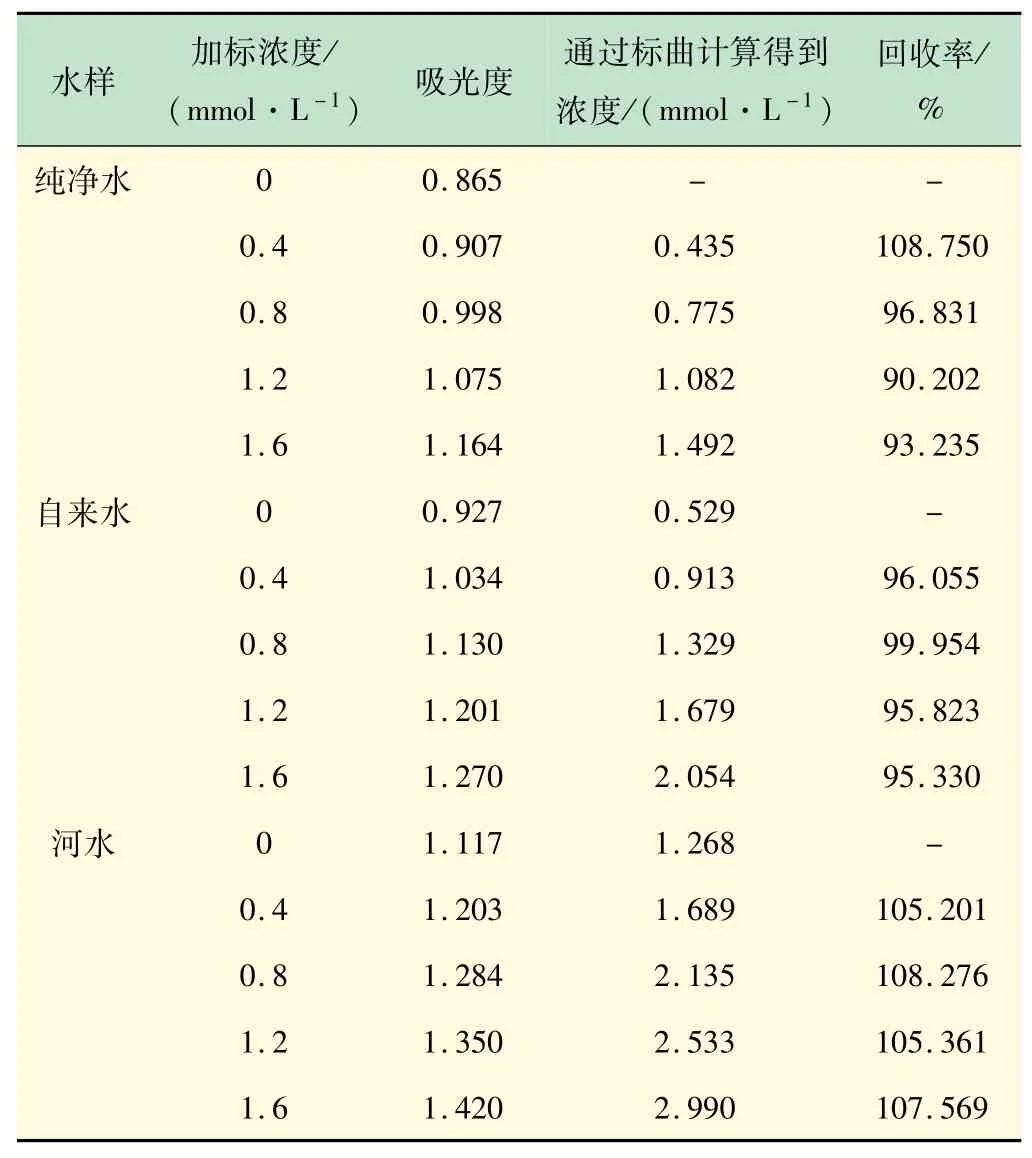
表6 实际水样测试及加标回收率计算
由表6可知,光度法测得自来水的硬度为52.9 mg/L,河水硬度为126.8 mg/L,回收率测试在90%~110%之间,结果良好。对比EDTA滴定分析法,用5 mmol/L的EDTA进行滴定测试,平行滴定3次,根据所消耗的EDTA溶液的体积计算得到实际自来水和河水的硬度分别为55.69和129.04 mg/L,紫外分光光度法测试结果与滴定法相差不大,在实验室中其操作更加简便快捷。
3 结 语
EDTA滴定法测水质钙镁总量方法中,钙镁离子测定总量的误差主要来源于方法误差以及滴定终点的主观误差。在测定实际水样时,缓冲溶液中添加适量的EDTA二钠镁可使终点颜色变化更敏锐,有效减小主观误差。通过加标回收、回收率检验、精密度和准确度计算等试验,低硬度水质中,只含有钙离子的溶液测定误差比只含有镁离子的测定误差大,适当减小EDTA的浓度可有效提高EDTA滴定法的准确性,有效减小方法误差。符合加标回收率常量要求在90%~110%之间可滴定的临界钙、镁硬度分别为70~75和45~50 mg/L(10 mmol/L EDTA),50~55和20~25 mg/L(5 mmol/L EDTA),20~25 mg/L(2 mmol/LEDTA),混标溶液中钙镁比对测定误差影响较小。置换分光光度法用于测定实际水样结果与滴定法结果一致,简便快捷,具有可适用性。
