分子诊断技术在新型冠状病毒核酸检测中的应用及发展*
2021-07-27陈馨宁黄斐张春燕潘柏申
陈馨宁,黄斐,张春燕,潘柏申
(1.复旦大学附属中山医院检验科,上海200032;2.复旦大学附属中山医院厦门医院检验科,福建厦门 361015)
截至2021年5月,新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引发的新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)已经累及185个国家,全球累计确诊人数超过1.6亿。SARS-CoV-2主要传播途径是经呼吸道飞沫和密切接触传播[1]。SARS-CoV-2在不同感染者间的临床表现存在较大个体差异,从无症状到常见的发热、干咳、乏力甚至严重急性呼吸综合征等[2]。其中,无症状感染者成为SARS-CoV-2传播和疫情反弹的焦点[3]。这突显了大规模提供准确、有效地诊断检测以识别感染者的重要性。
SARS-CoV-2实验室检测包括:(1)核酸检测,即诊断病原体感染的“金标准”,是确诊、治疗和防控COVID-19的主要手段;(2)血清学检测,即检测机体产生新冠病毒特异性抗体,但由于存在“窗口期”,不适合用于早期诊断;(3)病毒分离培养与鉴定,即病原学鉴定的传统金标准,受限于耗时和实验室安全等级要求,暂不作为日常诊断方法。本文将结合SARS-CoV-2核酸检测现状,着重概述不同分子诊断技术,并对上述技术在未来传染病暴发中的应用和发展提出建议。文中所涉及的新冠相关内容仅依据现行标准指南,实际操作时还应遵循最新版本。
1 核酸检测样本
1.1样本类型 根据《新型冠状病毒肺炎防控方案(第八版)》中附件10《新冠病毒样本采集和检测技术指南》,需由经过生物安全培训合格和具备相应实验技能的人员进行样本采集,无症状患者和普通人群筛查优先采集鼻咽拭子,次之为口咽拭子;急性期患者应采集呼吸道标本;重症患者优先采集下呼吸道标本(表1)[4-5]。另需注意多部位(类型)样本联合检测能有效防止由样本造成的假性结果。

表1 新型冠状病毒核酸检测样本[6-9]
1.2采样模式 考虑到检测压力和卫生经济资源压力,国务院应对新型冠状病毒肺炎疫情联防联控机制医疗救治组于2020年7月21日和8月17日相继制定了《新冠病毒核酸筛查稀释混样检测技术指引》和《新冠病毒核酸10合1混采检测技术规范》,以供特定人群(总体阳性率低于0.1%)针对混合样本进行核酸检测(低风险地区可按照10∶1、中风险地区可按照5∶1的检测模式)。值得注意的是,混合样本在临床检测中存在风险,如无法通过内参监控样本质量、混合样本复杂性和异质性。对于重点区域人群及医疗机构就诊患者检测,还是应当单采单检[10-12]。
2 核酸检测技术
SARS-CoV-2是一种正义单链RNA病毒(Genbank:MN908947),其基因组全长为29 903个核苷酸,转录29种蛋白质。其中,开放读码框1ab(open reading frame 1ab,ORF1ab)基因编码16个非结构蛋白质,结构基因组依次编码棘突蛋白(spike protein,S)、包膜蛋白(envelope protein,E)、膜蛋白(membrane protein,M)和核衣壳蛋白(nucleocapsid,N)(图1)[13]。根据《新型冠状病毒肺炎实验室检测技术指南(第五版)》,高度特异的ORF1ab基因和相对保守的N基因是SARS-CoV-2核酸检测的推荐靶点[14]。SARS-CoV-2具有基因组校对机制,可以防止病毒积累可能削弱自身的突变[15]。但随着时间推移和人际传播,自然选择仍然可以对罕见但有利于病毒的突变起到作用,获得具有适应度优势和免疫抗性的突变[16]。
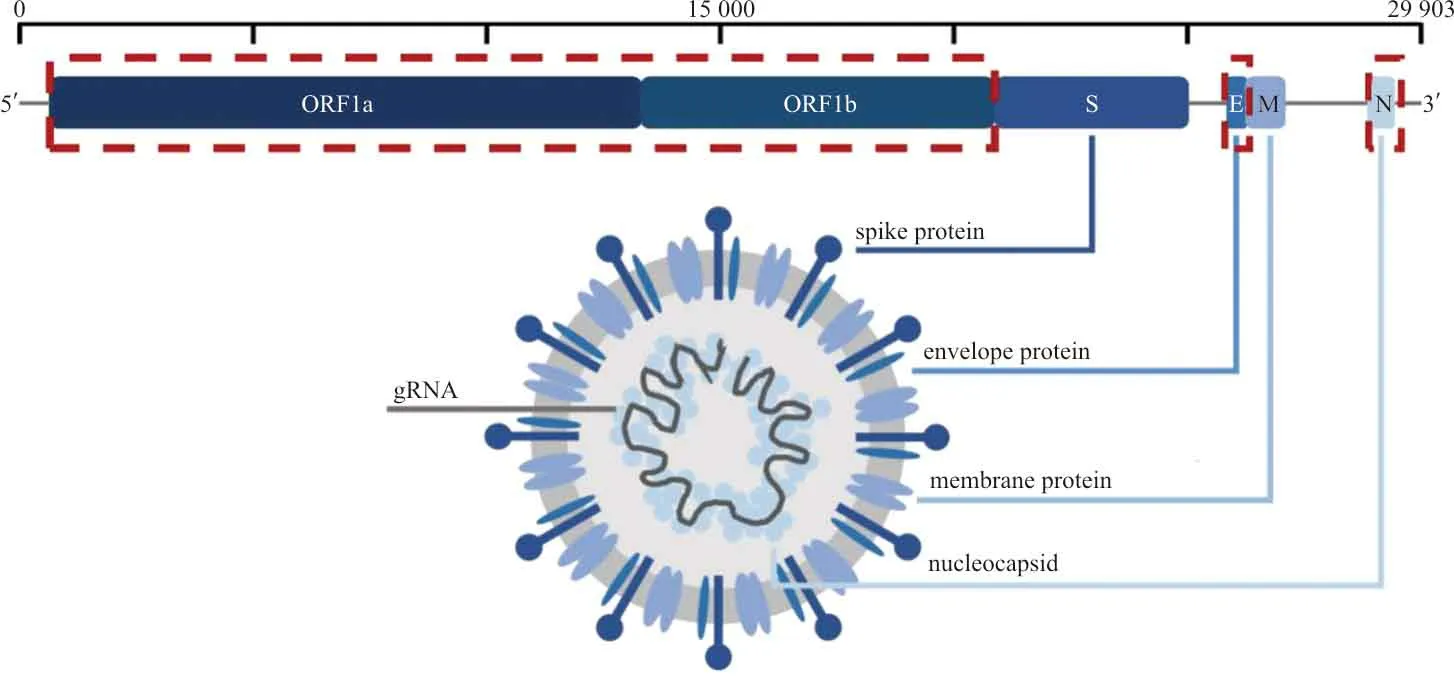
图1 SARS-CoV-2结构示意图
自疫情暴发以来,全球各地不同科学背景的研究人员和整个体外诊断(in vitro diagnostics,IVD)领域致力于技术攻关,将科研成果落地转化,以满足一线防控诊治对快速准确诊断检测的需求。国家药品监督管理局(National Medicine Products Administration,NMPA)批准及获得美国食品药品监督管理局(Food and Drug Administration,FDA)紧急使用权的核酸检测试剂中,可以发现目前SARS-CoV-2核酸检测所使用的分子诊断技术原理各不相同,提供了全场景化核酸检测方案。
2.1常态化防控
2.1.1常规检测 医院检验科、疾控中心和第三方检测机构承担了大范围筛查的工作,确保了“应检尽检、愿检尽检”的有序开展,适合本次大面积流行的新冠肺炎疫情。通过提供规模化和集约化的检测服务,满足常规检测的需求,为临床提供及时精准的信息,继而达到提高人民健康水平服务这一目标[17]。
截至2021年2月10日,经NMPA审批批准26个新冠病毒核酸检测试剂中(图2),不难发现逆转录聚合酶链式反应(reverse transcription-PCR,RT-PCR)技术凭借至少达10拷贝/反应的灵敏度和96个样本/批的检测通量成为目前临床上主流应用于SARS-CoV-2核酸检测的方法。RT-PCR检测SARS-CoV-2核酸过程中将RNA逆转录为cDNA,以cDNA为模板进行扩增,通过荧光染料或荧光标记的特异性的探针,对PCR产物进行跟踪并进行产物分析[18]。除了常见的以ORF1ab和N基因为靶点的RT-PCR检测外,同时也存在针对E基因的临床检测。单靶、双靶、三靶的检测及不同判读标准对实验人员的专业素质提出要求[19],需执PCR证上岗人员在PCR认证实验室开展。
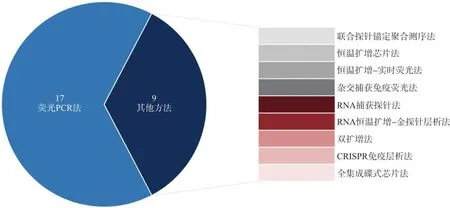
图2 NMPA获批试剂盒检测原理图
此外,对已知的多种病原体核酸同时进行意向性筛查也是一大临床需求,即在识别SARS-CoV-2的同时,排查其他引起相似症状的病毒。基因芯片通过微阵列技术,应用已知序列的核酸探针对未知序列的核酸序列进行大规模集成的固相杂交检测DNA[20]。双扩增法利用特异探针和标记有多生物素的放大探针杂交,实现病原体靶核酸的信号放大[21]。同时,已有一些企业基于核酸质谱技术开发了呼吸道病原体多重检测试剂盒,样品经过多重PCR扩增后,用特异性的质量探针进行延伸反应,利用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS)检测分子量的差异[22-23]。但核酸质谱对环境设备和人员资质具有一定要求,在检验科中难以普及,但在医学独立实验室中可以展露锋芒。
以上技术迎合了《新型冠状病毒肺炎诊疗方案(第八版)》中对全面鉴别诊断新型冠状病毒感染提出的要求,一次检出包括SARS-CoV-2在内的多种临床常见呼吸道病原体。有效区分健康人群、新冠病毒感染者与其他呼吸道感染患者,实现对就诊人群的快速检测和准确分类,从而大幅度降低疑似病例数量、降低医患风险、助力疫情防控。
2.1.2快速检测 快速检测是新冠肺炎常规化防控的前哨。床旁检验(point-of-care testing,POCT)中的分子诊断技术突破了专业实验室的限制,实现去中心化,将应用场景拓展到出入境、机场、火车站、基层医疗单位等。最大化分子诊断检测效益,解除了核酸检测对人员、仪器、场地的依赖性,改善了周转周期的问题,迎合了对快速报告的需求[24]。
其中,等温扩增(isothermal amplification technology,IAT)技术在恒定的温度下,通过添加不同酶和特异性引物进行快速核酸扩增。单一温度对仪器要求低。目前主要的恒温扩增技术有:滚环核酸扩增(rolling circle amplification,RCA)、环介导等温扩增(loop-mediated isothermal amplification,LAMP)、链替代扩增(strand displacement amplification,SDA)和依赖核酸序列扩增(nucleicacid sequence based amplification,NASBA)等(表2)[25-27]。目前已经有基于此技术的POCT类商品化试剂盒,但尚无大量临床验证及应用。而且由于该技术对引物设计复杂,可能存在假阴性和假阳性干扰[28]。

表2 基于等温扩增技术的病毒核酸检测对比
此外,基因编辑技术为基础的核酸检测也具有广阔发展前景。基因编辑技术是以规则成簇间隔短回文重复序列及其相关蛋白(clustered regularly interspaced short palindromic repeats/CRISPR associated,CRISPR/Cas)系统为代表,利用RNA引导Cas核酸酶,对基因及转录产物进行定点修饰编辑[29-30]。2020年5月,张锋团队提出的STOPCovid.v2(SHERLOCK testing in a one pot)技术是联合RNA提取、LAMP和CRISPR介导的集大成者,对SARS-CoV-2检出达到93.1%的灵敏度和98.5%的特异性,阳性样本只需 15~45 min就能获得结果且结果可视化[31-32]。
除以上主流POCT方法外,另有部分获FDA或NMPA批准的检测技术,虽然缺少文献报道但仍有一定应用前景。例如,杂交捕获免疫荧光分析法是将核酸杂交技术和免疫荧光捕获技术相结合的方法。通过试剂直接裂解病原体并释放靶核酸,利用荧光粒子对杂交体进行荧光信号识别,实现对样本中新冠病毒的特异性靶基因的定性判断[33]。RNA捕获探针法是用特异性靶标捕获法磁珠提取病毒RNA再结合转录介导的恒温扩增结合的实时检测技术[34-35]。两种方法同样兼具检测设备体积小和单个样本检测时长短的优势,且两种方法试剂商宣称的检测灵敏度、特异性都能够达到传统PCR方法的水平。
2.2病毒溯源及变异监测 病毒溯源和变异监测是疫情防控的“必答题”。第一时间获取全部病毒基因信息,可以解释病毒的来源、传播、变异演化等科学问题、指明后续流行病学调查方向、助力病毒变异监测。
得益于高通量测序(next generation sequencing,NGS)技术在疫情初期,仅5 d的时间内获得了SARS-CoV-2基因组序列,为进行溯源工作和全世界抗击病毒奠定了基础[36]。NGS主要是对临床样本中提取的核酸进行大规模平行测序,再经过数据库比对与生物信息学分析,完成包括病毒在内的多种病原体检测[37]。基于NGS的核酸检测包括宏基因组测序、探针捕获测序和扩增子测序(表3)[38]。检测周期长、操作流程复杂、对生物信息学专业背景要求等限制使NGS难以成为临床一线开展核酸检测方法。

表3 基于NGS技术的病毒核酸检测对比
目前,全球各地已检测出各种变异SARS-CoV-2,依赖于NGS技术,各方也在开展相关病毒株变异监测工作[39],及时评估防疫措施,确保各环节预防效果。通常,病毒以每月大约1~2个碱基突变的速度积累突变。这意味着今天测序的许多基因组与2020年1月最早测序的基因组相差约20个位点。针对SARS-CoV-2突变株的研究认为[40],突变株在S蛋白(尤其RBD区域)上发生的突变不会影响以ORFlab、N、E基因为靶点的核酸检测试剂的检测能力。但新发突变株B.1.1.7中发现的69/70缺失突变已被证实会影响针对S基因的聚合酶链反应检测的性能[41-42]。
2.3参考品制作 各实验室、地区、国家之间的SARS-CoV-2核酸测量结果都需要通过一致性计划并进行准确性工作。数字PCR(digital PCR,dPCR)技术将反应混合物分割成上千至上万个不等的液滴,读取每一独立反应单元的扩增情况,利用泊松分布,实现模板DNA的绝对定量。检测原理加之其独立于校准曲线的特性使其具备高检测灵敏度(2.5个拷贝/反应)及抗干扰能力,使其可以被利用于SARS-CoV-2核酸检测参考品制备。此外,多项独立研究表明,SARS-CoV-2核酸检测性能大大优于RT-PCR[43-44]。带来检测性能提升的同时,也增加了操作和成本的负担。因此,dPCR技术应用更偏向于动态监测病毒载量和环境监测(如公共场所、病房、卫生间、实验室手套、废水等)等[45]。
以上提到的所有核酸检测技术,都可作为标准RT-PCR方法的补充,互为验证。尤其对于“灰区”患者复检、疑似患者排查和感染初期病毒载量低的患者,应更为谨慎。除了多技术检测的核酸结果外,IgM/IgG抗体结果、影像学、流行病学史和临床表现等都有所帮助,应根据实际情况选择使用。
3 小结及展望
尽管COVID-19疫情尚未战胜,但本次疫情中分子诊断技术的角色和效用可以作为未来传染病暴发中的范例。检测能力的提升对于控制疫情必不可少,质量控制和技术创新密不可分。
核酸检测的可靠性和有效性是第一优先级。实验室应不断加强自身能力建设、对不同厂家试剂进行严格性能验证与比对、做好日常室内质控,并常态化接受国家级或省级检验质量控制以助力患者的临床管理。各省级卫生健康行政部门要加强对核酸检测实验室的日常质量控制工作,组织实验室参加室间质评并对实验质评结果进行及时地回顾、反馈及干预。进一步提高核酸检测质量,从而降低临床假阴性风险、有效控制病毒传播[46-47]。实验室人员和试剂研发人员应时刻关注突变株对病原体核酸检测的影响。通过对照公开的病毒基因组序列数据库定期评估和修正引物集及检测体系,以保证检测有效性。科学家们应对研发更快、更便捷、更准确、更安全的核酸检测迭代技术和搭建POCT平台保持热度,适应疫情偶发和常态化的现实状况,满足防控要求。
COVID-19疫情引发了对分子诊断技术的开发和投资。在此次宝贵经验的基础上,临床医生、科学家和公共卫生管理人员之间的多学科合作无疑可以实现向其他病原体疾病的拓展。
利益冲突:作者声明无任何利益冲突
