DOT结合PET-CT诊断乳腺癌的价值观察
2021-07-27枣庄矿业集团中心医院超声科山东枣庄277000
枣庄矿业集团中心医院超声科(山东 枣庄 277000)
杨 舒* 林晓丹
乳腺癌系全球妇女发病率最高的恶性肿瘤,且患病人数持续增加,发病年龄呈低龄化,严重威胁女性健康和生活质量,其早期诊断、及时治疗对患者预后至关重要[1-2]。常规的超声多普勒影像学检查是通过解剖结构、形态分析判断病变情况,是临床鉴别诊断乳腺癌的重要方式之一,但其诊断准确率并未达到临床要求[3]。PETCT将PET与CT融为一体,通过PET对检查者病灶功能及代谢进行详细检查,通过CT为患者提供病灶的精确解剖定位,可以在一次显像下了解身体各个方位的图像,定位准确,分辨率高,实现早期发现疾病的目的[4]。超声光散射成像(diffused optical tomography,DOT)是将光子漫散射成像技术和超声成像技术有机结合的一种新的乳腺功能成像技术,可通过超声成像技术获得乳腺病变形态和位置等结构信息,利用DOT技术对病变组织血红蛋白含量光学信息进行激光漫散射功能多维成像,从而为乳腺肿瘤的良恶性鉴别、定性提供诊断信息[5]。本研究比较了DOT与PET-CT诊断乳腺癌的临床价值,并评估其联合应用的可行性,以期为临床早期诊断和鉴别乳腺良、恶性肿瘤提供参考。
1 资料与方法
1.1 一般资料选择2017年5月至2019年5月在枣矿集团中心医院行乳腺病变切除活检的女性患者42例,共45个乳腺病灶,均经病理检查证实,患者术前接受DOT和PET-CT检查,未行放疗或化疗,年龄28~65岁,平均年龄(44.58±8.32)岁。本研究获得医院伦理委员会审批,患者自愿签署知情同意书。
1.2 DOT检查仪器为OPTIMUS Ⅱ型超声光散射乳腺成像系统(新奥博为技术有限公司)和Terason T3000超声诊断装置(探头频率7~12MHz)。患者取平卧位,双臂上举,扫查乳腺,然后选取病变部位最大切面为水平切面进行光学扫描,再旋转探头90°进行为垂直切面进行光学扫描。存储图像后,在对侧乳腺和患侧病变镜面对称部位进行光学扫描。再对获取的两个病灶切面勾勒感兴趣区(ROI)进行光学重建,得到光学特征参数、光吸收图像和乳腺病灶的总血红蛋白浓度(THC)。
1.3 PET-CT检查仪器为Biograph 64 TruePoint TrueV型PET-CT仪(德国西门子公司)。检查前6h禁食,且空腹血糖<6.4mmoL/L,按5.55MBq(0.15mCi)/kg剂量静脉注射18F-FDG,闭目休息60min后,嘱患者排尿,然后使用PETCT仪扫描,扫描范围由头顶至会阴,120kV,220mA,层厚104mm,螺距1.2,扫描过程中嘱患者保持平静呼吸。将图像上传至西门子公司MMWP工作站,由3位高年资医师共同阅片,观察18F-FDG异常摄取部位和形态学变化,勾画ROI,并测量病灶最大标准摄取值(SUVmax)。
1.4 统计学分析应用SPSS 19.0软件处理数据,以THC与SUVmax表示,行t检验;以病理诊断为“金标准”,绘制受试者工作特征曲线(ROC),计算曲线下面积(AUC)值分析DOT与PET-CT及其联合诊断乳腺癌的临床价值;以Pearson相关及散点图分析THC与SUVmax之间的关系。P<0.05为差异有统计学意义。
2 结果
2.1 病理类型42例患者45个病灶中,良性病灶20个(44.44%),其中包括纤维腺瘤9个(20.00%)、腺病6个(13.33%)、导管内乳头状瘤3 个(6.67%)、乳腺炎2 个(4.44%),病灶直径1.2~6.8cm,平均病灶直径(2.42±1.56)cm;恶性病灶25个(55.56%),其中包括浸润性导管癌22个(48.89%),浸润性小叶癌2个(4.44%),导管内癌1个(2.22%),病灶直径0.8~5.5cm,平均病灶直径(2.78±1.22)cm。
2.2 DOT与PET-CT及其联合诊断乳腺癌的临床价值良性组THC与SUVmax均显著低于恶性组,差异有统计学意义(P<0.05);以术后病理结果为“金标准”,绘制ROC曲线得出:THC>170.88μmoL/L可作为诊断恶性的截断值,诊断乳腺癌的敏感度、特异度为65.7%、85.0%,AUC值为0.776;SUVmax>3.28可作为诊断恶性的截断值,诊断乳腺癌的敏感度、特异度为82.9%、75.0%,AUC值为0.835。THC与SUVmax的诊断效能比较差异无统计学意义(P>0.05),但二者联合诊断的AUC值最大(0.873),敏感度、特异度分别为85.7%、75.0%。见表1、表2 及图1。
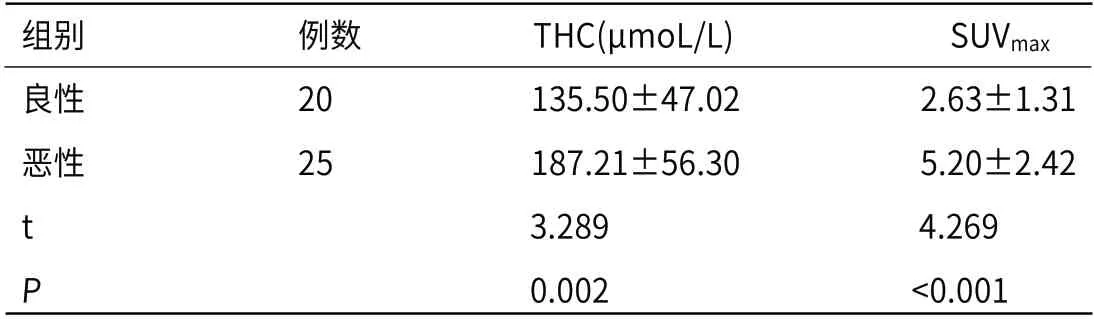
表1 良恶性病灶THC与SUVmax 比较

表2 THC与SUVmax 及其联合诊断乳腺癌的临床价值

图1 THC与SUVmax及其联合诊断乳腺癌的ROC曲线分析
2.3 THC与SUVmax的相关性分析 Pearson相关分析显示,THC与SUVmax显著正相关(r=0.609,P<0.05),见图2。

图2 THC与SUVmax之间关系的散点图分析
3 讨论
乳腺恶性肿块内部血管呈网格样分布,由于癌细胞代谢旺盛,其生长和转移都需要依靠新生的毛细血管,耗氧量大,从而使得恶性肿快血含量高,氧含量低,血红蛋白含量因此增多[6]。但常规的超声多普勒影像学检查仅可显示肿块内部及周边血管,无造影剂增强的超声多普勒无法显示低流量和低速血流,仅可用于显示直径≥200μm的滋养血管,无法显示肿瘤新生血管网全貌,易漏诊及误诊血供较少的乳腺癌[7-8]。
DOT是一种融合了超声波和光子成像技术优势的新技术,引入超声为光学系统提供位置引导,通过散射光断层造影技术对不同组织的光谱特性成像,反映肿瘤组织内血红蛋白的含量和分布,获取肿瘤的生理信息,可无创、重复地对乳腺肿瘤进行定性诊断分析[9-10]。本研究发现良性组THC显著低于恶性组,以THC>170.88μmoL/L作为诊断恶性的截断值,诊断乳腺癌的敏感度、特异度分别为65.7%、85.0%,AUC值为0.776。其中有8例浸润性导管癌及浸润性小叶癌漏诊,其原因可能与病灶本身低血流灌注及肿瘤异质性有关。4例纤维腺瘤、乳腺炎及导管内乳头状瘤误诊为恶性,其原因可能是因为少部分纤维腺瘤血红蛋白含量高与血管增多和高血流灌注有关;炎性病灶也可表现为乏氧,诱导促新生血管生长因子增多,促进血管生成,出现高血红蛋白含量表现;Wang等[11]研究发现某些导管内乳头状瘤本身毛细血管丰富,也可在超声造影上出现高增强表现,血管明显增多。
乳腺癌病理生理改变较正常乳腺组织表现为血流灌注和血管通透性增强,新生血管生成和细胞增殖力增强,这些变化是乳腺癌的PET功能成像的重要关键[12]。PET/CT是一种融合了PET人体功能成像和CT解剖结构成像的新技术,可利用肿瘤恶性程度与18F-FDG的摄取度的关系,通过静脉注射18F-FDG增强显像效果,结合肿瘤复杂的分子代谢变化与解剖结构的准确定位,为乳腺癌的准确诊断和术前分期提供更精确的影像学信息[12-13]。本研究发现良性组SUVmax显著低于恶性组,以SUVmax>3.28作为诊断恶性的截断值,诊断乳腺癌的敏感度、特异度分别为82.9%、75.0%,AUC值为0.835。其中有4例浸润性导管癌、浸润性小叶癌漏诊,病灶直径为0.8~2.5cm。陈英茂等[14]研究发现,肿瘤病理类型、病灶大小、系统灵敏性、空间分辨率及部分容积效应为影响PET敏感性的重要因素,其局限性主要表现在对较小病灶敏感性较低,对于较小病灶FDG现象可能出现假阴性。本研究中有5例导管内乳头状瘤、肉芽肿性乳腺炎及硬化性腺瘤误诊为恶性,其原因可能在于一些非乏氧良性肿瘤也可出现高葡萄糖代谢表现。
乳腺癌的生长代谢是葡萄糖代谢、乏氧、血管生成等多因素参与的过程,多模式诊断可提高肿瘤检出率,促进分子影像技术的发展[15]。本研究结合DOT检查测得的THC与PET/CT测得的SUVmax联合诊断效果有了显著提高,AUC值最大(0.873),敏感度、特异度分别为85.7%、75.0%。理论上,乳腺癌细胞代谢旺盛,恶性病灶耗氧量大,葡萄糖代谢增加,可刺激病灶内部生成更多新生毛细血管转运葡糖糖和氧,增高血红蛋白含量,促进肿瘤生长和增殖。本研究进一步行Pearson相关分析显示,THC与SUVmax显著正相关(r=0.609,P<0.05)。
综上所述,DOT结合PET-CT可提高乳腺癌诊断效能,减少不必要的活检,更好地指导临床治疗方案的选择及提高患者预后。