山羊副流感病毒3型和巴氏杆菌混合感染的诊断与病原分离鉴定
2021-07-26恽佳蕾毛立杨蕾蕾何苗峰李文良张纹纹孙敏刘茂军
恽佳蕾 毛立 杨蕾蕾 何苗峰 李文良 张纹纹 孙敏 刘茂军


摘要:随着规模化养羊业的发展,肉羊呼吸道疾病流行普遍、发病严重、防治困难,给养殖业及养殖户造成较大的经济损失。为明确安徽某肉羊养殖场呼吸道疾病的病因,结合流行病学、临床症状、剖检病变观察、细菌学及病毒学检测与分离鉴定以及血清学检测对病因进行分析,结果表明该病是由山羊副流感病毒3型与巴氏杆菌混合感染所致。分离菌株对丁胺卡那霉素、氟苯尼考、阿奇霉素、恩诺沙星和头孢曲松敏感,对青霉素、克林霉素和强力霉素不敏感。通过MDBK细胞成功分离获得山羊副流感病毒3型毒株,其M基因片段与已有毒株同源性达99%。血清学检测也进一步证实病毒的感染。这为临床上科学防控山羊呼吸道疾病提供了指导和借鉴。
关键词:山羊副流感病毒3型;巴氏杆菌;呼吸道疾病;混合感染;分离鉴定
中图分类号:S858.27 文献标志码: A
文章编号:1002-1302(2021)11-0124-03
收稿日期:2020-12-06
基金项目:江苏省农业科技自主创新资金[编号:CX(19)3020];国家重点研发计划(编号:2016YFD0500900)。
作者简介:恽佳蕾(1996—),女,江苏无锡人,硕士研究生,从事食源性/人兽共患传染病防控技术研究。E-mail:834462138@qq.com。
通信作者:李文良,博士,研究员,主要动物重要病原感染致病机制与防控技术研究。E-mail:kfliwenliang@163.com。
近年来,随着规模化养羊业的发展,肉羊呼吸道疾病流行普遍、发病严重、防治困难,给养殖业及养殖户造成较大的经济损失[1-3]。研究表明,与牛呼吸道疾病综合征(BRDC)是由多种病毒、细菌感染导致的[4]类似,临床上肉羊呼吸道疾病的发生可由多种病毒[如山羊副流感病毒3型(CPIV3)、小反刍兽疫病毒(PPRV)、呼吸道合胞病毒(RSV)]和细菌性病原(巴氏杆菌、曼氏杆菌、绵羊肺炎支原体、肠外致病性大肠杆菌、链球菌等)单独或混合感染引起,尤其在机体健康状态低下、环境改变、长途运输等应激条件下引起严重的临床症状[1,3,5-6]。
2020年9月,安徽一山羊养殖场外购育肥山羊(182头)于到场后10 d陆续发生严重的呼吸道疾病,治疗效果较差。发病羊主要表现为发热、咳嗽、流涕、精神萎靡,严重者呼吸困难并出现死亡。剖检2只病死羊均可见肺脏严重实变、化脓并与胸腔、心包膜黏连,胸腔积液,气管出血并充满泡沫与黏液。发病率约35%,死亡率8.2%。为查明病因,本研究结合流行病学、临床症状、剖检病变观察、病原学、血清学检测以及病原分离鉴定等方法对病因进行分析,明确致病病原,为该病的防治提供指导和依据。
1 材料与方法
1.1 材料与试剂
RNA/DNA提取试剂盒、胶回收试剂盒,购自Axygen公司;一步法RT-PCR试剂盒、胎牛血清、DNA分子量标准DL2000 plus,购自北京全式金生物科技有限公司;PCR Mix,购自南京诺唯赞生物科技有限公司;血平皿、药敏纸片,购自杭州微生物试剂有限公司;革兰氏染色液,购自北京索莱宝生物科技有限公司;DMEM培养基,购自Hyclone公司;其他试剂均为国产分析纯。
1.2 细菌分离鉴定
1.2.1 染色与镜检 取肺、肝组织病料,涂布于绵羊血平板,37 ℃恒温过夜培养,24 h后取出。挑取典型菌落涂片并进行革兰氏染色、镜检。
1.2.2 细菌16S rRNA序列测定 挑取纯化的菌落,采用16S rRNA通用引物进行菌落PCR扩增,预期扩增片段为1 500 bp。引物序列如下:F:5′-AGAGTTTGATCCTGGCTCAG-3′;R:5′-GGWTACCTTGTTACGACTT-3′。反应体系为20 μL,2×PCR buffer 10 μL,引物各为1 μL,提取的核酸4 μL,ddH2O 4 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min,4 ℃保存。扩增后PCR样品于10 g/L琼脂糖凝胶中电泳观察结果。用胶回收试剂盒将PCR扩增产物纯化后,送南京擎科生物科技有限公司进行测序并对结果进行BLAST分析。
1.2.3 藥敏试验 挑取纯化培养的菌落,涂布血平板,用纸片法进行药敏试验。37 ℃培养一昼夜,观察结果,根据美国临床与实验室标准化协会(CLSI)M100-S21标准判定敏感性[7]。
1.3 病毒与支原体检测
分别取200 μL鼻拭子(2份)、肺脏组织匀浆上清(2份)样品,按照RNA/DNA提取试剂盒说明书提取样品中的核酸。分别使用CPIV3、RSV、PPRV、绵羊肺炎支原体的引物分别进行RT-PCR或PCR检测(引物序列如表1所示),一步法RT-PCR和PCR反应均参照试剂说明书进行。取扩增产物进行10 g/L琼脂糖凝胶电泳,观察结果。
1.4 病毒分离与序列分析
选取CPIV3检测阳性的鼻拭子样品,参照文献[6]方法采用MDBK细胞进行病毒分离、传代,观察细胞病变(CPE)情况,检测病毒血凝价。采用RT-PCR检测CPIV3,将扩增产物送南京擎科生物科技有限公司进行测序并进行BLAST分析。
1.5 血清学检测
按照报道的阻断ELISA方法[11]对发病期(15份,其中2份为剖检羊)和1个月后(31份)采集的血清样品进行CPIV3抗体检测。
2 结果与分析
2.1 细菌分离鉴定
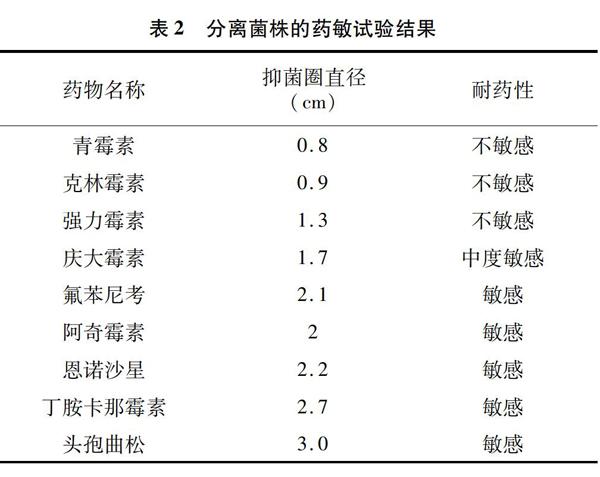
从肺脏、肝脏样品中均分离到单一的透明、湿润、光滑、不溶血的小菌落。染色后镜检可见大量革兰氏阴性杆菌并呈两极着染。菌落PCR后电泳结果显示,得到的扩增的核苷酸片段与预期结果大小相符。测序表明,该菌株16S rRNA基因部分序列与巴氏杆菌同源性最高。药敏试验结果显示,此菌对丁胺卡那、氟苯尼考、阿奇霉素、恩诺沙星和头孢曲松敏感(表2)。
2.2 病毒检测与分离鉴定
结果显示,2份鼻拭子和1份肺脏样品检测到CPIV3为阳性,而RSV、PPRV和绵羊肺炎支原体均未检出(图略)。
选择阳性的鼻拭子样品经离心、过滤除菌后接种MDBK细胞进行病毒分离,接种后4 d可见细胞出现CPE,传代至第二代时3 d即可出现明显的CPE,5 d时细胞出现融合、死亡、脱落(图1),与已有报道[6]一致。通过血凝试验检测第3代病毒血凝价为128。对第3代病毒进行RT-PCR检测,结果为阳性(图略)。将扩增产物纯化后进行测序,并进行BLAST分析,与已报道CPIV3毒株同源性为99%。
2.3 CPIV3抗体检测
采用阻断ELISA方法检测采集的血清样品,结果见图2。发病早期采集的15份血清样品抗体阳性率为53.33%,但阻断率不高,有6份样品在临界值(35%)左右,2份剖检病死羊的血样均为阴性。发病1个月后血清抗体阳性率为96.77%,绝大多数阻断率达到70%以上,仅有1份为阴性。
3 讨论
根据流行病学、临床症状、病理观察和实验室检测,综合判定发病羊场为CPIV3和巴氏杆菌的混合感染。建议对发病羊隔离饲养,使用专用的器具与饲料等;对死亡羊尸体及圈舍、粪便等污染物进行无害化处理;对整个羊舍,尤其对发病羊舍及其污染的环境、器具等进行全面消毒,1~2 d/次;对发病羊使用氟苯尼考、氟尼辛葡甲胺和维生素C注射治疗,疗程3~7 d,同时采用氟苯尼考进行全群预防用药2次,1周后病情逐步好转,死亡率显著降低,1个月后回访已基本恢复正常。
近年来,随着国内养羊规模化的发展,集约化增加、流通运输频繁,但相应的防疫措施不到位,相关疾病频发,逐渐引起大家关注,其中呼吸道疾病造成的危害最为突出。临床上肉羊呼吸道疾病的发生可由多种病毒和细菌性病原引起,疾病的严重程度与感染病原的致病性、混合感染的程度以及应激、饲养管理等有关。小反刍兽疫致病性强,自2014年流行以来已通过疫苗免疫得到有效控制,但仍有散发的病例[12-13]。养殖户需提高防范意识,做好疫苗免疫,定期监测抗体水平,保证免疫效果。CPIV3是新近报道的羊源副流感病毒,其流行分布较广,尚无疫苗和特效药物,应给予重视并采取预防为主的措施[6,14]。此外,根据笔者所在实验室调查发现,绵羊肺炎支原体流行普遍[15],危害较大且缺乏针对性的疫苗,巴氏杆菌、曼氏杆菌、肠外致病性大肠杆菌等常与之混合感染。针对这些细菌性病原,应重视病原的检测、鉴定,筛选敏感药物进行治疗。本病例中检测到CPIV3与巴氏杆菌混合感染,未检测到PPRV和绵羊肺炎支原体,该株巴氏杆菌耐药性不强,但养殖户最初使用的是不敏感药物,根据检测结果调整药物并配合对症支持治疗药物后即收到良好的效果,发病率和死亡率明显下降并最终恢复正常。
总之,面对规模化养殖模式下肉羊呼吸道疾病多发难防的问题,养殖户和研究人员均应给予足够的重视,贯彻预防为主的综合防控措施,发病后应结合流行病学和病原学检测科学分析病因并采取针对性的防治方案,最大限度降低造成的损失。
参考文献:
[1]Chakraborty S,Kumar A,Tiwari R,et al. Advances in diagnosis of respiratory diseases of small ruminants[J]. Veterinary Medicine International,2014,2014:508304.
[2]孙宏业. 目前羊流行性呼吸道病病因分析[J]. 农民致富之友,2018(12):199.
[3]胡玉婷,刀筱芳,王成龙,等. 羊呼吸道主要支原体和细菌病原的多重PCR检测方法的建立及应用[J]. 中国预防兽医学报,2018,40(5):416-420,430.
[4]王洪梅,赵贵民,侯佩莉,等. 牛呼吸道疾病综合征流行现状及防控技术研究进展[J]. 中国畜牧杂志,2015,51(16):33-39.
[5]何融泽,甘霖莉,杜玉兰,等. 简述几种山羊的呼吸道疾病[J]. 广西畜牧兽医,2018,34(6):305-306.
[6]Li W,Mao L,Cheng S,et al. A novel parainfluenza virus type 3 (PIV3) identified from goat herds with respiratory diseases in eastern China[J]. Veterinary Microbiology,2014,174(1/2):100-106.
[7]钟舒红,吴翠兰,李军,等. 一起牛呼吸道疾病综合征的病原分析与药敏试验[J]. 江苏农业科学,2020,48(19):168-171.
[8]Eleraky N Z,Kania S,Potgieter L N. The ovine respiratory syncytial virus F gene sequence and its diagnostic application[J]. Journal of Veterinary Diagnostic Investigation,2001,13(6):455-461.
[9]毛 立,窦永喜,翟军军,等. 小反刍兽疫病毒RT-PCR检测方法的建立[J]. 中国兽医科学,2010,40(6):593-597.
[10]Mcauliffe L,Hatchell F M,Ayling R D,et al. Detection of mycoplasma ovipneumoniae in pasteurella-vaccinated sheep flocks with respiratory disease in England[J]. The Veterinary Record,2003,153(22):687-688.
[11]Mao L,Li W,Zhou T,et al. Development of a blocking ELISA for Caprine parainfluenza virus type 3[J]. Journal of Virological Methods,2017,250:59-65.
[12]兰德松,刘 贺,王海丰,等. 辽宁省一起小反刍兽疫疫情的紧急流行病学调查[J]. 中国动物检疫,2020,37(10):1-6.
[13]王治維,图门巴雅尔,胡明明,等. 2017—2019年山西省小反刍兽疫血清学和病原学监测[J]. 中国动物检疫,2020,37(8):1-4.
[14]Mao L,Yang L,Li W,et al. Epidemiological investigation and phylogenetic analysis of caprine parainfluenza virus type 3 in sheep of China[J]. Transboundary and Emerging Diseases,2019,66(3):1411-1416.
[15]霍晓丽,李文良,毛 立,等. 绵羊肺炎支原体和小反刍兽疫病毒双重RT-PCR检测方法的建立[J]. 江苏农业科学,2020,48(19):185-189.
