绵羊mtDNA变异与产羔数关联分析
2021-07-26张利平吴建平靳继鹏孙渭博张筱艳
肖 帆,张利平*,吴建平,靳继鹏,孙渭博,张筱艳
(1.甘肃农业大学动物科学技术学院,兰州 730070;2.甘肃省农业科学院畜草与绿色农业研究所,兰州 730070)
绵羊(ovisaries)的繁殖性能是其重要的经济性状之一,直接决定着养羊业的生产成本和经济效益。提高绵羊每胎次的产羔数是提高生产效益的最直接方式,具有十分重要的意义。绵羊的产羔性状在不同品种间存在明显差异[1],我国多数绵羊品种以产单羔为主,繁殖力较低,少数品种产多羔。例如,我国特有的小尾寒羊、湖羊等以产多羔为主,都属于高繁殖力绵羊品种;而我国其它绵羊品种,如蒙古羊、藏羊等主要以单胎羊为主,产双羔的比例较低,一般在5%以下[2]。相比于传统育种方法,通过分子遗传标记技术筛选出与绵羊产羔数相关的分子标记,就可在羔羊时期鉴定出具有高繁殖力的个体,从而实现绵羊繁殖性能的持续优化提升[3]。绵羊产羔数是一个复杂的数量性状,遗传力为0.03~0.10,受遗传、表观修饰和激素等的调控,绵羊产羔数性状受主效基因控制的同时还受微效多基因的调控[4]。目前,已确定影响绵羊产羔数的主效基因有BMPR1B、BMP15、GDF9、B4GALNT2等[5-10]。但基于线粒体DNA(mitochondrion DNA,mtDNA)变异与表型性状间的关联分析报道较少。与核DNA遗传不同的是,mtDNA结构比较简单,呈共价、闭合的双链环状结构,从母体到后代通常不发生变化[11]。线粒体是能量代谢中心,通过氧化磷酸化系统产生三磷酸腺苷(adenosine triphosphate,ATP),因此它们在细胞内有自己的生命过程,其复制和转录独立进行,不受细胞周期的限制[12]。
mtDNA在动物经济性状方面的研究较少。Tess等[13]研究发现,牛的产乳性能与线粒体核苷酸变异具有显著关联。在猪肥育性状研究中发现存在mtDNA的遗传学效应[14]。侯玲灵[15]研究了线粒体异质性在不同品种间和固始鸡资源群体中的分布及其对重要经济性状的效应。Zhang等[16]采用PCR-SSCP和DNA测序方法检测了6个中国牛种714个个体的mtDNAND5基因多态性,结果表明,ND5基因变异与早期生长性状差异显著。Biase等[17]研究表明,牛mtDNA的tRNA基因变异与个体质量显著相关。Jeon等[18]研究得出,牛mtDNA的COI、COII、COIII 基因变异与重量性状差异显著相关。傅建军等[19]研究得出,草鱼D-loop序列变异对子代生长性状具有显著影响,推测可以利用mtDNA多态性信息进行辅助选择。Aljubouri和Al-Shuhaib[20]通过研究伊朗3种多胎绵羊的D-loop区遗传多样性,发现它们在地理分布和表型性状上存在明显差异。Wei等[21]研究发现,虽然BMPR1B基因与中国一些绵羊品种或品系的高繁殖力相关,但它并不是影响中国绵羊繁殖力的唯一基因。Niu等[22]比较了藏羊与其他绵羊线粒体全基因组序列,藏羊mtDNA的拷贝数显著低于萨福克羊,藏羊在12S rRNA的突变还未趋于稳定,确定了藏羊耐缺氧的分子标记。Reicher等[23]研究Afec-Assaf母羊D-loop区和细胞色素b(Cytb)后发现,HB和HC单倍型显著影响母羊的产羔数性状。陈晓勇等[24]在萨福克绵羊mtDNA编码区中发现14个变异位点与产羔数显著相关。
因此,本试验采用PCR结合DNA测序技术对小尾寒羊、湖羊、蒙古羊、欧拉羊以及甘肃高山细毛羊的mtDNA多态性进行检测,并结合产羔数进行关联性分析,旨在探索mtDNA与绵羊产羔性状的相关性,寻找影响绵羊繁殖性能的分子遗传标记,为高繁殖力绵羊的选育提供理论依据和方法。
1 材料与方法
1.1 样品采集
选取健康、有产羔记录的3~4岁小尾寒羊多羔母羊(multiple Small tailed han sheep,XM)63只、湖羊多羔母羊(multiple Hu sheep,HM)47只、蒙古羊双羔母羊(twins Mongolian sheep,MT)42只、蒙古羊单羔母羊(singletons Mongolian sheep,MS)46只、欧拉羊双羔母羊(twins Oula sheep,OT)52只、欧拉羊单羔母羊(singletons Oula sheep,OS)50只、甘肃高山细毛羊双羔母羊(twins Gansu alpine fine wool sheep,GT)42只和甘肃高山细毛羊单羔母羊(singletons Gansu alpine fine wool sheep,GS)48只为试验对象,取其颈静脉血5 mL,用EDTA抗凝,迅速送回实验室,-20 ℃冷冻保存备用。
1.2 提取血液基因组DNA
采用DNA提取试剂盒(天根生化科技有限公司)提取基因组DNA,并通过分光光度计与琼脂糖凝胶电泳进行质量及浓度检测。
1.3 PCR反应体系及反应程序
从GenBank(NCBI)中选取绵羊线粒体DNA序列(登录号为AF 010406.1),用Primer 5.0软件设计引物,引物由金唯智有限公司合成,具体如表1所示。

表1 引物序列信息Table 1 Primers sequence information
PCR扩增反应体系为20 μL:Taq Mix 10 μL,RNase-free ddH2O 7 μL,上、下游引物各1 μL,DNA模板1 μL。引物P1的PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,62 ℃退火30 s,72 ℃延伸30 s,40个循环;72 ℃总延伸10 min。引物P2的PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃总延伸10 min。引物P3的PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,66 ℃退火30 s,72 ℃延伸90 s,72 ℃总延伸10 min,35个循环。将检测合格的PCR产物送至生物公司(北京奥科鼎盛生物技术有限公司)进行DNA测序。
1.4 数据分析
测序结果通过DNAMAN软件对其数据进行拼接,运用NCBI BLAST将试验绵羊序列与绵羊线粒体DNA标准序列(GenBank AF 010406.1)比对分析,通过DNAsp和MEGA软件对多态性进行统计分析。用SPSS 21.0软件Duncan′s法进行多重比较显著性检验,单因素方差分析(One-Way ANOVA)多态性与产羔数的相关性。
2 结 果
2.1 绵羊血液基因组DNA检测
采用DNA提取试剂盒从采集的绵羊冷冻血中提取DNA,通过1%的琼脂糖凝胶电泳检测,条带清晰,无杂带等现象,并且分光光度计检测OD值为1.70~1.90,说明提取的DNA无降解,完整性好(图1)。

M.DNA相对分子质量标准M.DL2000 DNA marker图1 绵羊血样基因组DNA的检测结果Fig.1 Detection results of sheep blood genomic DNA
2.2 PCR扩增产物检测
运用引物及其反应程序,以提取的DNA为模板进行PCR扩增。P1、P2、P3引物扩增结果见图2A、2B、2C,PCR扩增产物大小(分别为321、736、1 421 bp)与预期相近,符合目的片段大小,且条带清晰无杂带,可进行下一步测序反应。
2.3 测序结果比对分析
运用NCBI BLAST将试验绵羊序列与绵羊线粒体DNA标准序列(GenBank AF 010406.1)进行比对分析,结果显示,同源性达99%以上,证明此序列为目的序列,且在所有个体中没有检测到杂合型变异位点。
2.4 绵羊变异位点分析
试验绵羊群体共有309个变异位点,其中简约信息位点212个。小尾寒羊194个变异位点,其中简约信息位点128个;湖羊139个变异位点,其中简约信息位点106个;蒙古羊198个变异位点,其中简约信息位点133个;欧拉羊204个变异位点,其中简约信息位点137个;甘肃高山细毛羊177个变异位点,其中简约信息位点122个。从变异位点中筛选出16个与产羔数有关的变异位点并进行分析。变异位点的具体分布情况见表2。

表2 不同产羔类型绵羊变异位点统计Table 2 Statistics of variation sites of sheep with different lambing types
2.5 不同繁殖力绵羊的变异位点基因型分布差异分析
采用SPASS 21.0软件检测试验绵羊A1099T、T1112C、C13576T、T13837C、T13855C、T15445C、T15627C、T15657C、T15668C、A15714G、T15732C、A15923G、T15956C、G15977A、A16101G和C16429T位点基因型分布差异,如表3~表9所示。T15445C、T15627C位点基因型分布一致。在A1099T位点,小尾寒羊多羔母羊(XM)与蒙古羊单羔母羊(MS)、欧拉羊双羔母羊(OT)、欧拉羊单羔母羊(OS)、甘肃高山细毛羊双羔母羊(GT)、甘肃高山细毛羊单羔母羊(GS)之间基因型分布均有显著性差异(P<0.05);湖羊多羔母羊(HM)也与蒙古羊单羔母羊(MS)、欧拉羊双羔母羊(OT)、欧拉羊单羔母羊(OS)、甘肃高山细毛羊双羔母羊(GT)、甘肃高山细毛羊单羔母羊(GS)之间基因型分布均有显著性差异(P<0.05)。在T1112C、C13576T、T13837C和T13855C位点,小尾寒羊多羔母羊(XM)与湖羊多羔母羊(HM)之间基因型分布均无显著差异(P>0.05),但小尾寒羊多羔母羊(XM)与其余试验组绵羊群体之间基因型分布均有显著性差异(P<0.05),同时湖羊多羔母羊(HM)与其余试验组绵羊群体之间基因型分布也均有显著性差异(P<0.05)。
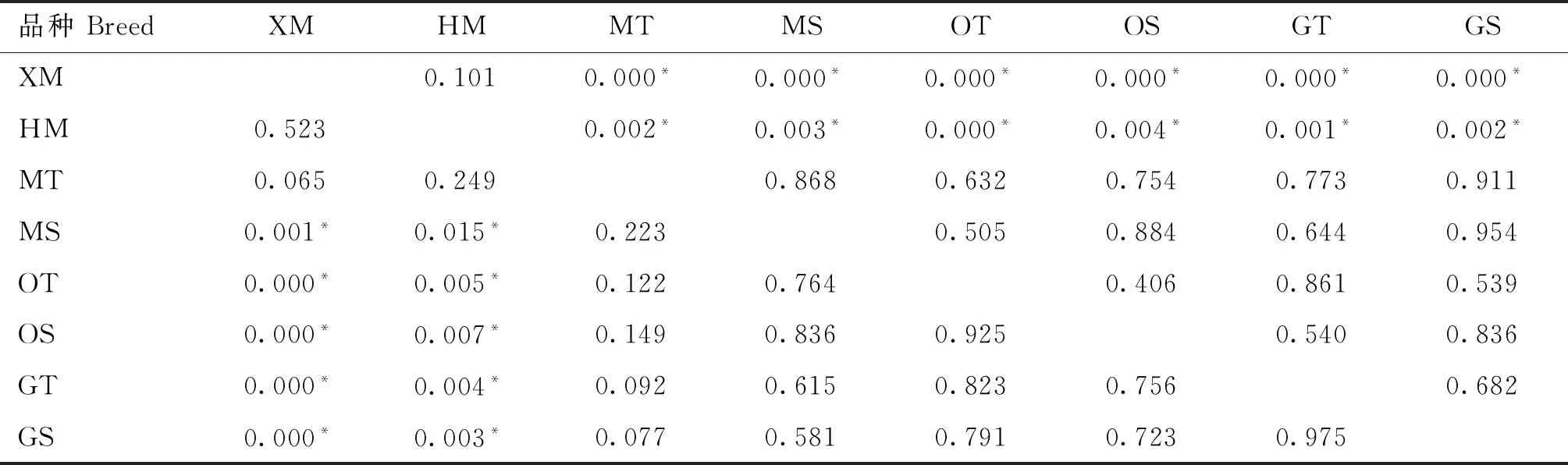
表3 A1099T和T1112C位点基因型分布差异检测结果Table 3 Results of genotype distribution difference at A1099T and T1112C sites
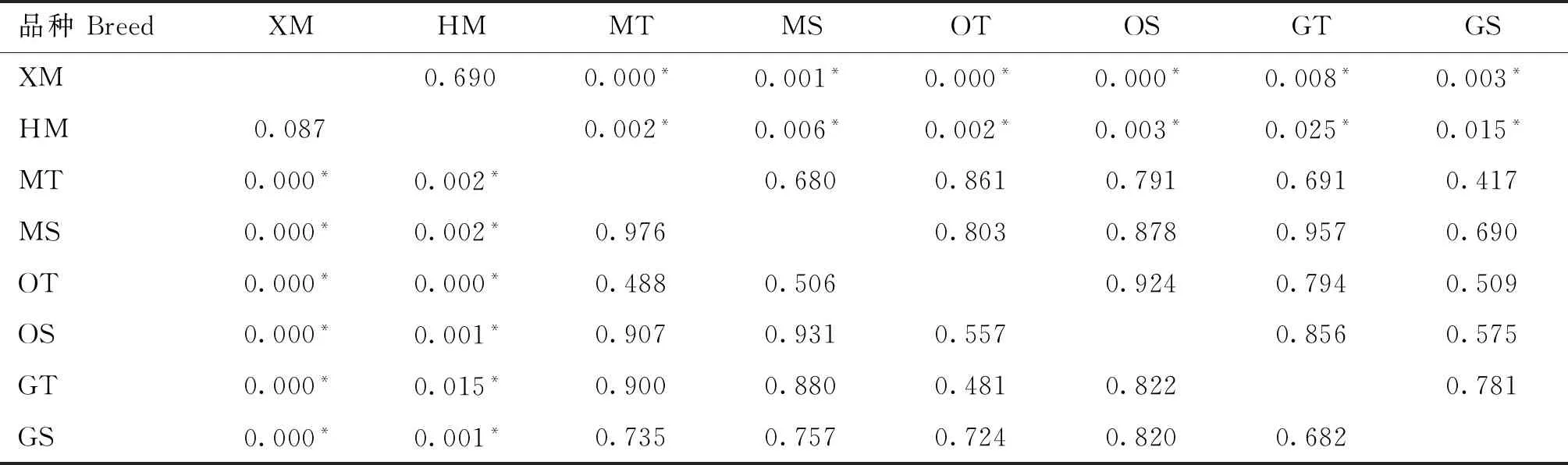
表4 C13576T、T13855C和T13837C位点基因型分布差异检测结果Table 4 Results of genotype distribution difference at C13576T,T13855C and T13837C sites
从表5中可知,在T15445C、T15627C位点,欧拉羊双羔母羊(OT)与蒙古羊单羔母羊(MS)之间基因型分布无显著差异(P>0.05),与其余试验组的绵羊群体之间基因型分布均有显著性差异(P<0.05);在T15657C位点,欧拉羊双羔母羊(OT)与小尾寒羊多羔母羊(XM)、欧拉羊单羔母羊(OS)、湖羊多羔母羊(HM)、蒙古羊双羔母羊(MT)之间基因型分布均有显著性差异(P<0.05)。

表5 T15445C、T15627C和T15657C位点基因型分布差异检测结果Table 5 Results of genotype distribution difference at T15445C,T15627C and T15657C sites
从表6中可知,在T15668C位点,蒙古羊双羔母羊(MT)与其余试验组绵羊群体之间基因型分布均有显著性差异(P<0.05)。在A15714G位点,蒙古羊双羔母羊(MT)与小尾寒羊多羔母羊(XM)、湖羊多羔母羊(HM)、甘肃高山细毛羊双羔母羊(GT)之间基因型分布均有显著性差异(P<0.05)。

表6 T15668C和A15714G位点基因型分布差异检测结果Table 6 Results of genotype distribution difference at T15668C and A15714G sites

A.P1扩增产物检测结果;B.P2扩增产物检测结果;C.P3扩增产物检测结果。M.DNA 相对分子质量标准A.The amplification products of P1;B.The amplification products of P2;C.The amplification products of P3.M.DL2000 DNA marker图2 扩增产物检测结果Fig.2 Detection results of amplification products
从表7中可知,在T15732C位点,欧拉羊单羔母羊(OS)与欧拉羊双羔母羊(OT)、甘肃高山细毛羊单羔母羊(GS)之间基因型分布均有显著性差异(P<0.05)。在A15923G位点,甘肃高山细毛羊双羔母羊(GT)与欧拉羊双羔母羊(OT)、甘肃高山细毛羊单羔母羊(GS)之间基因型分布均有显著性差异(P<0.05)。
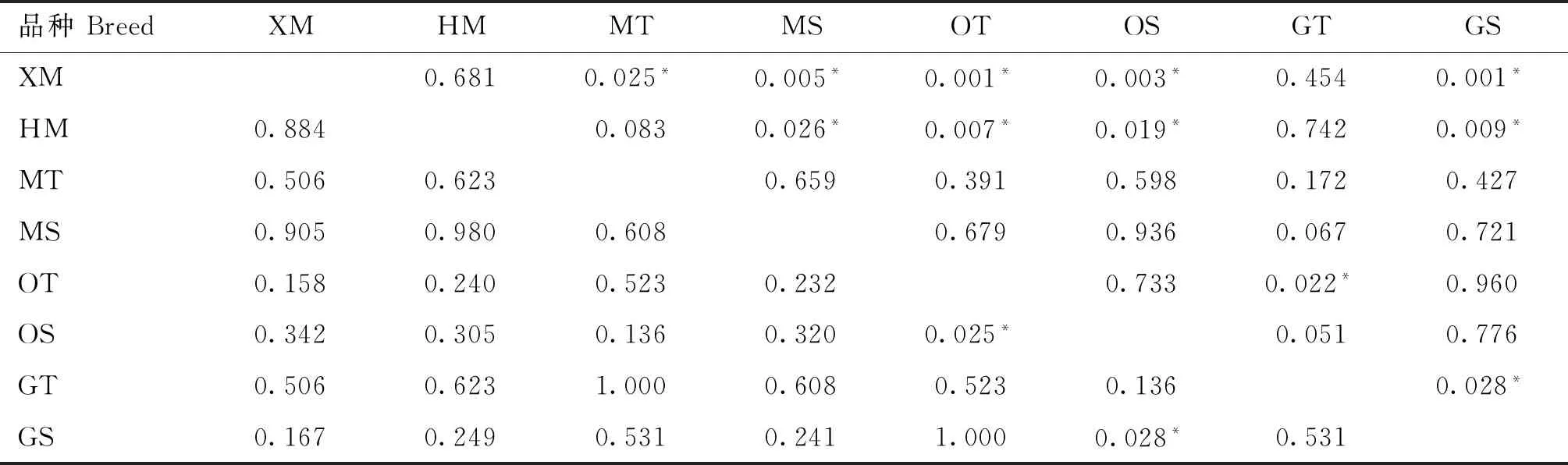
表7 T15732C和A15923G位点基因型分布差异检测结果Table 7 Results of genotype distribution difference at T15732C and A15923G sites
从表8中可知,15956C位点小尾寒羊多羔母羊(XM)与湖羊多羔母羊(HM)之间基因型分布差异不显著(P>0.05),湖羊多羔母羊(HM)与蒙古羊双羔母羊(MT)之间基因型分布差异不显著(P>0.05),但小尾寒羊多羔母羊(XM)和湖羊多羔母羊(HM)与其余试验组绵羊群体之间基因型分布均有显著性差异(P<0.05);蒙古羊双羔母羊(MT)与欧拉羊双羔母羊(OT)之间基因型分布有显著性差异(P<0.05)。G15977A位点小尾寒羊多羔母羊(XM)与湖羊多羔母羊(HM)、欧拉羊双羔母羊(OT)之间基因型分布有显著性差异(P<0.05),欧拉羊双羔母羊(OT)和欧拉羊单羔母羊(OS)之间基因型分布有显著性差异(P<0.05)。

表8 T15956C和G15977A位点基因型分布差异检测结果Table 8 Results of genotype distribution difference at T15956C and G15977A sites
从表9中可知,在A16101G位点,欧拉羊双羔母羊(OT)与小尾寒羊多羔母羊(XM)、湖羊多羔母羊(HM)、蒙古羊双羔母羊(MT)、蒙古羊单羔母羊(MS)、欧拉羊单羔母羊(OS)、甘肃高山细毛羊双羔母羊(GT)之间基因型分布均有显著性差异(P<0.05)。在C16429T位点,欧拉羊双羔母羊(OT)仅与蒙古羊单羔母羊(MS)之间基因型分布差异不显著(P>0.05),与其余试验组绵羊群体之间基因型分布均有显著性差异(P<0.05)。
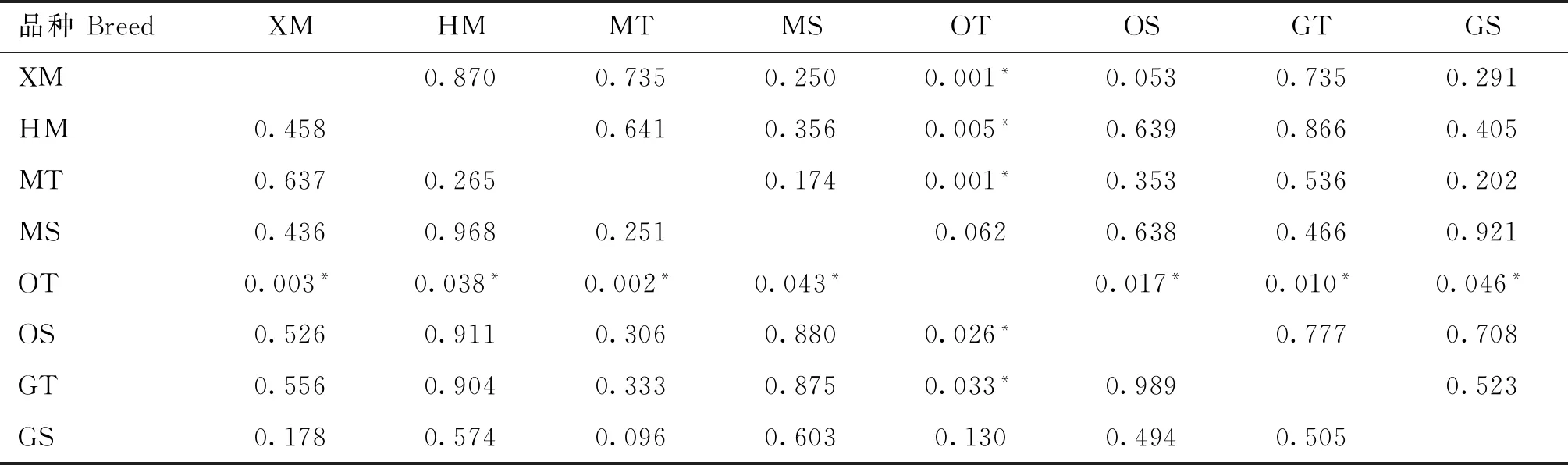
表9 绵羊A16101G和C16429T位点基因型分布差异检测结果Table 9 Results of genotype distribution difference at A16101G and C16429T sites
2.6 绵羊变异位点与产羔性状的相关性分析
对试验绵羊群体的变异位点与产羔性状的关联分析结果见表10,结果显示,在T15445C和T15627C位点,欧拉羊产羔数C型(2.000只)均显著高于T型(1.489只)(P<0.05)。T15657C位点,欧拉羊产羔数C型(1.800只)显著高于T型(1.459只)(P<0.05)。T15668C位点,蒙古羊产羔数C型(2.000只)显著高于T型(1.452只)(P<0.05)。T15732C位点,欧拉羊产羔数T型(1.530只)显著高于C型(1.000只)(P<0.05)。A15923G位点,甘肃高山细毛羊产羔数G型(1.800只)显著高于A型(1.425只)(P<0.05)。T15956C位点,欧拉羊产羔数T型(1.550只)显著高于C型(1.230只)(P<0.05)。G15977A位点,欧拉羊产羔数A型(1.736只)显著高于G型(1.457只)(P<0.05)。C16429T位点,欧拉羊产羔数T型(1.695只)显著高于C型(1.455只)(P<0.05)。
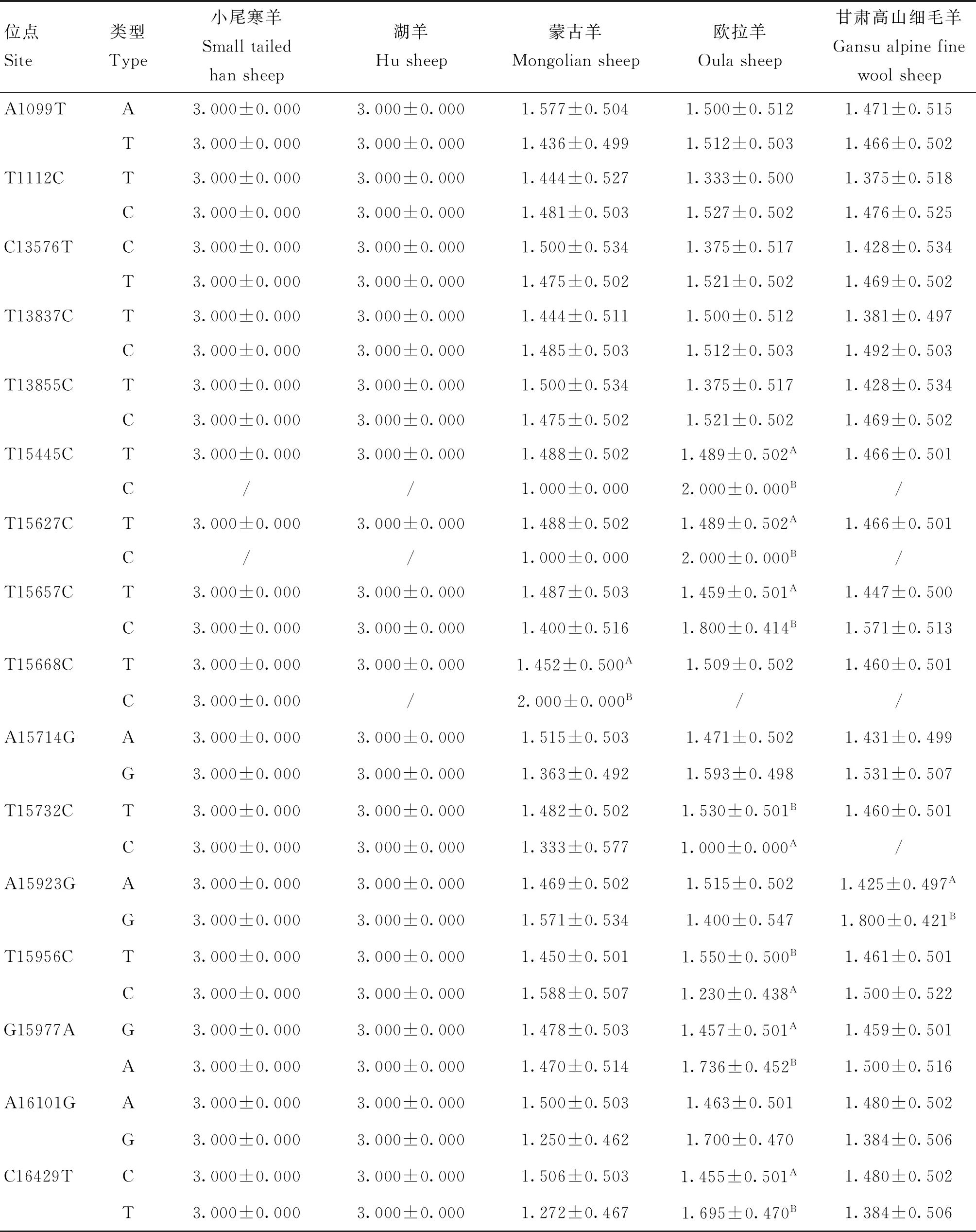
表10 绵羊mtDNA变异位点与产羔性状的相关性Table 10 Correlation between mtDNA variation sites and litter size in sheep
2.7 绵羊mtDNA单倍型与产羔性状的相关性分析
试验绵羊mtDNA有9个与产羔数显著相关的突变位点(15445、15627、15657、15668、15732、15923、15956、15977、16429)形成28个单倍型,个体数大于试验绵羊总数5%的单倍型有4种,其在群体中的具体分布如表11所示。

表11 显著变异位点单倍型群体分布Table 11 Population distribution of haplotype at significant variation sites
表12显示了mtDNA显著突变位点形成的单倍型与产羔数的相关性分析结果,欧拉羊的TTCTTACGC(Hap_2)单倍型母羊产羔数(1.778只)显著大于TTTTTACGC(Hap_1)单倍型和TTTTTATGC(Hap_4)单倍型母羊产羔数(1.386和1.167只)。但欧拉羊的TTCTTACGC(Hap_2)单倍型母羊产羔数与TTTTTACAT(Hap_3)单倍型母羊产羔数(1.625只)无显著性差异。通过从整体上分析所有不同产羔类型试验绵羊单倍型与产羔数的关系发现,TTTTTATGC(Hap_4)单倍型母羊产羔总数(2.254只)显著大于其他单倍型。

表12 显著变异位点单倍型与产羔数的相关性Table 12 Correlation between haplotypes at significant variation sites and litter size
3 讨 论
绵羊繁殖力的高低取决于排卵的数量、卵子的受精能力、性成熟的时间、胎产羔数等。绵羊繁殖性状中的胎产羔数性状存在3种方式:一胎产一羔,也称单胎性状,是指母羊一生中每胎都只产1只羔羊,其母羊称单胎母羊;一胎产双羔,也称双胎性状或双羔性状,是指母羊一生中有过一胎产2只羔羊的,其母羊称双羔羊或双胎羊;一胎产多羔也称多胎性状或多胎性,是指母羊一生中有过一胎产3只或3只以上羔羊的,其母羊称多胎羊。mtDNA的多态性与人类各种疾病及动物经济性状有关。研究发现,畜禽重要经济性状,如鸡的增重与产蛋量,奶牛产奶量、乳脂量、乳脂率和蛋白含量,猪的增重,羊的增重与产毛量等性状,都存在着核外基因效应。李杨等[25]采用DNA测序和PCR-RFLP方法,对瓢鸡线粒体DNACOX3基因变异与生长、屠体性状进行了关联分析,结果表明,C10669T位点基因型间生长性状差异显著。Qin等[26]研究发现,荷斯坦奶牛产奶量与ATPASE8/6的单倍型显著相关,因此ATPASE8/6的单倍型可能是影响荷斯坦奶牛产奶量的分子标记。线粒体DNA有拷贝数多、突变率高、母系遗传且参与氧化磷酸化合成ATP等特点,且ATP是细胞最重要的能量来源,因此mtDNA直接影响ATP的合成,进而影响与体内能量代谢密切相关的重要经济性状[27]。由此可见,mtDNA的遗传变异可用来分析畜禽重要经济性状核外基因效应,并进一步将其应用于标记辅助选择来改良畜禽品种,提高动物生产效率。产羔数是绵羊生产中重要的经济性状。线粒体是卵母细胞内最多的细胞器,其mtDNA拷贝数变异及结构突变累积可导致细胞内ATP合成减少,从而影响卵母细胞质量、受精能力及胚胎的发育潜能[28]。由此可见,mtDNA突变使线粒体结构、功能发生改变,从而影响线粒体代谢和氧化呼吸功能,直接影响ATP含量,从而影响卵母细胞减数分裂和卵母细胞受精率[29]。牟天伊等[30]讨论了卵母细胞mtDNA拷贝数与卵母细胞质量、胚胎发育的相关性,研究结果显示,mtDNA突变可引起线粒体结构、功能的改变,同时也与卵母细胞受精有关。产羔数性状在核基因上的研究非常丰富,但线粒体DNA变异与产羔数性状的关系研究较少。因此,本试验分析mtDNA编码区及D-loop 区变异与产羔数的相关性具有重要意义。
mtDNA是细胞核外的遗传物质,共价闭合的环状双链DNA具有结构简单、分子拷贝数高、结构稳定、进化速度快、分子质量小、无组织特异性等特点[31]。Reicher等[23]在mtDNA编码区序列发现的245个变异位点中,有26个是非同义突变,有8个序列在22个tRNA 中也出现了变异。本试验采用PCR结合DNA直接测序技术对试验绵羊多态性进行检测,并结合产羔数进行关联性分析,5个品种试验绵羊群体共有309个变异位点,其中简约信息位点212个;试验绵羊群体在D-loop区共有264个变异位点,简约信息位点194个。陈晓勇等[24]以杜泊、陶赛特、萨福克绵羊为研究对象,通过线粒体基因组测序发现,杜泊羊的mtDNA编码区存在25个突变位点,陶赛特羊mtDNA编码区存在20个突变位点,萨福克羊mtDNA编码区存在77个突变位点。本试验结果与陈晓勇等[24]的研究相比,mtDNA D-loop 区序列不编码蛋白,因而该区域在进化上受选择压力较小,表现出更为丰富的多态性。
本试验筛选出16个与产羔数有关的变异位点并进行分析。A1099T、T1112C、C13576T、T13837C和T13855C位点在XM与HM之间基因型分布均无显著差异(P>0.05),XM与MS、OT、OS、GT、GS之间基因型分布均有显著性差异(P<0.05)。陈晓勇等[24]分析了萨福克绵羊mtDNA的17个变异位点,结果显示,16S rRNA区域的A1099T、T1112C、T1932G、C2443T以及多肽编码区的A3949G、A8039G、A8515G、A8779G、C13576T、T13837C、C13855T位点对产羔数影响显著(P<0.05)。根据不同繁殖力绵羊变异位点基因型分布差异分析推测,A1099T、T1112C、C13576T、T13855C和T13837C位点对于小尾寒羊和湖羊产羔性状有一定的影响,T15668C位点影响蒙古羊产羔数,T15445C、T15627C、T15657C、T15732C、G15977A、A16101G和C16429T位点影响欧拉羊产羔数,A15923G位点影响甘肃高山细毛羊产羔数。
在mtDNA分子中分编码区和非编码区。非编码区即线粒体基因组的D-loop区,存在高度突变并控制着mtDNA的复制与转录[31]。相比编码区,D-loop区序列不编码蛋白,是mtDNA的调控区域,但研究表明,它的突变与恶性肿瘤及动物经济性状有关。近几年,在肿瘤mtDNA突变的研究中,日益发现D-loop区也是很重要的热点突变区域,D-loop区的突变可能是使线粒体功能紊乱既而促进肿瘤发生的一个重要因素[32]。Tsai等[33]研究表明,猪的mtDNA变异数与卵母细胞质量有25%的相关性,发育正常卵母细胞的mtDNA拷贝数与16383位点变异水平正相关,该变异位点是mtDNA转录和复制的调控区域,mtDNA单倍型影响猪的繁殖能力,可以作为一个标记,以补充现有的选择方法,识别高产猪。陈晓勇等[24]研究表明,杜泊羊mtDNA的13个 非同义突变对产羔数均无显著影响,陶赛特绵羊mtDNA的9个非同义突变位点均与产羔数关联不显著,萨福克绵羊中发现的14个变异位点与产羔数显著相关。本试验通过对试验绵羊群体变异位点与产羔性状的关联分析结果表明,T15668C变异位点对蒙古羊产羔数影响显著(P<0.05),T15445C、T15627C、T15657C、T15732C、T15956C、G15977A和C16429T变异位点对欧拉羊产羔数影响显著(P<0.05),A15923G变异位点对甘肃高山细毛羊产羔数影响显著(P<0.05)。陈晓勇[34]研究表示,mtDNA遗传变异对产羔数性状影响显著(P<0.05)。Reicher等[23]研究Afec-Assaf母羊D-loop区和细胞色素b(Cytb)显示,mtDNA多态性影响母羊的产羔数性状,HB和HC单倍型显著影响母羊的产羔数性状。本研究显示,Hap_2单倍型影响欧拉羊母羊产羔数,但通过从整体上分析所有试验绵羊单倍型与产羔数的关系发现,Hap_4型对绵羊产羔数有显著影响,而Hap_2和Hap_4单倍型的不同之处在T15657C位点(第3个碱基C-T)和T15956C位点(第7个碱基C-T)。试验绵羊群体在T15657C变异位点检测到T→C突变,发生突变最多的是OT,最少的是OS;而T型个体数占比最高的是HM(93.62%)和XM(90.48%),T型的OT个体数占比较低,为76.92%。在T15956C位点,各品种T型个体数占比从高到低依次是XM(52.38%)、HM(38.30%)、MT(23.81%)、OS(20.00%)、MS(15.22%)、GT(14.29%)、GS(12.50%)、OT(5.77%);各品种C型个体数占比从高到低依次是OT(94.23%)、GS(87.50%)、GT(85.71%)、MS(84.78%)、OS(80.00%)、MT(76.19%)、HM(61.70%)、XM(47.62%),本研究与Reicher等[23]的研究结果类似,都证实了mtDNA遗传变异对绵羊产羔数性状存在遗传效应。
4 结 论
本试验筛选出16个与产羔数有关的变异位点并进行分析。在A1099T、T1112C、C13576T、T13837C和T13855C位点,HM与XM基因型分布基本一致。T15668C变异位点,MT与MS之间基因型分布有显著性差异(P<0.05),也对蒙古羊产羔数影响显著(P<0.05)。在T15445C、T15627C、T15657C、T15732C、G15977A和C16429T位点,OS与OT之间基因型分布有显著性差异(P<0.05),也对欧拉羊产羔数影响显著(P<0.05)。在A15923G位点,GT与GS之间基因型分布均有显著性差异(P<0.05),对甘肃高山细毛羊产羔数影响显著(P<0.05)。Hap_2型显著影响欧拉羊母羊产羔数,Hap_4对绵羊产羔数也具有一定的影响。
