老芒麦幼苗糖代谢对PEG模拟干旱胁迫的响应
2021-07-26刘敏洁刘文辉杨伟张永超秦燕吴瑞
刘敏洁,刘文辉,杨伟,张永超,秦燕,吴瑞
(1.青海省青藏高原优良牧草种质资源利用重点实验室,青海大学畜牧兽医科学院,青海 西宁 810016;2.甘肃农业大学 草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
青藏高原地处我国西南地区,平均海拔4 000 m,具有独特的生态系统。近年来,随着人类活动加剧、全球气候变暖、水资源缺乏等原因,导致青藏高原草地破坏严重。青海省地处青藏高原东北部,属高原大陆性气候,空气干燥,太阳辐射较强,降水较少,春旱发生频繁,导致青藏高原草地植被因缺水退化,给原有的草地生态系统带来损失,使干旱成为制约牧草生长及增产的关键生态因素之一[1]。因此,选择具有较强适应性和抗旱能力的优良牧草品种是促进青藏高原地区牧草生产和草地生态修复的关键。目前,关于植物抗旱性的研究表明干旱条件下,植物的种子萌发、植株形态和生理指标均会发生不同程度的变化,最终影响植株的产量及品质[2-3]。但对青藏高原地区植被的抗旱性研究较少,通过本研究,可为抗旱品种的培育和干旱贫瘠土地的开发利用提供理论依据,对青海高原畜牧业发展和恢复受损草地有重要的现实意义。
老芒麦(Elymussibiricus),别名西伯利亚披碱草,属禾本科(Gramineae)小麦族(Triticeae)披碱草属(Elymus),为多年生疏丛型中旱生植物,广泛分布于我国东北、内蒙古、陕甘宁、西藏等地[4-5]。老芒麦具有叶量较多、再生性好、适口性好和营养价值高等优点,同时较耐旱,是青藏高原大面积播种的主要牧草之一。青牧1号老芒麦是通过国家审定登记的品种,由青海省畜牧兽医科学院育成。因其叶片多、草产量高、品质好,是青海省目前推广应用最多的草种之一。国内外学者对老芒麦在干旱环境中的种子萌发、幼苗生长状态及生理响应机制进行了较多研究和探讨[6-8],发现干旱胁迫对老芒麦种子萌发及幼苗生长具有抑制作用[7-8],且株高及叶面积明显下降[9],甚至出现不同程度倒伏、叶片枯萎凋落,植株正常生理代谢发生改变[6,10]。其中,关于老芒麦苗期抗旱胁迫的生理生化研究主要集中于脯氨酸(Proline,Pro)、丙二醛(Malondialdehyde,MDA)、可溶性糖、以及超氧化物歧化酶(Superoxide dismutase,SOD)及过氧化物酶(Peroxidase,POD)等相关指标的研究[6,11],但对干旱胁迫下老芒麦叶片糖代谢的变化研究缺乏详细报道。
植物叶片中糖的合成和代谢是影响植株正常生长发育的重要基础,在植物抵御逆境胁迫中具有重要的调节作用[12]。在干旱胁迫下植株通过调节糖分积累和分配缓解植株所受的伤害,维持正常生长[13]。PEG溶液模拟干旱操作方便,重复性好,被普遍运用于各种植物的抗旱性研究[14-16]。因此,本研究以青牧1号老芒麦为试验材料,采用不同浓度PEG溶液对老芒麦幼苗进行模拟干旱胁迫处理,旨在探讨老芒麦幼苗在干旱胁迫条件下可溶性糖、葡萄糖、蔗糖、果糖及蔗糖代谢相关酶的变化,全面了解老芒麦应对干旱胁迫的生理反应,为老芒麦抗旱育种与栽培提供理论基础。
1 材料和方法
1.1 试验材料
试验材料青牧1号老芒麦种子产自青海省海北州西海镇,为2018年收获的种子,由青海省畜牧兽医科学院草原所提供。
1.2 试验设计
选取完整、饱满的老芒麦种子,将种子均匀撒播于装有清洗干净并灭菌的河砂的育苗钵(下底直径5.00 cm,上底直径8.50 cm,高11.00 cm),育苗钵底部留孔,以便吸水。将育苗钵置于白色塑料盒(25 cm×20 cm×12 cm)(每盒6个),塑料盒放于昼夜温度为25℃/20℃、光照时间为16 h/d的恒温箱,每盒加入1 L 1/2 Hoagland营养液,每3 d换1次营养液。出苗10 d后间苗,每钵定株30株,待生长20 d后选取幼苗生长一致的育苗钵进行胁迫处理。用含有不同浓度PEG-6000的1/2 Hoagland营养液模拟干旱胁迫,分别设置低浓度10%(T1)和高浓度30%(T2)2个浓度处理,以不含PEG-6000的1/2 Hoagland营养液为空白对照(CK)。每组处理设置3个重复。干旱胁迫采用称重法[14],每日以含有相应浓度PEG-6000的1/2 Hoagland营养液补充蒸发水分,每3 d更换1次培养液。
分别于胁迫第0,4,8,12 d剪去叶片两端,取生长一致的中段叶片,用蒸馏水冲洗干净,液氮冷冻后-80℃保存,用于指标测定。
1.3 测定项目及方法
酶活性的测定 粗酶液提取、蔗糖合成酶(Sucrose synthase,SS)活性和蔗糖磷酸合成酶(Sucrose phosphate synthase,SPS)活性的测定参照戴云[17]的方法略做修改。酶活性单位为μg/(h·g FW)。
酸性转化酶(Acid invertase,AI)活性和中性转化酶(Neutral invertase,NI)活性测定参照Cruz等[18]的方法。酶的活性单位以μg/(min·g FW)表示。
可溶性糖含量测定采用蒽酮比色法[19],单位表示为mg/g;
葡萄糖、蔗糖和果糖含量测定参照张志良等[20]的方法,单位表示为mg/g。
1.3 数据处理与分析
数据采用Excel 2016统计整理,采用SPSS 21.0软件进行双因素方差分析和0.05水平的Duncan法进行多重比较分析,运用origin 2018制作图表。
2 结果与分析
2.1 PEG胁迫对青牧1号老芒麦幼苗叶片可溶性糖含量的影响
老芒麦幼苗叶片可溶性糖含量在低浓度干旱胁迫下,随着胁迫天数延长呈升-降-升的趋势(表1),在胁迫第12 d达到最大,为24.20 mg/g,但与对照相比差异不显著。高浓度处理下,可溶性糖含量与对照的变化趋势相似,呈先降后升的趋势,在胁迫第12 d含量最高,为24.92 mg/g。

表1 PEG胁迫下老芒麦幼苗叶片可溶性糖的含量
PEG胁迫下老芒麦叶片蔗糖含量随时间延长呈现不同幅度的变化(图1-A)。T1处理4~12 d,蔗糖含量变化无显著差异。T2处理下叶片蔗糖含量随胁迫时间延长逐渐上升,在第8 d达到最大,为36.97 mg/g,较对照增加76.81%。
果糖含量变化整体呈现先升高后下降的趋势(图1-B)。T1处理下,果糖含量于第8 d达到峰值,分别是CK和T2的1.53和1.65倍;T2处理下果糖含量于第4 d最高,在第12 d时显著下降,相比对照和T1,下降幅度分别为58.70%和44.78%(F=18.255,P<0.05)。
葡萄糖含量随着处理天数的增加呈现先增加后下降的趋势(图1-C),处理第4 d,T1、T2处理下葡萄糖含量均为最高值,且两者差异不显著。胁迫至第12 d,各处理下葡萄糖含量与对照均无明显差异。
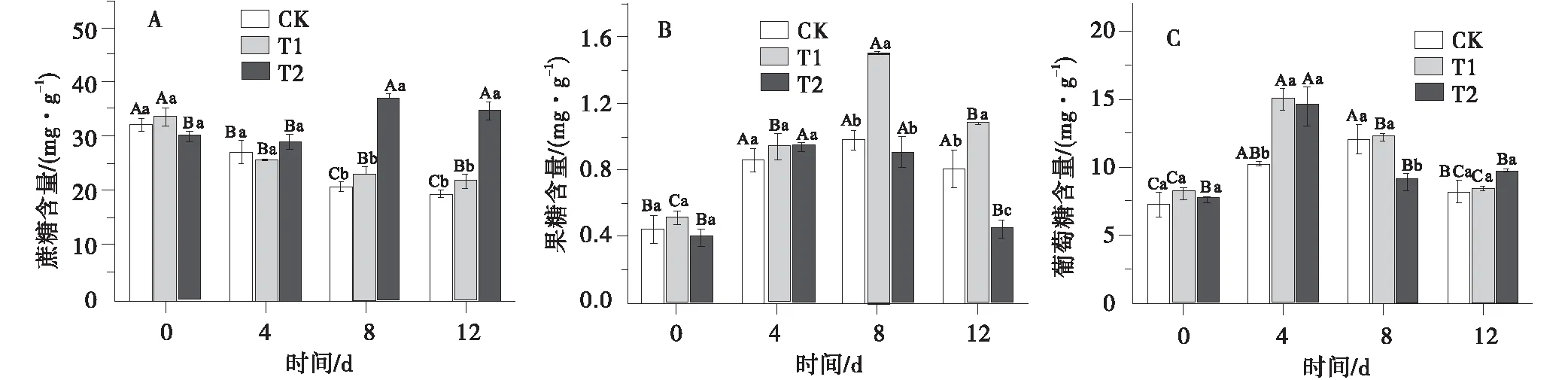
图1 PEG胁迫下老芒麦幼苗蔗糖、果糖、葡萄糖含量
2.2 PEG胁迫对青牧1号老芒麦幼苗叶片蔗糖合成酶和蔗糖磷酸合成酶活性的影响
不同浓度PEG处理下蔗糖合成酶(SS)活性在胁迫初期变化幅度均较小(图2-A)。T2处理下胁迫12 d(F=108.102)时,SS活性达最大,为157.88 μg/(h·g FW),显著高于对照和T1(P<0.05)。与SS不同的是,T1和T2处理的蔗糖磷酸合成酶(SPS)活性分别于胁迫第8 d和第12 d达到最大,较对照分别增加了22.10%和40.05%(图2-B)。
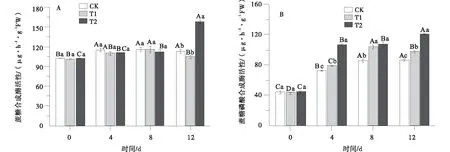
图2 PEG胁迫下老芒麦幼苗蔗糖合成酶和蔗糖磷酸合成酶活性
2.3 PEG胁迫对青牧1号老芒麦幼苗叶片酸性转化酶和中性转化酶活性的影响
与对照相比,T1和T2处理均提高了老芒麦幼苗叶片酸性转化酶(AI)活性(图3-A)。两组胁迫处理4~12 d,同一胁迫天数下,AI活性随胁迫浓度的增加而升高,且处理间差异显著(P<0.05)。T1处理下,AI随胁迫天数延长呈先增后降的变化趋势,胁迫第4 d达最大,为34.49 μg/(min·g FW),随后降低。T2处理下,AI活性在不同天数间存在较大变化且差异显著(F=464.915),胁迫第12 d时活性最高,为57.19 μg/(min·g FW)。
相比AI,干旱胁迫下,中性转化酶(NI)活性逐渐升高(图3-B)。在整个胁迫过程中,T1和T2处理下NI活性均显著高于对照。低浓度胁迫(T1)和高浓度胁迫(T2)下NI活性分别于第12 d和第8 d达到最大,较对照分别增加了129.17%和160.43%。
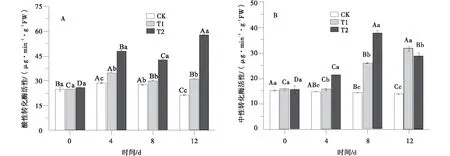
图3 PEG胁迫下老芒麦幼苗叶片酸性转化酶和中性转化酶活性
、
3 讨论
可溶性糖是植物在干旱、高温、低温等胁迫条件下参与渗透调节的重要物质。在干旱胁迫下,植株体内可溶性糖含量增加,从而增强植物体内渗透势,提高植物的抗旱能力[21]。本研究结果显示,处理4 d后高浓度PEG胁迫下可溶性糖含量随着处理天数延长而逐渐上升,这与老芒麦幼苗正常的生理代谢有关。植物在逆境防御过程中,转化酶、蔗糖、己糖(葡萄糖和果糖)、淀粉是相互制约、相互促进的。前人研究结果也发现短期胁迫会导致植株体内蔗糖、果糖、淀粉等碳水化合物快速积累[22-23]。本试验中PEG胁迫后葡萄糖和果糖含量整体呈先升高后下降的趋势,且高浓度PEG胁迫使老芒麦幼苗叶片蔗糖的含量随时间延长逐渐积累,可能的原因是蔗糖作为植株体内主要的糖,被运送至植物体各个器官用于物质合成或被暂时储存起来最终分解为己糖,从而保证植株生长发育所需的能量供应[24-25]。干旱胁迫下老芒麦植株为了抵御逆境完成正常的生理代谢活动,其体内淀粉水解速度加快,蔗糖含量增加,从而调节细胞的渗透势。Spollen等[26]关于高羊茅(Festucaarundinacea)果糖含量对干旱的响应研究结果表明,高羊茅叶片因水分亏缺其蔗糖含量增加,与本试验结果一致。而戴云[17]对高羊茅干旱及复水的研究结果显示水分胁迫下高羊茅蔗糖含量则呈现先升后降的趋势。根据前人研究分析原因可能是由于长时间胁迫导致原生质膜上脂类双分子层的排列遭到破坏,质膜透性发生改变,从而引起机械损伤和代谢紊乱[17,27]。因此,有关干旱胁迫对植株蔗糖代谢生理的影响还有待进一步研究。
蔗糖合成与代谢过程中的催化酶类对植物体内蔗糖含量动态平衡具有十分重要的作用[28]。蔗糖合成酶活性与蔗糖的分解和合成有关,是蔗糖进入植株代谢途径不可或缺的酶之一[29],其作用主要是催化蔗糖降解,也可催化蔗糖合成[30]。蔗糖磷酸合成酶(SPS)是催化蔗糖合成的关键酶,其活性变化可反映蔗糖生物途径的能力[31],SS和SPS共同调节维持植物体内蔗糖代谢与合成的动态平衡。本试验中低浓度PEG胁迫下,处理过程中SS活性无较大的变化,在高浓度PEG胁迫后期SS活性升高,说明低浓度干旱胁迫对老芒麦植株体内蔗糖合成和分解无明显抑制作用,高浓度则导致植株蔗糖含量上升,SS活性则相应增强。SPS活性在低浓度PEG胁迫下随时间延长呈先升后降的趋势、高浓度胁迫下则持续上升,两种浓度差异显著。这说明在干旱胁迫下,老芒麦植株通过增强SS和SPS活性从而促进蔗糖积累以此抵御干旱对植株造成的损伤。Fu等[32]关于高羊茅、Nemati F等[33]关于小麦(Triticumaestivum)和王维等[34]关于水稻(Oryzasativa)的研究结果与本试验结果一致。
一般来说,转化酶有酸性转化酶(AI)和中性转化酶(NI)两种,在蔗糖分解代谢中均具有重要作用。本研究结果显示,相比对照,PEG干旱胁迫处理下AI活性在胁迫期间虽存在小范围波动,但总体呈增强趋势,可以认为这是老芒麦植株为应对干旱胁迫的一种保护性反应,AI参与催化蔗糖水解成为果糖和葡萄糖,为植株的生长和发育提供碳源和能源[35],高浓度胁迫条件下,AI活性增强促进果糖、葡萄糖积累,以保证植株在逆境下具有正常的生理代谢,从而提供抗逆性。本试验发现30% PEG胁迫的AI和NI活性分别从第4 d和第8 d明显增强,可认为此时为一个临界期,植株受干旱胁迫影响严重,急需通过转化酶调节碳水化合物供给,为植株提高己糖并以此作为碳源[13],这与程智慧等[36]的研究结果相似。现有诸多研究证明不仅是干旱胁迫,在植物遭受低温、高温、盐胁迫等逆境胁迫时,植株叶片内转化酶活性亦会增强[37-39],以此保持植株体内糖代谢平衡,保证植株能正常生长。糖代谢是生物体内的代谢中心,在植株生长发育及品质形成中具有极其重要的作用。
目前,牧草抗旱性仍是科学研究领域中的一个热点问题,随着实验技术的迅猛发展,分子生物学手段已被广泛应用于各项研究,借助分子生物学技术和手段可进行更深层次的机理探究和基因的挖掘。因此,对于干旱胁迫下老芒麦植株糖代谢的基因调控机制亟须更深入的研究。
4 结论
不同浓度PEG胁迫下,老芒麦幼苗体内糖代谢相关产物含量及相关酶活性均发生变化。其中,低浓度胁迫可溶性糖含量呈先升后降再升高的趋势,高浓度胁迫则呈先降后升趋势;处理8~12 d,两组处理的蔗糖含量均显著高于对照,且高浓度胁迫下蔗糖含量增幅更大;果糖和葡萄糖含量均呈先升后降趋势,且处理8~12 d,低浓度胁迫的果糖含量显著高于对照和高浓度胁迫;蔗糖合成酶活性前期受干旱影响较小,高浓度胁迫第12 d显著升高;与对照相比,两组胁迫处理下(4~12 d)蔗糖磷酸合成酶活性均显著升高,且高浓度下增幅更大;不同浓度PEG胁迫对老芒麦幼苗叶片酸性转化酶和中性转化酶活性具有显著影响,高浓度胁迫下酸性转化酶活性显著高于低浓度胁迫和对照,中性转化酶活性在高浓度胁迫下更快达最大值,且显著高于对照和低浓度胁迫。综上所述,老芒麦幼苗叶片内糖代谢相关产物和相关酶对干旱胁迫较敏感,一定范围内,老芒麦幼苗通过增强糖代谢相关酶活性、提高糖含量来应对干旱胁迫,从而提升其耐旱力。
