甘肃省胡枝子属植物的遗传多样性分析
2021-07-26潘平新马瑞马彦军任小燕
潘平新,马瑞,马彦军,任小燕
(甘肃农业大学林学院,甘肃 兰州 730070)
遗传多样性(genetic diversity)是研究生物多样性的一个重要层次,是其他一切多样性的基础和最重要的成分。遗传多样性指地球上所有生物携带的各种遗传信息的总和。遗传多样性的检测方法随着生物学,尤其是遗传学和分子生物学的发展不断提高和完善,从形态学水平、细胞学水平、生理生化水平逐渐发展到分子水平。分子水平的遗传多样性研究一般是通过遗传标记进行[1]。分子标记是在DNA水平上研究植物遗传多样性的方法,在分子水平上反映物种个体间或种群间的差异,是一种较为理想的遗传标记形式。DNA分子标记技术主要有基于分子杂交检测的RFLP,基于PCR的RAPD、SSR、ISSR、AFLP等,以及上述一些方法的改进方法[2]。简单重复序列即SSR(Simple Sequence Repeat)由Moore等于1991年创立,是一类由几个碱基组成的基序串联重复而成的DNA序列,其长度一般较短,每单元长度在1~6 bp,两边有保守的DNA序列。SSR标记因具有高度的多态性、数量丰富、信息含量高和重复性好等特点,而且对DNA的纯度要求不高,这就大大减少了分子标记工作的复杂度。并且SSR标记覆盖整个基因组,遵循孟德尔遗传规律,呈现多基因特点,表现为共显性遗传[3-6]。
胡枝子属(Lespedeza)是豆科蝶形花亚科中一个较大的属,本属植物全世界约有100余种,分布在亚洲、大洋洲、欧洲和北美洲的湿润、半湿润地区[7]。我国有65种[8],集中分布于东北、黄河流域和安徽、浙江、湖北等省区以及台湾山地的林缘、林迹地。该属植物具有广泛的用途,较高的开发利用价值,因此,国外从20世纪初就开始了其引种和栽培技术的研究工作,并取得了一系列的成果。国内学者对于胡枝子属植物的研究大多集中在其生物学特性、栽培技术、药用价值、饲草资源、水土保持及其根瘤菌的研究方面[9-11],对部分地区胡枝子属植物应用形态学、同工酶、RAPD、AFLP、ISSR及SRAP[12-20]进行了遗传多样性研究。本研究利用 SSR 分子标记技术,对甘肃省胡枝子属的10个种100个样品进行遗传多样性与遗传结构分析,在分子水平上揭示胡枝子属在物种水平和居群水平的遗传多样性以及居群间的遗传关系,为胡枝子属植物野生资源的保护与合理利用提供理论指导。
1 材料和方法
1.1 实验材料
2017年10月收集甘肃省胡枝子属的10个种(表1)。种子在实验室培养皿进行发芽,当苗长4 cm时每个种选取了10株,每个单株分别提取总基因DNA,再等量混合,建立DNA池作为PCR模板。

表1 材料与来源
1.2 实验方法
1.2.1 DNA提取方法 采用改良CTAB法提取总DNA[21]。
1.2.2 总基因组DNA质量的检测 取2 μL DNA溶液,用ddH2O稀释至2 000 μL,ddH2O做空白对照,用紫外分光光度计分别测定待测样品液在260 nm与280 nm的D值。1D260≈50 ng/μL,根据D260/D280估计其纯度。用0.8%琼脂糖凝胶电泳检测胡枝子植物总DNA的分子量大小及粗略估计其浓度并检查DNA的完整性。
1.2.3 PCR反应体系和反应条件 PCR反应体系采用优化后的胡枝子20 μL体系,其中包括:模板DNA( 40 ng/μL)0.5 μL、10.0 μmol/L的引物(1对)各0.5 μL、(0.3 mmol/L)dNTPs 2 μL、TaqDNA酶(5 U/μL)0.3 μL、10×TaqBuffer 2 μL、ddH2O 14.2 μL。反应条件:94℃高温预变性3 min,94℃变性30 s,50℃退火45 s(退火温度依据引物变化),72℃延伸90 s,40个循环,最后72℃延伸5 min。PCR产物经8%变性聚丙烯酰胺凝胶电泳(200 V稳压,2 h)分离,银染检测[22]。
1.2.4 引物的筛选 由于胡枝子属没有已发表的SSR引物序列,本实验通过检索Genebank数据库和查阅文献借鉴紫花苜蓿(Medicagosativa)和山生柳(Salixoritrepha)的引物为本次实验所用引物[23-25],合成了14对(10对紫花苜蓿和4对山生柳)引物进行扩增。引物由北京塞百盛生物工程有限公司合成。
1.2.5 数据处理统计 SSR为显性标记,同一引物扩增产物中电泳迁移率一致的条带被认为具有同源性。电泳图谱中的每一条带均视为一个分子标记(marker),代表引物的结合位点。统计稳定且易于辨认的差异性条带数,即按同一位置上扩增产物条带的有无进行统计,有带的(包括反复出现的弱带)标记为“1”,无带的标记为“0”,建立0/1矩阵输入Excel,用作进一步的分析。利用NTSYS-pc 2.0软件进行聚类分析,按简单匹配系数SM 计算种间遗传相似系数(genetic similarity,GS),获得相似系数矩阵。并用SHAN程序中的非加权对群数学平均法( unweighted pair group of arith-metic means,UPGMA)进行聚类分析,并通过Tree plot模块生成聚类图[24-26]。
2 结果与分析
2.1 胡枝子基因组DNA的提取与检测
用改良的CTAB方法提取胡枝子的基因组DNA,并用0.8%的琼脂糖凝胶电泳检测其质量。电泳条带显示所提取的DNA完整,带型清晰一致,无明显降解(图1)。用紫外分光光度法检测了DNA样品的纯度和浓度(表2)。结果表明,用改良的CTAB法提取的胡枝子基因组DNA质量比较好,可用于SSR-PCR分析。
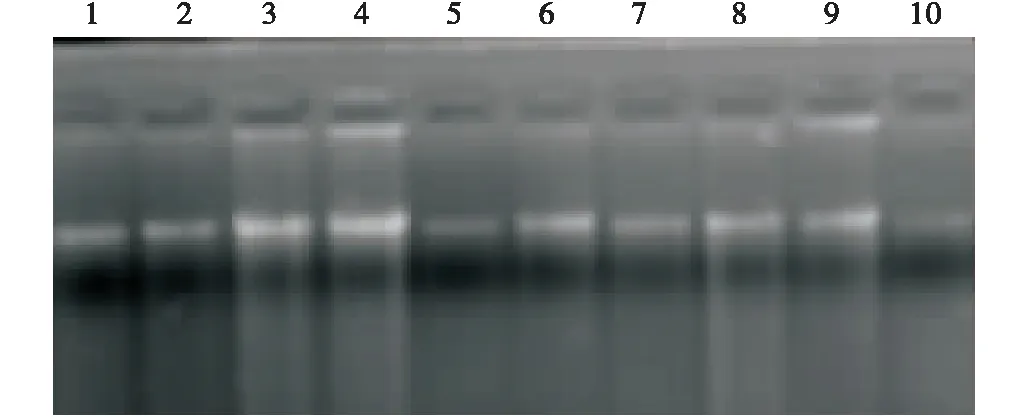
图1 胡枝子基因组DNA的琼脂糖凝胶电泳检测
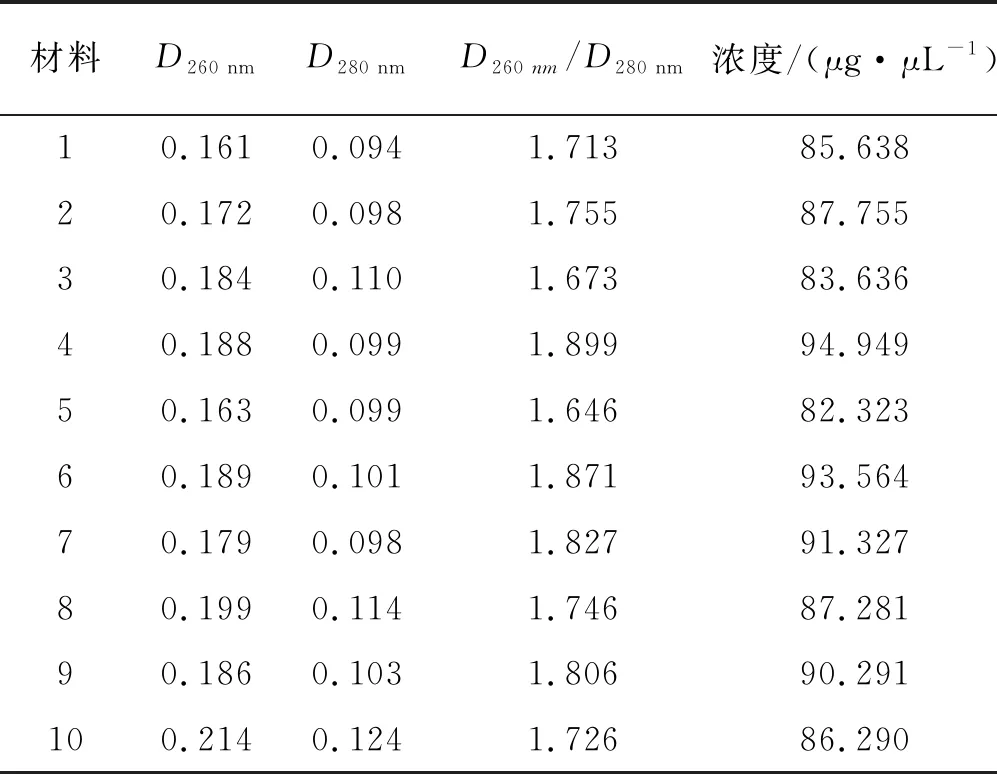
表2 胡枝子DNA样本纯度和浓度检侧
2.2 引物的筛选
利用优化的反应体系和反应条件,用合成的14对引物对胡枝子10个种进行扩增,从中筛选扩增条带清晰且呈多态性、重复性好、稳定性高的7对引物用于PCR扩增,引物的名称和序列见表3,其中2对引物来自山生柳,5对引物来自紫花苜蓿。表明引物在一定程度上具有通用性,通过PCR反应体系和反应条件的优化,能够获得可靠清晰的条带(图1,图2)。这些引物在胡枝子基因组扩增的条带清晰,重复性好,可用于胡枝子不同种质资源的遗传多样性检测。
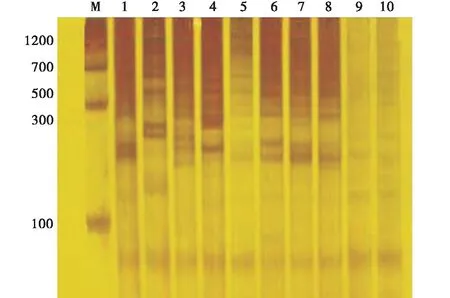
图2 引物ARG1扩增的10种胡枝子SSR电泳图谱
2.3 SSR扩增产物多态性分析
利用7对引物对10种胡枝子进行扩增,根据聚丙烯酰胺凝胶电泳检测到126个位点,其中有105个位点有多态性,等位基因座位最多的是ARG6引物,为24个位点,最少的是SHUK058引物,为12个位点。
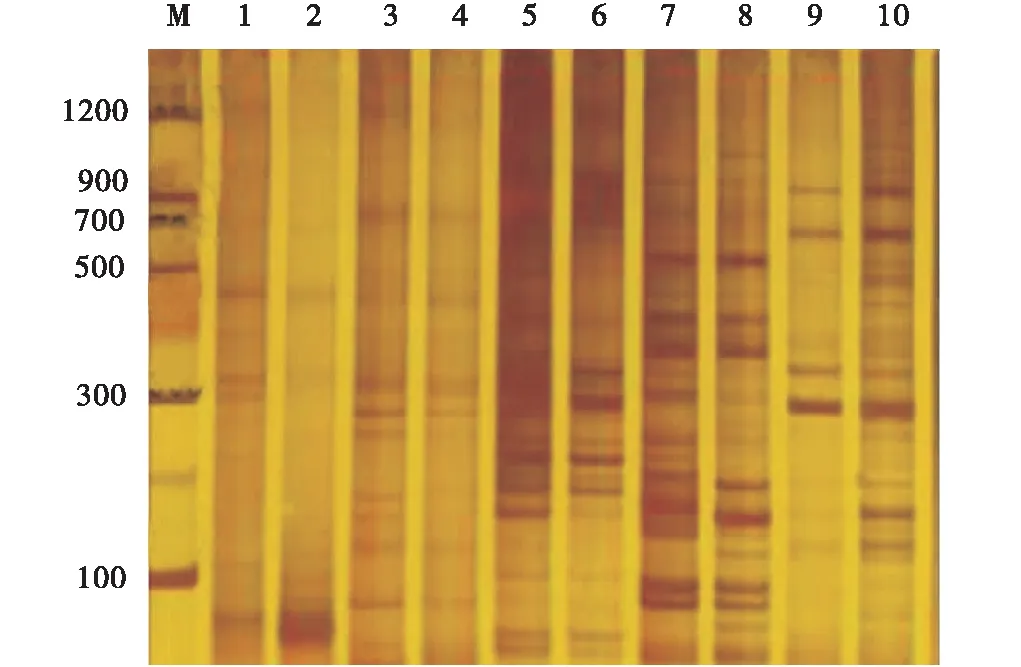
图3 引物SHUK058扩增的10种胡枝子SSR电泳图谱
本实验最终选用了7对SSR引物对胡枝子属不同物种进行PCR扩增,获得了105个SSR多态性位点,多态性达83%(表3)。表明胡枝子属不同物种的基因组SSR具有丰富的多态性。
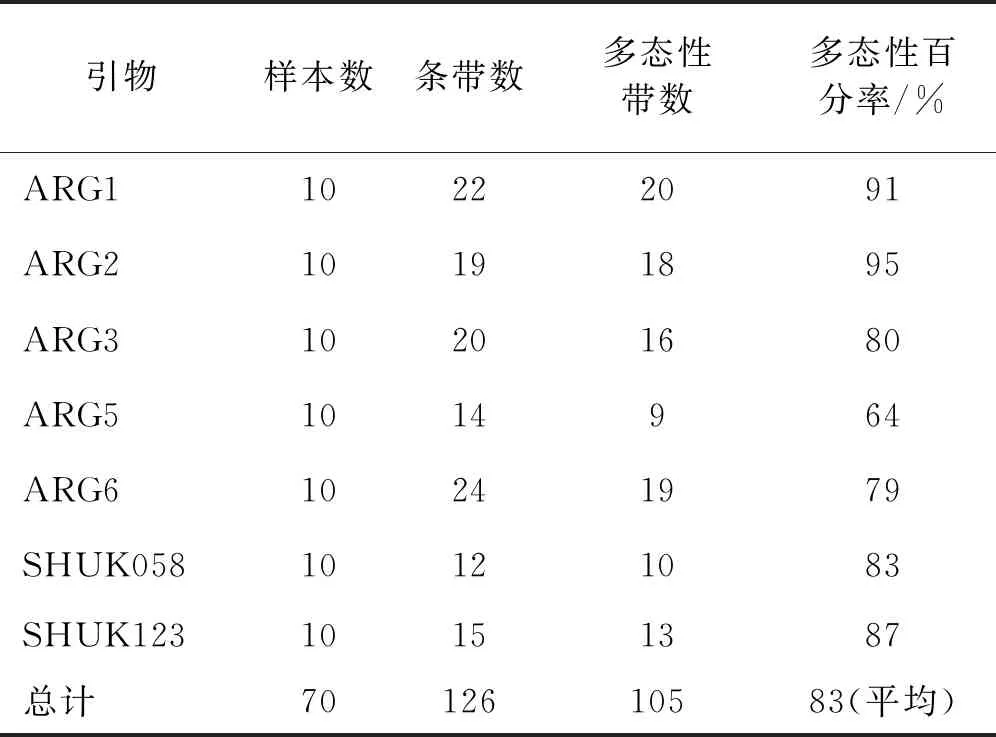
表3 筛选的7对SSR引物扩增PCR的位点数
从胡枝子不同种间的PCR扩增结果来看,SSR 多态性位点数和多态性百分率存在较大差异(表4)。多花胡枝子种内扩增到的多态位点最多,为111 个,截叶胡枝子仅扩增到89个多态位点。由此可见,SSR 标记所反映的遗传多态性在不同种间和同一种不同个体间都存在差异。多态位点百分数能够直观地反映出居群遗传多态性大小,因此从表4的结果能够初步比较出胡枝子属的10个种SSR 多态性差异大小。其中多花胡枝子的平均多态位点为111个,多态位点百分率为88.1%,截叶胡枝子的平均多态位点为89 个,多态位点百分率为70.6%。可见,多花胡枝子的遗传变异大于截叶胡枝子。
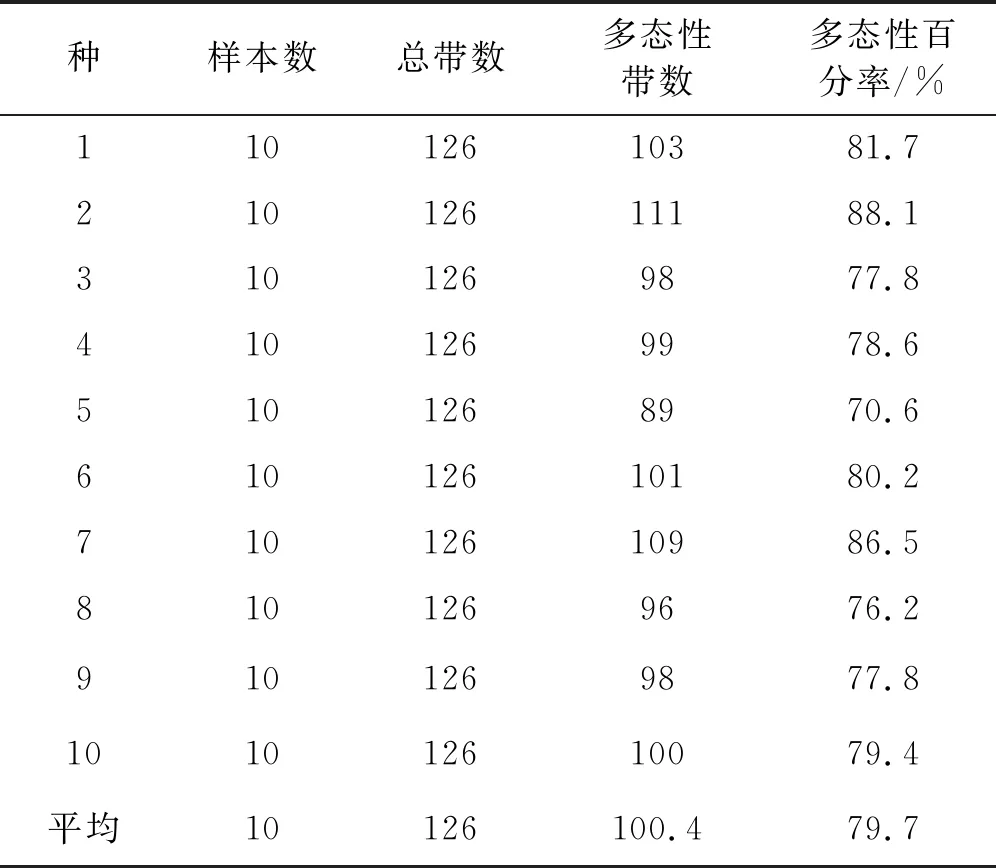
表4 不同胡枝子种SSR扩增产物的多态性比较
2.4 胡枝子属不同种间的杂合度和多态信息含量
7对引物平均等位基因数为1.79;平均有效等位基因数为1.51,其中引物SHUK123 所得的有效等位基因数最高,为1.66,引物SHUK058的最低,为1.29;平均杂合度为0.29,其中引物ARG1 所得的杂合度最高,为0.34,引物SHUK058的最低,为0.20;各引物的Shannon指数为0.33~0.51,平均为0.44,其中引物ARG1的最高(0.51),引物SHUK058的最低(0.33)(表5)。
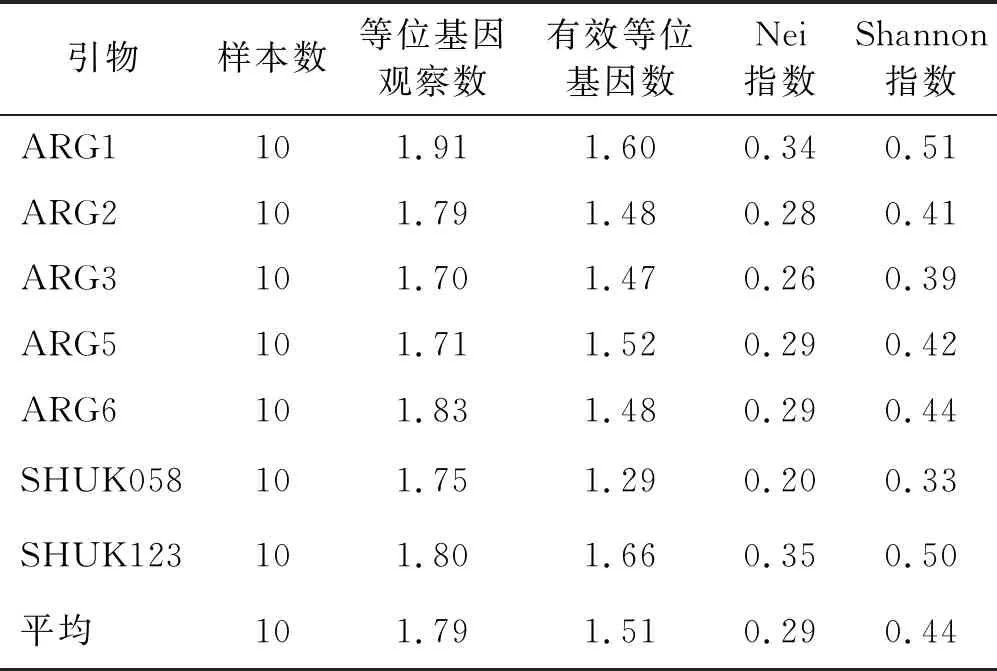
表5 7对SSR引物遗传多样性指标
2.5 胡枝子种的遗传距离与聚类分析
遗传距离和遗传相似系数是度量群体间遗传变异的指标,它们都是基因频率的函数,其中遗传相似系数表示群体间的相似程度。根据居群间SSR标记,计算居群间遗传相似系数,并根据其与遗传距离之和为1计算遗传距离。两个居群亲缘关系越近,其在所有位点上的等位基因频率就越近,遗传相似系数就越接近1;而两个亲缘关系越远的居群,在所有位点上的等位基因频率差别就越大,遗传相似系数就越接近0。2号和3号遗传相似系数最大,为0.761 9,7号和9号遗传相似系数最小,为0.563 5(表6)。遗传相似系数越大的,其遗传距离越小,亲缘关系也就越近;反之,遗传相似系数越小,其遗传距离越大,亲缘关系也越远。7号和9号遗传距离最大,为0.573 6(表6)。
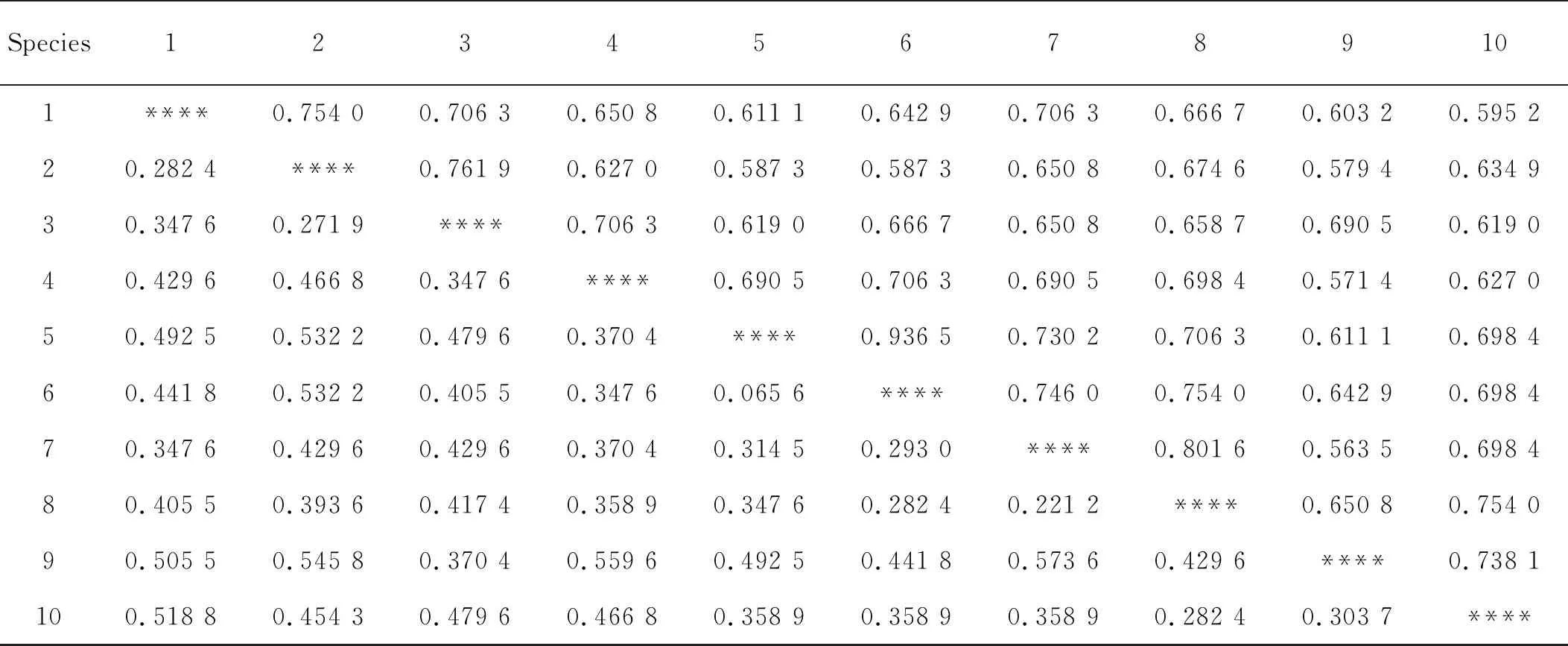
表6 甘肃胡枝子种间遗传一致度和遗传距离
聚类分析是以数学方法为基础,描述种间关系的一种具体而形象的分析手段。在微卫星多态性分析中常用等位基因频率进行聚类分析。本实验采用了非加权平均聚类法(UPGMA)进行聚类(图4)。胡枝子属10个种大体分为3类群,多花胡枝子首先和美丽胡枝子相聚,再与阴山胡枝子相聚,可归为一类群。截叶胡枝子和尖叶胡枝子聚类;达乌胡枝子和牛枝子聚类;这两者在聚类后和绒毛胡枝子相聚为第2类群, 二色胡枝子和细梗胡枝子聚为第3类群。
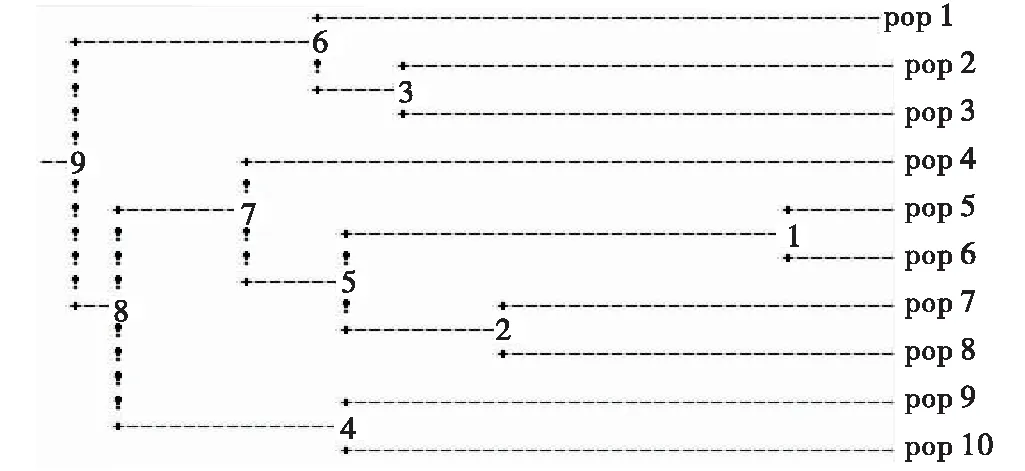
图4 甘肃10个胡枝子种的遗传聚类图
3 讨论
3.1 SSR标记引物的选择
目前多数使用PRIMER 0.5软件(Whitehead Institute,Camridage,MA02142)设计引物,主要参数因不同作物和SSR类型而异。一般为:引物长度18~30 bp,产物的长度为80~300 bp,PCR反应的退火温度为40~60℃。引物3’端有1-2G/C核苷酸,单个引物少于3个核苷酸的互补,2个引物之间少于连续3个核苷酸的配对,以防止PCR引物形成二聚物及发夹结构而影响扩增物的产量。但是,SSR标记的引物数量少,开发成本很高。国内外的研究发现,从十字花科拟南芥属发展的SSR引物可用于近缘类群,表明SSR标记位点可能在属内种间,甚至在科内属间是保守的[26]。本实验选用了紫花苜蓿10对引物和山生柳的4对引物对胡枝子基因组DNA进行PCR扩增。且筛选出的5对来自紫花苜蓿和2对来自柳树的引物都可以从胡枝子基因组DNA中扩增出DNA片段,占全部引物的50%。这表明引物在一定程度上具有通用性,通过PCR反应体系和反应条件的优化,能够获得可靠清晰的条带。这些引物在胡枝子基因组扩增的条带清晰,重复性好,可用于胡枝子不同种质资源的遗传多样性检测[27-28]。
3.2 胡枝子属不同种之间的亲缘关系
赵杨等[28]对胡枝子的聚类分析发现,9种胡枝子中,二色胡枝子和美丽胡枝子先聚然后再与短便胡枝子聚为一组;胡枝子组的达乌里胡枝子和牛枝子先聚在一起然后再与阴山胡枝子、截叶胡枝子聚为一组;多花胡枝子和短叶胡枝子先聚为一组然后再与前两组聚在一起,多花胡枝子没有完全像传统的形态分类那样,和胡枝子组的相近种聚到一起,而是独立出来的。而在骈瑞琪[29]的报道中这10种胡枝子可分为3大类,第1类包括截叶胡枝子和绒毛胡枝子,阴山胡枝子和牛枝子先聚到一起,然后再与多花胡枝子聚为一类,其余的5种胡枝子聚为一类。这与本研究结果不一致,本研究将甘肃省10种胡枝子大体分为3类群,多花胡枝子首先和美丽胡枝子相聚,再与阴山胡枝子相聚,可归为一类群。截叶胡枝子和尖叶胡枝子聚类;达乌里胡枝子和牛枝子聚类;这两者在聚类后和绒毛胡枝子相聚为第2类群,二色胡枝子和细梗胡枝子聚为第3类群。与前二者研究中聚类差异较大的是阴山胡枝子、多花胡枝子及绒毛胡枝子的聚类,产生这种差异的原因可能是不同研究者所选的引物及采样差异造成,需要进一步进行分析,来确定胡枝子属植物的亲缘关系,为胡枝子属植物野生资源的保护、分类、杂交育种等提供科学的理论依据。
4 结论
选用7对SSR引物对胡枝子进行了PCR扩增,获得105个SSR多态性位点,多态性达83%。引物平均等位基因数为1.91;平均有效等位基因数为1.51,各引物的Shannon指数(I)的多态性在0.33~0.51,平均为0.44。从胡枝子不同种间的PCR扩增结果来看,SSR多态性位点数和多态性百分率存在较大差异。甘肃省胡枝子属植物大体可分为3类群,多花胡枝子首先和美丽胡枝子相聚,再与阴山胡枝子相聚,可归为一类群。截叶胡枝子和尖叶胡枝子聚类;达乌胡枝子和牛枝子聚类;这两者在聚类后和绒毛胡枝子相聚为第2类群,二色胡枝子和细梗胡枝子聚为第3类群。
