宫颈小细胞神经内分泌癌合并宫颈子宫内膜样腺癌1例
2021-07-24康馥莉
谭 爽,康馥莉
(大连医科大学附属第二医院 妇产科, 辽宁 大连 116011)
1 临床资料
患者,女,36岁,以“阴道淋漓流血2个月,发现宫颈病变1个月”为主诉于2019年9月2日入大连医科大学附属第二医院妇科二病房。患者平素月经规律,2个月前无明显诱因出现阴道流血,量少,淋漓不尽持续半个月,后口服止血药治疗后阴道流血停止。1个月前于我院门诊行宫颈癌筛查,提示:TCT为宫颈高级别上皮内瘤变,倾向腺上皮来源;HPV为高危18型阳性。遂于我院门诊行阴道镜检查+宫颈活检术+宫颈管搔刮术。术后病理提示:(3、6、12点及宫颈管搔刮物)小细胞恶性肿瘤,建议做免疫组化进一步明确分类。入院诊断:“宫颈恶性肿瘤Ⅰb1期”。入院后查体:T:37 ℃,P:92次/min,R:16次/min,Bp:118/83 mmHg,锁骨上淋巴结未触及肿大,心肺听诊无明显异常,肝脾未触及。妇科检查:外阴及阴道正常,宫颈常大,表面光滑,子宫前位,常大,无压痛,双侧附件区未及明显异常。三合诊:双侧主骶韧带无缩短、增厚及硬结。辅助检查:阴道彩超提示:子宫大小形态正常,宫颈下段宫颈管内见低回声,低回声大小1.8 cm×1.4 cm,形态欠规则,回声欠均匀,内部可见血流信号。诊断为宫颈管内实性肿物。见图1。盆腔磁共振提示:宫颈可见结节状异常信号,大小约16 mm×12 mm,T1WI呈等信号,T2WI呈稍高信号,DWI呈高信号,增强后呈明显不均匀强化,未侵及阴道。见图2。诊断为宫颈异常信号,考虑宫颈癌可能,病灶未侵及阴道。胸部及上下腹CT未见异常。肿瘤标记物SCC及NSE未见异常。患者完善相关术前检查,排除手术禁忌,于2019年9月10日于全麻下行膀胱镜下双侧输尿管插管术+经腹广泛性全子宫切除术+双附件切除术+盆腔淋巴结清扫术。
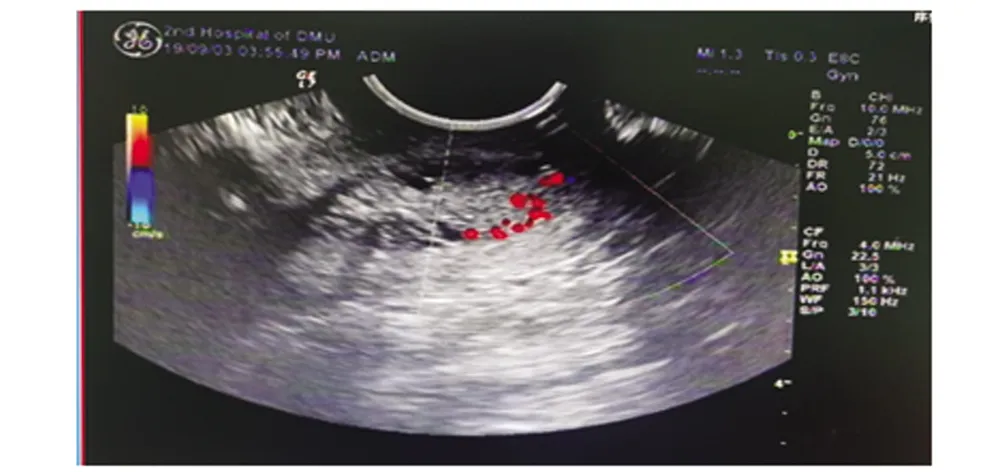
图1 宫颈管内低回声,可见血流信号Fig.1 Intracervical hypoechoic, visible blood flow signal
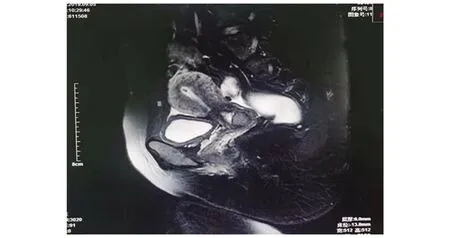
图2 磁共振提示宫颈可见结节状异常信号,大小约16 mm×12 mmFig.2 Magnetic resonance examination suggested that the cervix showed nodular abnormal signal, the size of it is about 16 mm×12 mm
术后病理提示:宫颈小细胞恶性肿瘤(图3)。免疫组化:癌细胞p40(-),AE1/AE3(+),p16(+),CgA(+),Syn(+),Ki-67(80%+)。结合免疫组化染色结果,符合小细胞神经内分泌癌。宫颈管符合宫颈腺癌(Ⅰ级,子宫内膜样腺癌)。癌组织浸润深度约1.2 cm(>1/2宫颈壁厚度),未见脉管内癌栓及神经侵犯,肿瘤未累及宫颈内口及阴道断端,分泌状态子宫内膜。双侧宫旁组织内未见恶性病变。淋巴结内未见癌转移。最终诊断:宫颈小细胞神经内分泌癌合并宫颈子宫内膜样腺癌Ⅰb1期。患者术后无发热、腹痛、腹胀、阴道流血等不适,生命体征平稳,心肺听诊正常,双下肢无水肿。遵医嘱带尿管出院。2019年9月26日返院拔除尿管,排尿顺利。2019年10月23日开始于我院肿瘤放疗科行第一次EP方案化疗,2019年11月19日行第二次EP方案化疗。后嘱门诊复查,2020年3月14日行全身PET-CT检查,未见明显异常。随诊至2021年3月20日,状态良好,无肿瘤复发迹象。
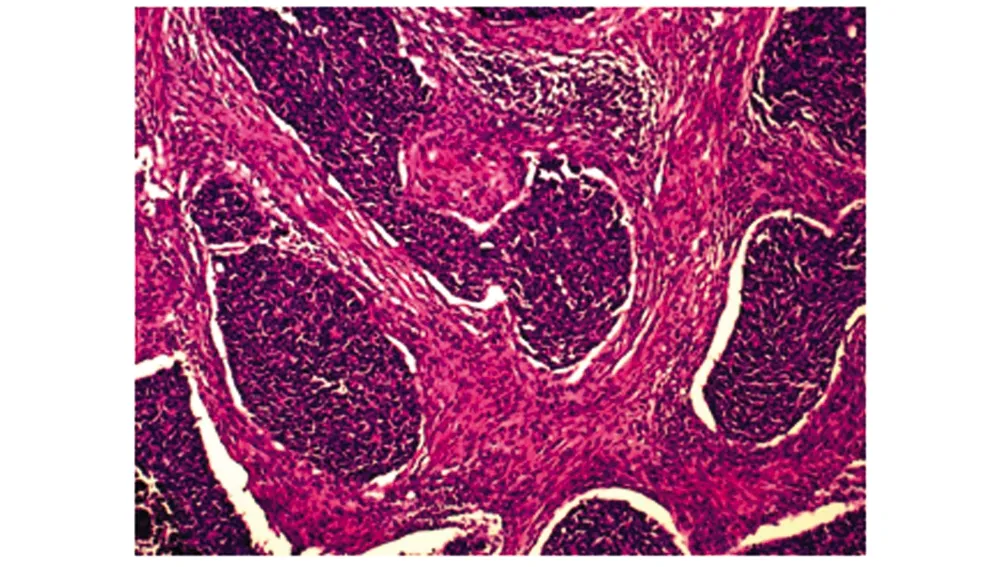
图3 宫颈小细胞恶性肿瘤(HE ×200)Fig.3 Small cell malignant tumor of the cervix(HE ×200)
2 讨 论
子宫颈神经内分泌癌(neuroendocrine tumors of the cervix)是一种罕见的发生于女性生殖道的肿瘤,其原发部位以宫颈最为常见[1]。它起源于神经内分泌细胞,2014年世界卫生组织将它分为低级别(类癌、非典型类癌)和高级别神经内分泌癌(大细胞神经内分泌癌、小细胞神经内分泌癌)[2]。本例患者即属于小细胞神经内分泌癌。近年来,宫颈癌不断呈现年轻化趋势,本例患者年仅36岁,且病理为混合癌,具有特殊性,值得关注。
宫颈鳞状细胞癌、腺癌、腺鳞癌的发病与宫颈HPV病毒感染密切相关[3]。越来越多的研究表明,宫颈神经内分泌癌可能也与人乳头瘤病毒(HPV),特别是HPV16、18相关。Castle等[4]曾对41项研究进行了meta分析,包括403个小细胞神经内分泌癌和45个大细胞神经内分泌癌患者,研究发现85%的小细胞神经内分泌癌以及88%的大细胞神经内分泌癌均是HPV阳性(HPV16和/或HPV18)。Alejo等[5]对49例宫颈神经内分泌肿瘤中HPV DNA检测、基因型分布及其与组织学、免疫组化特征的关系进行分析,发现86%的神经内分泌癌中含有HPV DNA。98%的病例报告为单一感染(1种HPV型),55%的神经内分泌癌中发现HPV16, 41%的神经内分泌癌中发现HPV18, 4%的神经内分泌癌为其他HPV类型阳性。HPV18在神经内分泌癌中的发生率(41%)是其他类型肿瘤(10%)的4倍(P<0.001)。神经内分泌癌表现出明显的淋巴转移特性,这也是HPV18相关肿瘤特有的特征[6]。本例患者宫颈小细胞神经内分泌癌合并宫颈子宫内膜样腺癌,HPV18阳性,符合以上研究特点。
宫颈小细胞癌主要临床表现为不规则阴道流血或接触性出血,有患者表现为阴道排液。本例患者表现为不规则阴道流血,符合基本特征。它在生物学行为方面与肺小细胞癌有许多共同之处[7],侵袭性强,早期容易发生淋巴转移和血行转移。与宫颈鳞癌及腺癌相比,预后更差。
盆腔磁共振成像(MRI)被认为是对>10 mm的肿瘤最好的成像方法,便于评估肿瘤大小和疾病的局部扩展[1]。对于肿瘤早期的女性,进行盆腔MRI检查,可以帮助我们判断患者是否适合手术治疗。另一检查手段是经直肠超声检查,它对小肿瘤(1 cm)[8]的检测优于MRI (90.5% vs. 81.1%,P<0.05)[9]。病理方面以组织形态学诊断为主,在组织形态上,肿瘤细胞小而一致,多呈卵圆形或纺锤形,细胞浆很少,核染色质深且不规则,核分裂象多见。多呈弥漫性生长方式,局部区域可呈巢状排列,肿瘤组织内坏死较常见[10]。免疫组化染色常用于神经内分泌癌的诊断,它可以提高诊断的准确率。最常用的神经内分泌染色是嗜铬粒蛋白A、突触素、CD56和神经细胞特异性烯醇酶。对于大细胞神经内分泌癌,除了苏木精和伊红染色的形态学外,嗜铬粒蛋白A是帮助确诊的最特异标记。INSM1可能比嗜铬粒蛋白A或突触素对神经内分泌肿瘤更有特异性[1,11]。本例患者免疫组化即提示嗜铬粒蛋白A阳性、突触素阳性。分子特征方面,3号染色体短臂缺失(3p)和罕见的3号染色体短臂的2区1带(3p21)缺失可用于诊断复发的宫颈小细胞癌[12]。此外,Frumovitz M等[13]对24例宫颈小细胞癌患者通过突变热点测序进行癌症相关基因突变分析,发现24例患者中21例(88%)出现至少一次类生物制剂的靶向突变,最常见的突变基因位点是PIK3CA(磷脂酰肌醇3激酶催化亚基,8例),KRAS(鼠类肉瘤病毒癌基因,6例)和TP53(5例)。
目前宫颈小细胞癌的治疗多采用手术联合术后放化疗,以铂类为基础的化学治疗无论作为手术后化疗还是新辅助化疗都能明显改善宫颈小细胞癌患者的生存率。化疗方案包括EP方案和CPT-P方案。有研究表明,对于Ⅰ~Ⅱ期的患者接受放射治疗后的生存率甚至要高于接受手术治疗的患者[14]。2019年一项针对宫颈小细胞癌的多中心研究表明,患者在早期和晚期的总体存活率存在统计学差异。早期组的5年无病存活率为52.7%,而晚期组为32.4%(P=0.022)。对于可能影响整体生存的其他因素,如年龄、肿瘤大小、浸润深度、淋巴结转移和治疗方式等均无统计学差异[15]。本例患者术后诊断为宫颈小细胞癌合并子宫内膜样腺癌Ⅰb1期,术后于放疗科继续行EP方案化疗2个周期后随诊至今,状态良好。患者未行进一步放疗,术后PFS及OS值得继续关注。另外,对于复发和转移患者,及早进行基因检测也可能发现潜在的有效的治疗药物。宫颈小细胞癌的分子谱分析揭示了许多靶向突变,例如PIK3CA和KRAS突变,提示应用磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)或RAS/RAF/MEK通路抑制剂可以治疗宫颈小细胞癌,许多相关研究处于Ⅱ期和Ⅲ期临床试验中。
