18例垂体细胞瘤的临床病理特点分析
2021-07-24石玲玲张清富高小卓
杨 虹,蒋 冰,刘 骞,石玲玲,黄 波,张清富, 高小卓
(1.沈阳市第十人民医院 病理科,辽宁 沈阳 110001;2.中国医科大学肿瘤医院(辽宁省肿瘤医院) 病理科,辽宁 沈阳 110042; 3.中国医科大学附属第一医院 病理科,辽宁 沈阳 110000)
垂体细胞瘤(pituicytoma)是发生在鞍内或鞍上区的少见肿瘤,因来源不清,曾被命名为漏斗瘤、粒细胞性成肌细胞瘤、迷芽瘤、毛状星形细胞瘤等[1]。2016年WHO中枢神经系统分类中归属于神经垂体分化的低级别神经胶质细胞肿瘤,也因表达NKX2-1基因编码的甲状腺核转录因子-1(TTF-1)蛋白,成为基底前脑相关肿瘤谱系成员之一[2]。此类肿瘤发病率低,又需要与TTF-1表达的包括转移性肿瘤在内的其他肿瘤相鉴别,尽管属于低级别惰性肿瘤范围,依旧困扰着临床与病理医生对此肿瘤的认知,很可能成为病理诊断中的陷阱和临床治疗中的盲区。本文收集18例垂体细胞瘤,并对其临床病理因素等进行总结分析,以提高对这一少见肿瘤的认知。
1 资料与方法
1.1 病例来源
收集中国医科大学附属第一医院和中国医科大学附属肿瘤医院(辽宁省肿瘤医院)2006年1月至2020年12月明确病理诊断为垂体细胞瘤18例,男女各9例,年龄11~69岁,中位年龄44岁。所有患者以神经系统的头晕、头痛、视力模糊为主要症状表现,可有乏力,血清学泌乳素轻度增高,仅1例(1/18)伴有Cushing综合征,女性患者可有月经紊乱。肿瘤均位于鞍区,鞍内或鞍上。CT或MRI影像学均显示蝶鞍区扩大,鞍区内或鞍上局限性界限较清楚占位性病变。临床检查中未见其他器官占位病变,全部收集病例已排除转移性病变。所有患者均接受外科手术治疗,术式为蝶鞍切除术,术后所有患者均未进行放疗或化疗。见图1~2,表1。
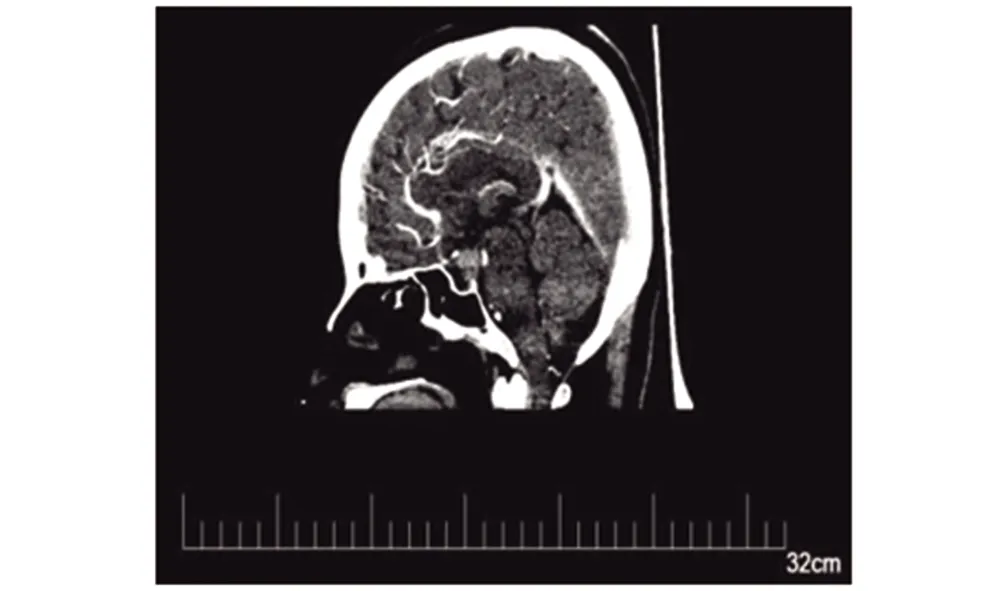
图1 CT鞍上类圆形稍高密度肿物,大小约10 mmFig.1 CT saddle-like circular high-density mass about 10 mm in size

图2 CT增强后强化明显Fig.2 The enhancement after CT enhancement is obvious
1.2 方法与结果判读
手术标本离体30 min内即经4%中性甲醛液固定24 h,石蜡包埋,4 μm厚切片,常规苏木素-伊红染色(HE)染色。先行组织病理学诊断重新评估筛选,再行免疫组织化学EnVision法染色协助诊断,一抗及二抗等均购自福州迈新生物技术开发公司的即用型工作液,常规高压抗原修复。
操作按试剂盒说明书进行:CK(阳性定位于细胞质),EMA(阳性定位于细胞质),Vim(阳性定位于细胞质),S-100(阳性定位于细胞质与核),GFAP(阳性定位于细胞质),TTF-1(阳性定位于细胞核),CD56(阳性定位于细胞膜),Syn(阳性定位于细胞质),CgA(阳性定位于细胞质),Ki-67(阳性定位于细胞核),计算阳性细胞百分率以及阳性强度。阳性判读标准:定位处棕黄色颗粒,且着色强度高于背景。深褐色颗粒、棕黄色颗粒、浅黄色颗粒分别为强阳性、中度阳性和弱阳性表达;阳性细胞百分率<5%为局灶阳性,<20%为局部阳性,<50%为部分阳性,Ki-67指数1%弱阳性即判读为阳性[1]。
2 结 果
2.1 病理特征
肿瘤大体所见:手术标本为破碎标本,体积较小,最大者体积最大径4.0 cm,最小者体积最大径0.3 cm,质地软,灰白色。见表1。
病理组织形态学:所有病例呈现为弥漫性结构,纤维束状或席纹状、漩涡状紧密排列,肿瘤细胞大小较一致,单一性明显,为梭形双极性、卵圆形或者多边形,边界不清,胞浆红染嗜酸性,细胞核中等大小,核为梭形、圆形、卵圆形,小核仁或未见核仁,缺乏异型性,或轻度异型性,本组未见核分裂,间质小血管丰富,无坏死与血管增生,无淋巴浆细胞浸润,无黏液变性,无Rosenthal纤维。见图3和4。
2.2 免疫表型
TTF-1(18/18)、Vim(18/18)、S-100(18/18)弥漫性阳性,GFAP(18/18)弱阳性为主,少数中等阳性,非弥漫性、灶状表达模式;EMA(18/18)中等阳性,定位于胞质,灶状模式;CK、CD56、Syn、CgA均为阴性表达(0/18);Ki-67表达增殖指数,1%~5%,3例(3/18)增殖指数为5%,均为成人,2例女性(体积最大径0.6 cm),1例男性(体积最大径3.0 cm)。见表2及图5。
3 讨 论
垂体细胞瘤的起源一直是认识这一肿瘤的焦肿瘤大小以肿瘤体积最大径表示点,对其超微结构的研究加深了对其认识。根据超微结构特点发现亮细胞、暗细胞、颗粒细胞、嗜酸性细胞、室管膜样细胞5个超微结构变异的亚型组成了垂体细胞形态学特点,奠定了垂体细胞瘤起源的有力形态学证据[2]。垂体细胞的功能性研究又对垂体细胞瘤的起源进一步补充明确,认为垂体细胞是一种功能特异的胶质细胞,是神经垂体有核细胞的主体,等效为神经垂体中的星形胶质细胞,支持和滋养下丘脑分泌神经元的末梢轴突。垂体细胞也存在于神经垂体的血管周围壁龛中,参与调节下丘脑激素的释放[3]。Brat等[4]尽管仅在9个病例基础上阐述了垂体细胞瘤起源于垂体细胞中的主细胞、暗细胞或其前体细胞3个超微结构亚型,首次以垂体细胞瘤命名并报道。随后,垂体细胞的分子研究更是为垂体细胞瘤的来源以及衍生的诊断问题获得了坚实的证据。分子研究认为垂体细胞瘤中的肿瘤细胞与垂体细胞同样具有双极纺锤形细胞形态,表达由NKX2-1基因编码的TTF-1[5],明确了瘤细胞核表达TTF-1的垂体细胞瘤是由垂体细胞转化引起。至此,垂体细胞瘤这一诊断术语仅限制于此类肿瘤,有别于毛细胞星形细胞瘤、颗粒细胞瘤、垂体腺瘤。2016年更新的世界卫生组织分类中更是将垂体细胞瘤明确定义为一种局限的、一般为实性的低级别胶质肿瘤,起源于神经垂体或漏斗部,由排列成束状或成层状的双极纺锤形细胞组成,WHOⅠ级。
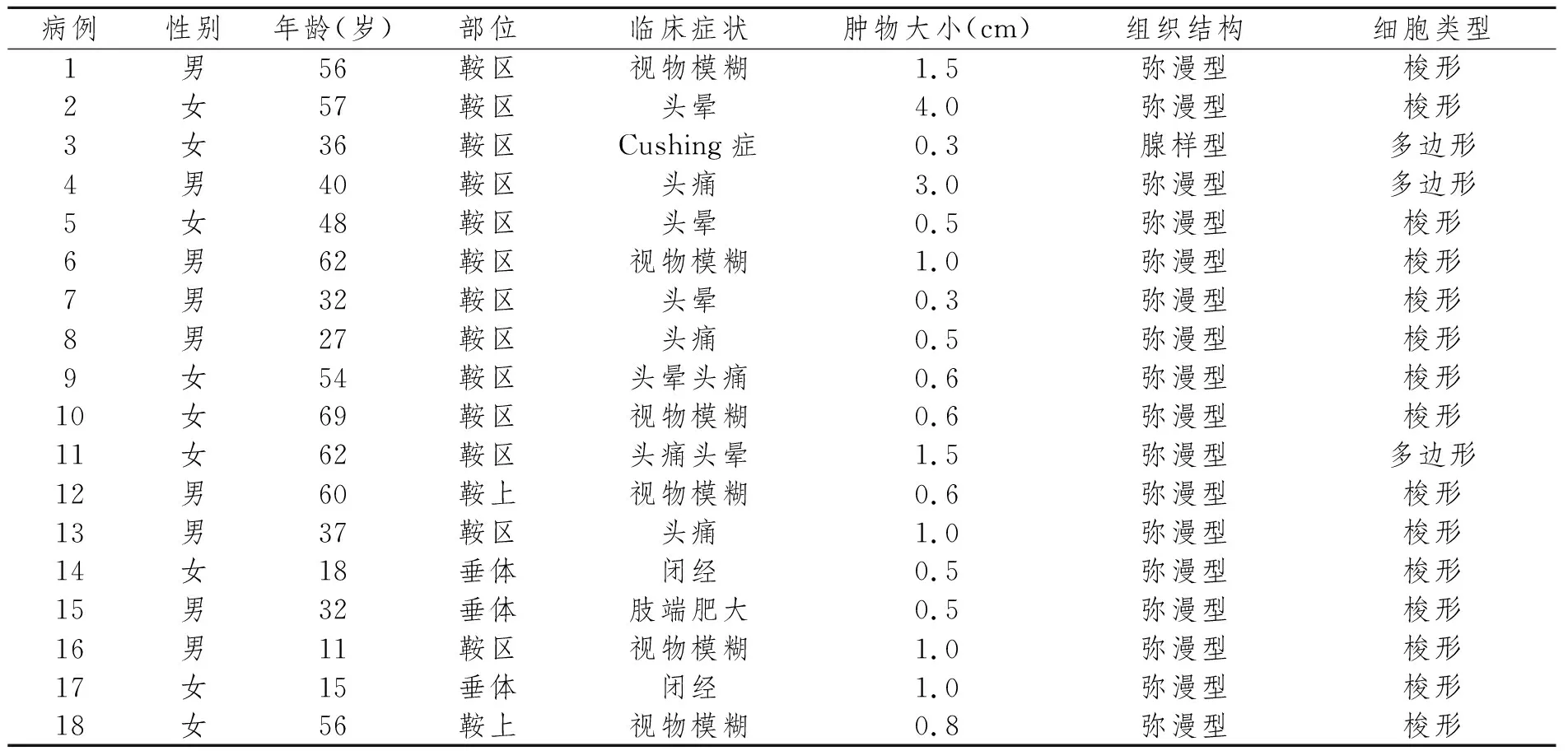
表1 18例垂体细胞瘤患者临床病理资料总结
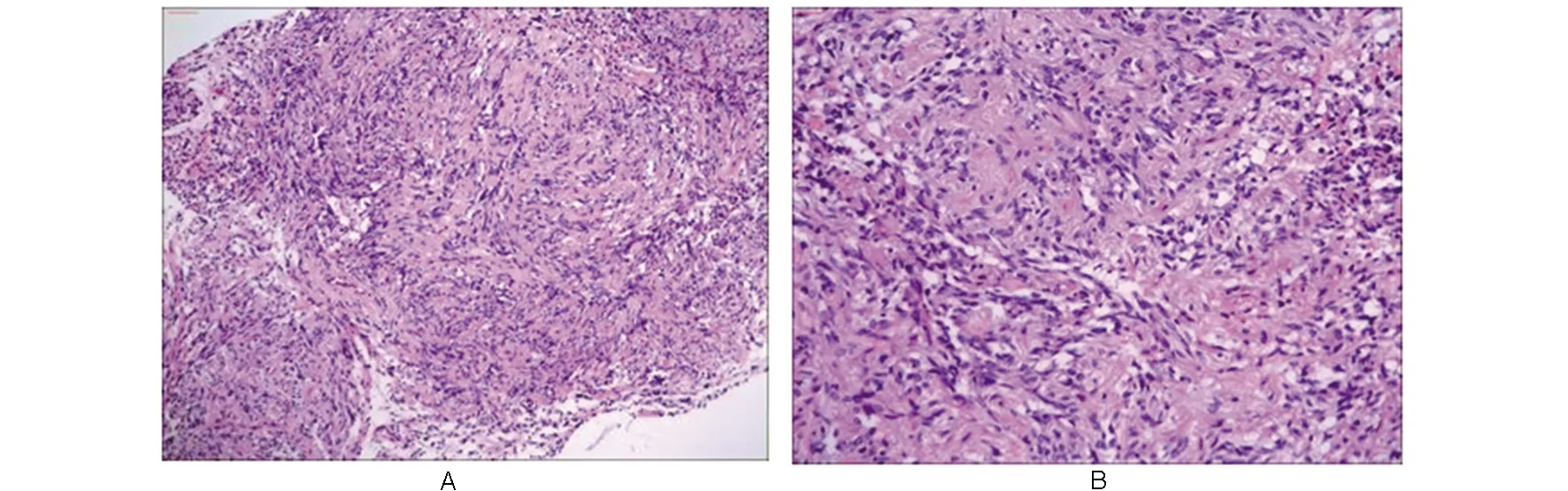
A:HE ×40;B:HE ×100图3 肿瘤呈弥漫状、旋涡状、束状分布,间质血管丰富 Fig.3 The tumor is distributed in diffuse, vortex, and bundle, with abundant interstitial blood vessels
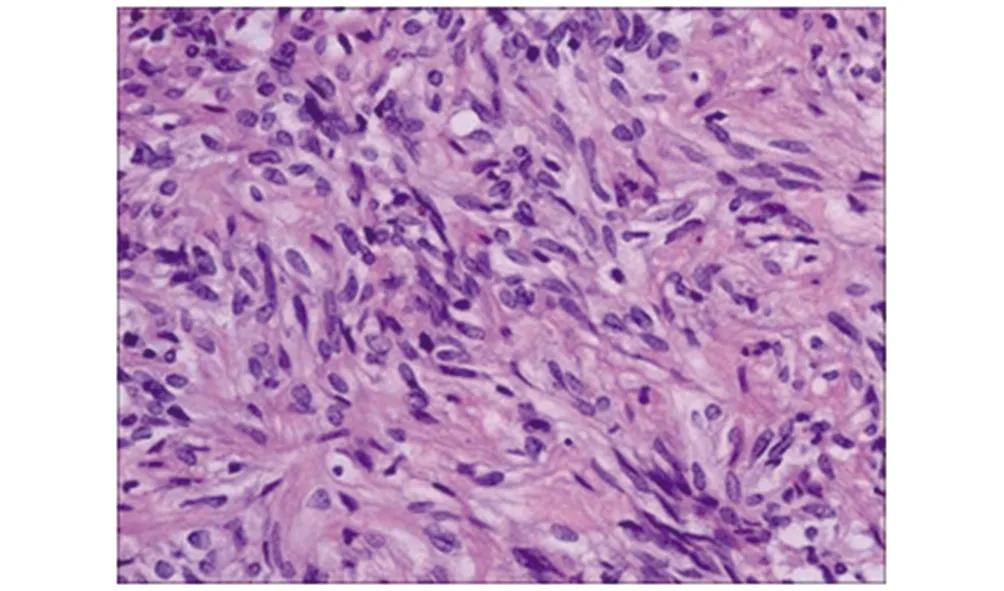
图4 瘤细胞梭形双极性,卵圆形或者多边形,边界不清,胞浆红染嗜酸性,细胞核梭形、圆形、卵圆形,中等大小,小核仁或核仁不清,缺乏异型性,或轻度异型性(HE×400)Fig.4 Tumor cells are spindle-shaped bipolar, oval or polygonal, with unclear borders, cytoplasm is red-stained with eosinophilia, nuclei are spindle-shaped, round, oval, medium size, small nucleoli or nuclei unclear benevolence, lack of atypia, or mild atypia(HE×400)
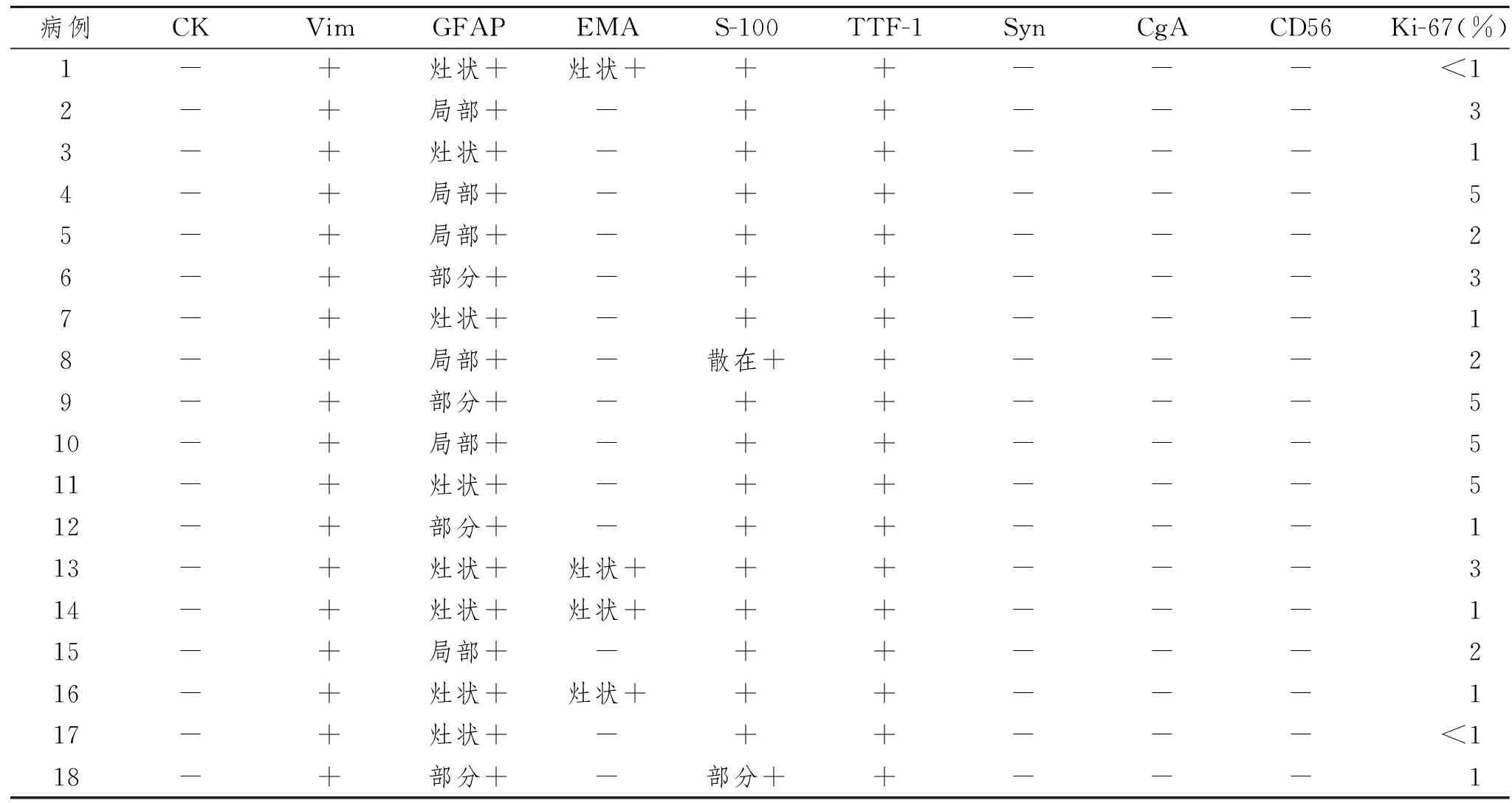
表2 18例垂体细胞瘤的免疫表型总结
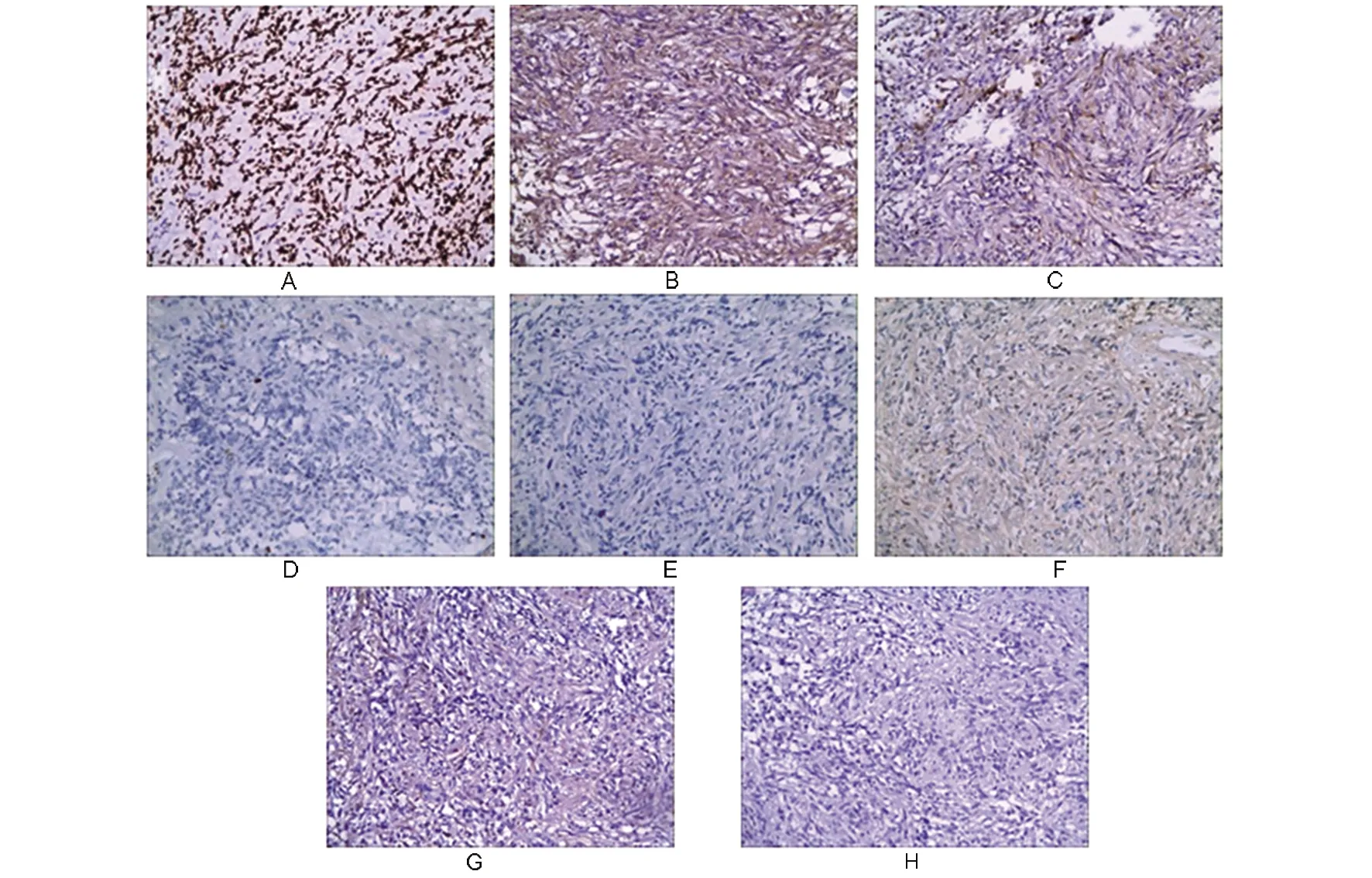
A: TTF-1弥漫性细胞核强阳性; B: Vim弥漫胞浆阳性; C: EMA灶状胞浆和膜阳性;D: Ki-67增殖指数<1%; E: CK阴性; F: S-100弥漫性胞浆阳性; G: GFAP斑片状胞浆阳性; H: Syn阴性图5 各指标免疫组化结果(EnVision两步法×100)Fig.5 Immunohistochemical results of each index (EnVision ×100)
因为垂体细胞瘤的病理诊断更依赖于免疫表型或分子病理,本文首先对收集的18例肿瘤进行免疫表型分析。本文18个病例均表达TTF-1,呈现弥漫性核表达模式,S-100与Vim弥漫性强阳性表达,GFAP为弱-中阳性表达,EMA呈现灶状胞质内表达,神经内分泌标记均为阴性表达,Ki-67增殖指数低,1%~5%,明确肿瘤细胞起源于基底前脑,符合垂体细胞瘤的诊断标准,免疫表型与文献报道基本一致[6-8]。循证医学文献中Ki-67增殖指数最高为4%[7],肿瘤体积在1.0~3.0 cm,与其他7例比较无体积的正相关性,而既往文献报道的复发病例Ki-67为1%,也没有表现出增殖指数与生物学行为的关系,多数报道Ki-67与本文结果一致,<2%,属于惰性肿瘤,与体积、年龄、性别、复发性生物学行为未见相关性趋势。免疫表型的研究中也有文献报道Bcl-2,ER,PR,Galectin-3不同程度的阳性表达[9],因其表达缺乏特异性本组病例并未检测,笔者认为可以做为与其他肿瘤鉴别诊断的补充指标。本例垂体激素均为阴性表达(未列出)。综上所述,与文献报道以及诊断标准一致的TTF-1、S-100、Vim弥漫表达为垂体细胞瘤的主要免疫表型。
病理组织形态中本组18个病例均较典型,未见核分裂,未见异型性。复习文献中发现垂体细胞瘤同样具有异质性,尤其是形态学的异质性更为显著,个案报道不断涌现。国内作者报道1例假腺样结构的上皮样垂体细胞瘤,50%的肿瘤呈现腺样或者裂隙结构,瘤细胞立方形或者上皮样[10],免疫表型符合垂体细胞瘤,增殖指数与经典型无差异,<2%,并未导致生物学行为的改变。另1例为室管膜亚型的垂体细胞瘤,国内外均有研究报道[11-14]。文献中阐述形态学除经典型结构外,也有围血管的乳头状结构,菊形团结构,呈现室管膜肿瘤的形态学特点,范围达到50%,并且与经典型之间有移行,免疫表型符合经典型垂体细胞瘤表达模式,唯有EMA表现为胞质点状阳性的室管膜细胞的表达方式,电镜研究也证实为室管膜分化特点,认为是起源于垂体细胞中的室管膜样细胞,特殊亚型的发现扩大和补充垂体细胞瘤的谱系。由此,我们总结垂体细胞瘤的形态学结构特点(1)梭形细胞弥漫性束状;(2)上皮样细胞假腺样或裂隙状;(3)围血管乳头状、菊形团状室管膜样结构。当然,上述这些结构并非为垂体细胞瘤的唯一特点,往往是神经系统肿瘤的普遍现象,因此可能成为病理诊断中的陷阱,需要结合前述的免疫表型进行诊断。本组病例均为经典的梭形细胞型,未见特殊亚型的形态学结构。我们有理由推测随着免疫表型与分子研究成果的不断明晰,垂体细胞瘤的谱系会更为广泛,当然也会可能让鉴别诊断更具挑战。
目前,垂体细胞瘤因为TTF-1阳性,提高了免疫表型的诊断与鉴别诊断价值,鉴别诊断主要依赖于病理学的依据。TTF-1属于NKX2转录基因家族的成员之一,分子量为40 kD,是重要的转录因子,表达于Ⅱ型肺泡上皮细胞、甲状腺滤泡上皮以及相关肿瘤,而在颅咽管瘤、室管膜瘤、脑膜瘤、毛细胞星形细胞瘤中为阴性表达,TTF-1的这种器官部位及其肿瘤的特异性差异表达,为垂体细胞瘤的鉴别诊断提供了很大的帮助,也是近年来这一肿瘤报道增多的原因之一。垂体细胞瘤的鉴别诊断包括(1)非肿瘤性的神经垂体组织;(2)鞍区的颗粒细胞瘤;(3)梭形细胞嗜酸细胞瘤;(4)毛细胞星形细胞瘤;(5)纤维性脑膜瘤;(6)孤立性纤维性肿瘤;(7)神经鞘瘤;(8)梭形细胞垂体腺瘤;(9)囊性变时与垂体Rathle囊肿区分;(10)TTF-1阳性的转移性肿瘤等。TTF-1阳性可以排除非阳性肿瘤;非肿瘤性神经垂体组织往往因细胞密度小而可以排除;根据临床表现、相关部位检查与其他免疫表型的差异(如甲状腺的TG,PAX-8)可以区别肺和甲状腺来源的转移性肿瘤。这些鉴别诊断中最主要是与同为中枢神经系统肿瘤的TTF-1阳性的基底前脑相关肿瘤谱系成员鞍区颗粒细胞瘤与梭形细胞嗜酸细胞瘤的区分。这两种肿瘤曾经被认为是垂体细胞瘤的亚型[15]。鞍区颗粒细胞瘤中瘤细胞相对大,多角形,片状或簇状,胞质嗜酸性显著,含有明显颗粒状物,核仁不清或不见,PAS阳性。梭形细胞嗜酸细胞瘤梭形细胞与上皮样细胞束状排列,胞质嗜酸性,呈现细颗粒状,显著嗜酸性核仁是这一肿瘤突出特点,有异型性,PAS阴性。两类肿瘤的形态学特点鲜明,与垂体细胞瘤不同。而另一个中枢神经细胞TTF-1阳性的肿瘤为第三脑室脊索样胶质瘤,形态学呈现瘤细胞肥胖的上皮样胶质细胞,索状分布在黏液样基质中,伴有炎性细胞浸润,除形态学差异性可以鉴别外,发病部位的不同也是主要的鉴别点。
对垂体细胞瘤的认知除了病理特点外,临床特点也很重要。2011年的文献总结中已经报道这一肿瘤好发于40~60岁的成人型肿瘤,性别差异不显著,男女比例为18∶17[16]。随着诊断标准的明晰,国内文献中报道的最小年龄为4岁,18岁前也有报道[17]。本文最年轻发病年龄为11岁,18岁前发生3例,最年长69岁,30~60岁居多,中位年龄44岁。年轻病例不断被报道,说明垂体细胞瘤的发生具有广泛性。本文男女发病比例相当,与文献报道相似,说明垂体细胞瘤缺乏性别趋势。复习文献与本文病例可发现垂体细胞瘤发生的年龄、性别与病理组织学缺乏相关性,生物学行为相似,即使复发病例也与年龄性别无相关性。垂体细胞瘤的临床症状包括头晕、头痛、视物模糊、泌乳素轻度增高、女性有月经紊乱,个别病例伴有Cushing综合征如本文病例3、肢端肥大症如本文病例15,此时需要同梭形细胞垂体腺瘤鉴别,本文2例少见临床表现病例经血液生化指标、免疫组化等检查后排除了垂体腺瘤的诊断,最终诊断为垂体细胞瘤。复习文献也与本文病例一致。常见的临床表现相似于无功能性垂体腺瘤,与占位发生后垂体受压而引起的机体糖皮质激素分泌不足有关,或垂体功能发生改变与垂体功能代偿间平衡紊乱而引起相应症状有关。本研究垂体细胞瘤的发病部位集中在鞍内或鞍上部位,与复习文献一致。垂体细胞瘤影像学对鞍区占位性病变的定位诊断具有特异性的帮助,但功能成像等研究尚缺乏特征性征象,也有报道认为垂体细胞瘤增强迟发。目前影像学对垂体细胞瘤的诊断特异性不足,这与病例少见,肿瘤体积小有直接关系。
垂体细胞瘤治疗以手术干预为首选,文献中报道此肿瘤血运丰富,术中出血是主要特点,出血量可高达1 000 mL[14],文献中阐述术式选择的观点是避免出血过度,建议经过翼点入路或额外侧入路开颅手术,不建议从蝶窦入路开展术式。并发症中的低钠血症、尿崩症,提示临床在围手术期要注意监测并补充电解质。术后放化疗的报道鲜见,个别给予化疗干预,本文收集的18例病例未接受任何治疗。本组病例缺乏随访结果,这也是本文的遗憾,也是对此肿瘤深入研究的切入点,复习文献中个别存在复发现象,与肿瘤体积大、无法完整切除有直接关系。对于垂体细胞瘤的治疗仍需要多样本的随访后回顾性评估复发等不良生物学行为,与前瞻性的研究相结合。
本文以及文献复习已经明确垂体细胞瘤是起源于神经前体的低级别胶质肿瘤。由于其罕见性、解剖位置和临床特征的重叠,术前容易被误诊为垂体腺瘤。其病理学上的特征性纤维束状、梭形细胞形态和TTF-1的核免疫反应对诊断有帮助。因此要严格掌握诊断的病理形态学、免疫表型、分子病理的标准。虽然垂体细胞瘤是可以通过全切除有效治疗的WHO Ⅰ级肿瘤,但它们往往是富于血管的肿瘤,在手术切除时可能导致严重出血,鲜见复发。
