青花菜WRI4基因的克隆、生物信息学分析及表达载体的构建
2021-07-23高颖杨亚苓李慕紫贺丽霞李慧
高颖 杨亚苓 李慕紫 贺丽霞 李慧


摘要: AP2/ERF(APETALA2/ethylene-responsive factor)是一个庞大的转录因子超家族,其蛋白质中均含有1段或2段由60~70个氨基酸残基组成的结构域,该家族基因广泛存在于植物体内,在植物生长发育,生物及非生物胁迫响应,植物次级代谢中均发挥着重要的作用。本试验利用前期的青花菜转录组数据,采用RT-PCR 技术从青花菜中分离克隆WRI4基因,利用生物信息学分析软件对其进行基因结构及特征分析。结果表明,青花菜WRI4转录因子基因共编码308个氨基酸,WRI4具有2个AP2/ERF结构域,属于AP2/ERF家族成员。WRI4蛋白为亲水性蛋白,无跨膜结构,二级结构以无规则卷曲和α-螺旋,β-转角为主。氨基酸序列比对及进化树分析结果表明,青花菜WRI4转录因子与白菜、油菜相应的转录因子有较高的相似性。采用同源重组技术构建了WRI4过表达载体,为进一步深入探究该转录因子的功能,培育青花菜新品种奠定了基础。
关键词: 青花菜;WRI4;AP2/ERF;同源重组克隆
中图分类号: S635.3;Q785 文献标识码: A 文章编号: 1000-4440(2021)03-0710-08
Cloning, bioinformatic analysis and expression vector construction of broccoli WRI4 gene
GAO Ying1, YANG Ya-ling1, LI Mu-zi1, HE Li-xia2, LI Hui1
(1.College of Horticulture and Landscape Architecture, Tianjin Agricultural University, Tianjin 300384, China;2.College of Life Sciences, Nankai University, Tianjin 300071, China)
Abstract: AP2/ERF (APETALA2/ethylene-responsive factor) is a large superfamily of transcription factors, there is one or two domains composed of 60-70 amino acid residues in its proteins. The family genes widely exist in plants and play important roles in plant growth and development, responses to biological and abiotic stresses and botanic secondary metabolism. WRI4 gene was isolated and cloned from broccoli by RT-PCR technique based on the previous data of transcriptome in broccoli, then the structure and characteristics of WRI4 gene were analyzed by bioinformatic analysis software. The results showed that, 308 amino acids were encoded by WRI4 transcription factor gene in broccoli, and there were two AP2/ERF domains in WRI4 transcription factor, which belonged to AP2/ERF family member. The WRI4 protein was hydrophilic and had no transmembrane structure, its main secondary structures were random coil, α-helix and β-rotation angle. Results of amino acid sequence alignment and evolutionary tree analysis showed that, WRI4 transcription factors in broccoli had high similarity with the corresponding transcription factors in cabbage and rape. Overexpression vector of WRI4 was constructed by homologous recombination technique, which provided basis for further exploring on its functions and cultivating new varieties of broccoli.
Key words: broccoli;WRI4;AP2/ERF;homologous recombination cloning
高盐、干旱、极端温度等不利因素对大多数植物的生长均有抑制作用。面对逆境胁迫,植物已经进化出复杂的系统来调节对压力信号的适应[1]。AP2/ERF(APETALA2/ethylene-responsive factor)属于植物中特有的一类转录因子超家族。其廣泛参与植物的生物与非生物胁迫,并在一些信号交叉途径中作为中间因子参与调节[2]。目前已有研究结果表明,AP2/ERF转录因子家族对植物适应非生物逆境、植物生长发育、花器官形态建成以及种子发育有重要影响[3]。
AP2/ERF家族均含有1个或2个DNA结合域,其保守域由60~70个氨基酸组成[4]。根据含有结构域数量的不同,AP2/ERF超家族可以分为5类亚族:DREB (Dehydration-responsive element binding protein)、ERF(Ethylene-responsive factors)、AP2(APETALA 2)、RAV (Related to ABI3/VP1),以及Soloist亚族,其中ERF亚族和DREB亚族含有1个AP2/ERF结构域,Soloist亚族具有单一的保守型结构域,AP2亚族大多数含有2个AP2/ERF结构域,RAV亚族包括1个AP2/ERF结构域及1个B3结构域[5]。
DREB亚族能够特异性结合干旱胁迫响应元件(DRE/CRT)和冷诱导响应元件(A/GCCGAC)[5-6],在调节植物对干旱和低温等非生物胁迫及生物胁迫响应中发挥功能[7]。ERF亚族参与植物激素的信号调节,具有调控乙烯应答以及抗病相关基因表达的功能[8-9]。RAV亚族主要在生物和非生物胁迫响应、乙烯响应过程中起重要作用[10]。Soloist亚族与生物胁迫响应相关[6]。AP2亚族基因最初被分离时,在花分生组织的建立中发挥着核心作用,AP2亚族基因主要影响植物的花器官发育、分化以及侧根生长、脂肪酸代谢、角质合成等过程[11]。其对花原基的形成、胚珠的发育[12]、种子的形成以及发育也起关键作用[8]。有研究结果表明,AP2突变体的拟南芥花瓣减少,雄蕊缺失,出现未融和萼片状心皮结构[13]。
已有研究结果证明,WRI类转录因子属于AP2亚族[14]。WRI类转录因子诱导合成的脂肪酸是所有植物细胞的基本组成成分,用于膜生物合成和修复,其覆盖在表皮细胞角质层脂质(角质层蜡和角质),是防止水分流失、病原微生物进入和器官粘连的重要保护屏障[15-16]。WRI1-like 组群中,WRI1、WRI3和WRI4这3个转录因子能够有效调控酰基链合成比率,参与花发育过程中脂肪酸生物合成的激活,并通过为角质生物合成提供酰基前体来防止花器官粘附和半不育[17]。同时WRI1在植物油脂合成的调控中起着至关重要的作用[15],它诱导了糖酵解生物合成相关基因的转录,影响植物种子特异性三酰甘油(TAGs)的合成和贮藏[16],有利于花器官角质合成[18-19]。该转录因子通常被认为是胚胎形成和种子成熟过程中的主要调控因子[17]。目前已经在多种植物中成功克隆到 WRI1基因[20-22],但国内外关于WRI4基因的报道较少。
中国青花菜的主要栽培品种均由国外引进,中国地域辽阔种植环境差异大,对青花菜生长发育有一定的限制,当务之急是要加快选育出适合中国种植,综合表现优良的品种[23]。
WRI类转录因子能影响植物的生长发育,调节贮藏代谢机制,影响油脂的合成与贮藏。本试验对青花菜WRI4基因进行克隆及生物信息学分析,并利用同源重组技术构建其表达载体,揭示该转录因子的功能,为青花菜育种提供理论参考。
1 材料与方法
1.1 试验材料
本试验所用的青花菜品种是高代自交纯系KJ-18,天津科润蔬菜研究所江汉民博士惠赠。
RNA 提取试剂盒购于上海普洛麦格生物制品有限公司,质粒DNA小量纯化试剂盒、DNA胶回收试剂盒、ClonEXPress II One Step Cloning Kit 试剂盒均购自从北京庄盟国际生物基因科技有限公司,高保真酶 KOD FX DNA聚合酶,限制性核酸内切酶 NcoI-HF、BstEII-HF购自New England Biolabs公司。
克隆载体pCAMBIA-3301购于北京擎科生物科技有限公司,大肠杆菌(Escherichia coli)菌株 DH5α、农杆菌(Agrobacterium tumefaciens)菌株EHA105购于北京庄盟国际生物基因科技有限公司;引物合成与测序由上海生工生物工程有限公司完成。
1.2 试验方法
1.2.1 总RNA的提取及反转录 根据RNA提取试剂盒的说明书提取RNA。使用前用灭菌冷冻后的剪刀和镊子取青花菜真叶放入液氮速冻,将冻好的材料放在提前冷冻过的研钵中快速研磨成粉末,迅速将其置于2.0 ml的離心管中,同时向该管中加入裂解液按说明书提取青花菜总 RNA。
1.2.2 WRI4全长cDNA引物设计及扩增 利用软件 Primer Premier 5.0 设计青花菜WRI4基因全长引物,根据同源重组反应引物设计原则,选择 NcoI-HF、BstE II-HF 2个限制性内切酶,引物设计如下:正向引物:5′-ACGGGGGACTCTTGACCATGGAT ̄G ̄G ̄C ̄A ̄AAACTCTCTCAACGGAAC-3′;反向引物:5 ̄′ ̄- ̄G ̄G ̄G ̄GAAATTCGAGCTGGTCACCTCAAGA ̄C ̄C ̄A ̄A ̄T ̄A ̄A ̄T ̄C ̄A ̄A ̄A ̄C ̄TCGTTACATA-3′。PCR程序为:94 ℃ 预变性5 min;94 ℃ 变性 15 s,58 ℃退火30 s,68 ℃ 延伸1 min ,33 个循环;68 ℃延伸7 min ,运行结束后将扩增产物置于4 ℃进行保存。用1%的琼脂糖凝胶电泳进行PCR产物鉴定。
1.2.3 同源重组技术构建青花菜WRI4基因表达载体 按照ClonEXPress II One Step Cloning Kit 试剂盒说明书的操作流程进行WRI4基因过表达载体的构建。利用NcoI-HF,BstE II-HF内切酶对pCAMBIA3301载体进行双酶切,获得线性化的载体,胶回收线性化载体与目的基因条带进行连接,采用冻融法将连接产物转入农杆菌感受态细胞,培养过夜,挑选单菌落进行PCR鉴定。
1.2.4 青花菜WRI4基因生物信息学分析 利用以下生物信息分析软件及在线网站对WRI4基因进行分析:利用NCBI (https:// www.ncbi.nlm.nih.gov/)对WRI4蛋白保守功能结构域预测,使用ProtParam (https://web.expasy.org/protparam/)对WRI4基因一级结构进行分析,利用PRABI (https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)分析WRI4氨基酸、蛋白质基本理化性质,利用ProtScale(https://web.expasy.org/protscale/)预测WRI4蛋白的亲(疏)水性,使用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构分析,使用NetPhos (http://www.cbs.dtu.dk/services/NetPhos/)进行磷酸化位点预测、分析,利用SWISS-MODEL: (https://www.swissmodel.expasy.org/)对WRI4蛋白三级结构进行分析,利用MEME软件对青花菜及其他物种中的WRI4蛋白进行保守 motifs分析,使用DNAMAN 软件对WRI4蛋白氨基酸序列进行同源比对,使用MEGA 软件对不同物种WRI4蛋白进行进化树分析。
2 结果与分析
2.1 WRI4基因的克隆
提取青花菜RNA,用1%的琼脂糖凝胶电泳检测到RNA清晰条带,采用NanoDrop-1000仪器测定提取的总RNA质量,A260/A280在2.0左右,RNA 无降解,纯度较高,反转录得到cDNA。以cDNA 为模板利用高保真酶对WRI4进行PCR扩增,得到长约900 bp的cDNA 条带(图1),经测序证明该条带是目的基因WRI4,可用于后续试验。
2.2 青花菜WRI4转录因子分子特征
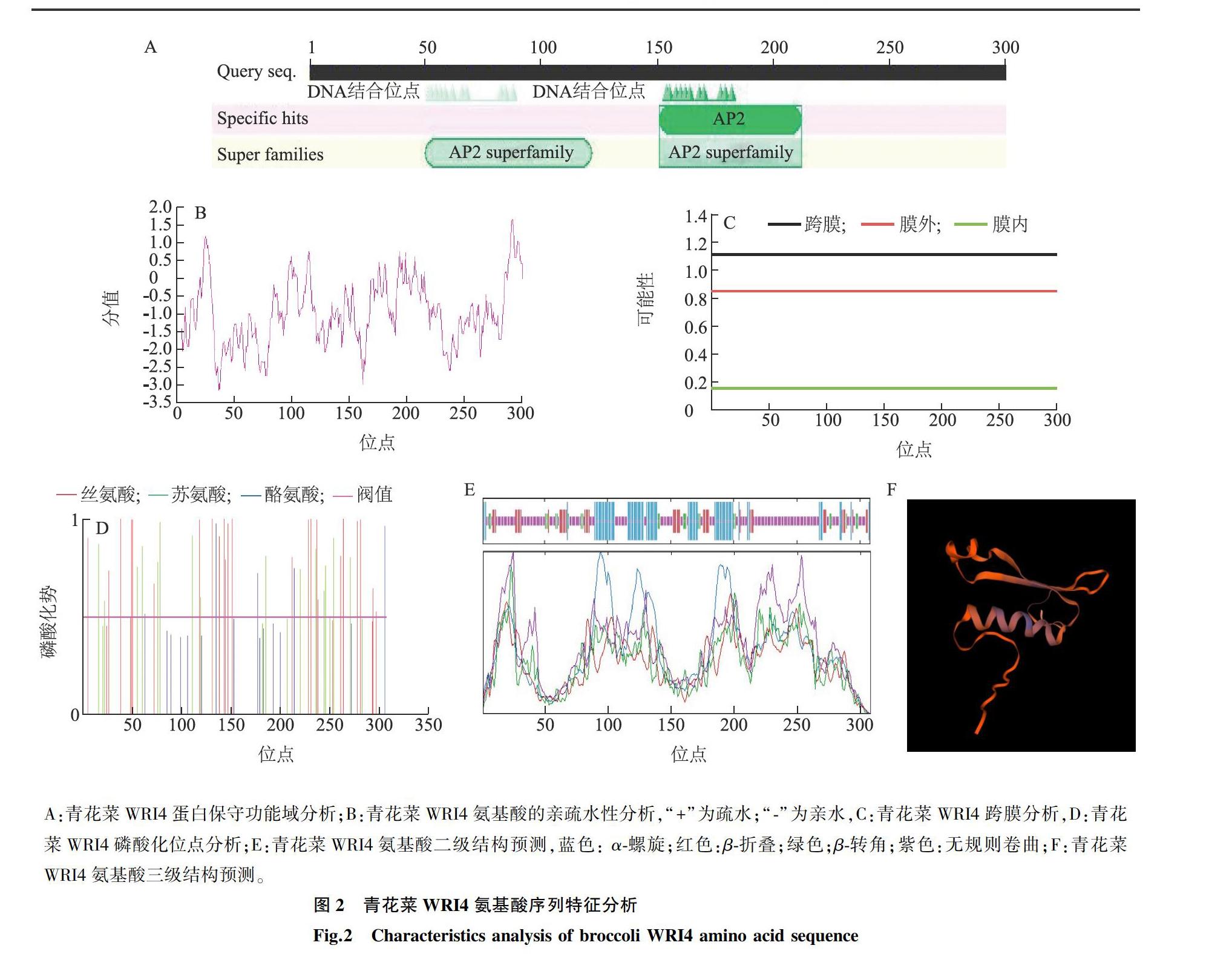
对WRI4转录因子进行结构分析,发现其有2个AP2/ERF保守结构域,证明WRI4转录因子属于AP2/ERF家族中AP2亚族(图2A)。利用软件ProtParam对青花菜中WRI4转录因子一级结构进行预测分析,结果显示WRI4共编码308个氨基酸,相对分子质量为35 020,理论PI值(蛋白质等电点)为7.69。原子总数为4 829,脂肪指数为53.64,亲水性平均值(GRAVY)为-0.944,青花菜WRI4可能是一种亲水性蛋白质。进一步的亲水性分析发现,亲水性最小分值为-3.133,最大分值为1.667,表明此蛋白质为亲水性蛋白质(图2B);TMHMM,PRABI软件分析结果表明,WRI4蛋白没有跨膜区域,不是膜蛋白(图2C)。蛋白质磷酸化位点分析结果(图2D)表明,WRI4蛋白有15个苏氨酸,24个丝氨酸,5个酪氨酸,WRI4蛋白内存在无规则卷曲(53.9%),α-螺旋(24.68%),β-转角(7.47%),伸展链(13.96%),不存在β-折叠(图2E、图2F)。
2.3 青花菜WRI4系统进化分析
通过DNAMAN软件对青花WRI4转录因子、荠菜(Capsella rubella,XP_023642912.1)、白菜(Brassica rapa,XP_009106692.1)、萝卜(Raphanus sativus,XP_018457265.1)、亚麻荠(Camelina sativa,XP_010472844.1)、油菜(Brassica napus,XP_013650299.1)、拟南芥(Arabidopsis thaliana,NP_001077849.1)、烟草(Nicotiana attenuata,XP_019248140.1)、甜樱桃(Prunus avium,XP_021830086.1)物种的相应转录因子氨基酸序列进行比对。比对结果(如图3)显示,青花菜WRI4转录因子与白菜、油菜的相似度高。
2.4 青花菜WRI4保守motifs及分子进化分析
利用MEME、MEGA软件分析不同物种结构域以及亲缘性。利用MEME对青花菜及其他物种中WRI4进行 motifs分析,分析结果(图4)显示,WRI4转录因子具有 2 个 AP2 保守结构域且均含有YRG 和 RAYD 2个保守结构域。motifs越相近,亲缘性越高。进一步采用 MEGA 软件对其进行进化树及结构域分析,结果如图5所示,更进一步证实青花菜WRI4与白菜和油菜相对应的转录因子有较高亲缘性。
2.5 同源重组克隆技术构建青花菜WRI4表达载体
根据ClonEXPress II One Step Cloning Kit 试剂盒说明书获得线性化目的基因与载体,胶回收线性化载体,与目的基因条带进行连接,将产物涂布在含有 50 mg/L卡那霉素和50 mg/L利福平的LB 筛选培养皿上培养,挑取單克隆菌落于相同抗性的LB液体培养基中培养并进行PCR鉴定(图6),条带大小正确,青花菜WRI4表达载体构建成功。
3 讨论
已有研究结果表明,AP2/ERF家族中WRI类转录因子对植物生长发育、脂肪酸产生、蜡质的形成与贮藏以及植物开花有一定的调控作用,并对植物抵抗生物与非生物胁迫有重要影响[24-25]。拟南芥中过表达Brassica napus的WRI1同源基因会使转基因种子以及叶片中油脂含量上升,过表达BnWRI1促使花期提前,在单子叶植物的叶片中异位表达BdWRI1后会使叶片中TAG和游离FA含量提高[25]。导入WRI1基因的转基因玉米,过表达该基因对种子萌发、植株生长以及产量并未出现明显影响,但转基因玉米籽粒含油量比野生型提高了48%[19]。另有研究结果表明,烟草原生质体中WRI4基因通过直接结合启动子激活LACS1、KCR1、PAS2、ECR和WSD1的表达,参与蜡前体的脂肪酸延伸和蜡质的产生与贮藏[17]。
本试验分离克隆了青花菜WRI4基因,利用生物信息学分析软件对WRI4进行分析,其编码308个氨基酸,编码的蛋白质相对分子质量为3 520,有2个AP2/ERF 结构域,无跨膜结构,亲水性平均值(GRAVY)为-0.944,由此推断其可能是一种亲水性蛋白质。由WRI4二级(三级)结构分析结果可知,其含有无规则卷曲(53.9%),α-螺旋(24.68%),β-转角(7.47%),伸展链(13.96%),不含β-折叠。Motifs分析结果显示青花菜WRI4与白菜和油菜WRI4同源性高。虽然WRI1转录因子在拟南芥、油菜、玉米、棉花等作物中已有报道,但WRI4转录因子的报道较少,因此探究该转录因子对青花菜生长发育影响,及其对外界胁迫的响应显得尤为迫切。本研究利用同源重组技术构建了青花菜WRI4基因表达载体,为探究WRI4转录因子在青花菜生长发育中的作用,进一步培育青花菜优良品种奠定了基础。
参考文献:
[1] JUNYA M, KAZUO S, KAZYKO Y. AP2/ERF family transcription factors in plant abiotic stress responses[J]. BBA Gene Regulatory Mechanisms, 2012,1819(2):86-96.
[2] 梁玲鸽. 矮牵牛PhWRIL1基因功能的分析[D].重庆:西南大学,2019.
[3] KAZUKO Y, KAZUO S. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses[J]. Annual Review of Plant Biology,2006,57(11):23-34.
[4] 邵文靖,敖特根白音,郎明林. AP2/ERF转录因子对植物非生物胁迫的应答机制研究进展[J].分子植物育种,2020,18(15):4981-4988.
[5] 崔喜艳,陈众峰,陈展宇. AP2/ERF转录因子对植物非生物胁迫应答的研究进展[J].吉林农业大学学报,2015,37(4):417-423.
[6] 孙 滨,占小登,曹立勇,等. 水稻AP2/ERF转录因子的研究进展[J].农业生物技术学报,2017,25(11):1860-1869.
[7] 崔 波,郝平安,梁 芳,等. 蝴蝶兰AP2/ERF家族基因的克隆及在低温下表达特性分析[J].园艺学报,2020,47(1):85-97.
[8] SAKUMA Y, LIU Q, DUBOUZET J G, et al. DNA-binding specificity of the ERF/AP2 domain of arabidopsis DREBs, transcription factors involved in dehydration- and cold-inducible gene expression.[J]. Biochemical & Biophysical Research Communications, 2002, 290(3):998-1009.
[9] 高春艷,吴 芮,袁 玉,等. 植物AP2/ERF转录因子及其在非生物胁迫应答中的作用[J].江汉大学学报(自然科学版),2017,45(3):236-240.
[10]苟艳丽,张 乐,郭 欢,等. 植物AP2/ERF类转录因子研究进展[J]. 草业科学,2020,37(6):1150-1159.
[11]ASAPHA, SHITAL D, REINHARD J, et al. The shine clade of AP2 domain transcription factors activates wax biosynthesis, altersc uticle properties, and confers drought tolerance when overexpressed in arabidopsis[J]. The Plant Cell,2004,16(9):2463-2480.
[12]闻可心,刘雪梅. AP2功能基因在植物花发育中的重要作用[J].生物技术通报,2010(2):1-7.
[13]李魁鹏. 杂种落叶松组培不定根诱导及生根相关AP2-like基因的克隆与表达研究[D].北京:中国林业科学研究院,2014.
[14]王莉莉. 甘蓝型油菜AP2亚家族转录因子及植物中WRI1的基因组学分析[D].杨陵: 西北农林科技大学,2016.
[15]TO A, JOUBES J, BARTHOLE G, et al. WRINKLED transcription factors orchestrate tissue-specific regulation of fatty acid biosynthesis in arabidopsis[J]. The Plant Cell,2012,24(12): 5007-5023.
[16]TAJIMA D, KANEKO A, SAKAMOTO M, et al. WRINKLED 1 (WRI1) homologs,AP2-Type transcription factors involving master regulation of seed storage oil synthesis in castor bean (Ricinus communis L.)[J]. American Journal of Plant Sciences,2013,4(2):333-339.
[17]PARK C S, GO Y S, SUH M C. Uticular wax biosynthesis is positively regulated by WRINKLED4,an AP2/ERF-type transcription factor, in Arabidopsis stem [J]. Plant Journal for Cell & Molecular Biology,2016,88(6):257-270 .
[18]CEMAC A, BENNING C. WRINKLED1 encodes an AP2/EREB domain protein involved in the control of storage compound biosynthesis in arabidopsis[J]. Plant Journal for Cell & Molecular Biology, 2010, 40(4):575-585.
[19]KONG Q, YANG Y, GUO L, et al. Molecular basis of plant oil biosynthesis: insights gained from studying the WRINKLED1 transcription factor [J]. Frontiers in Plant Science,2020,11(24):1-6.
[20]丁 霄,杨淑巧,许 琦,等. 转录因子WRI1在主要作物中的研究进展[J].分子植物育种,2015,13(3):697-701.
[21]VANHERCKE T, TAHCKY A E, SHRESTHA P, et al. Synergistic effect of WRI1 and DGAT1 coexpression on triacylglycerol biosynthesis in plants[J]. FEBS Letters,2013,587(4):364-369.
[22]BENIAMIN P, SEBASTIEN B, VANESSAV, et al. Duplicate maize Wrinkled1 transcription factors activate target genes involved in seed oil biosynthesis[J]. Plant Physiology, 2011,156(2):674-686.
[23]王建升,虞慧芳,赵振卿,等. 早熟青花菜新品种浙青60的选育[J]. 长江蔬菜, 2020(6):66-69.
[24]张计育,王庆菊,郭忠仁. 植物AP2/ERF类转录因子研究进展[J].遗传,2012,34(7):44-56.
[25]李玉兰,孙勤富,王幼平. 植物油脂合成的转录调控研究进展[J].分子植物育种,2016,14(9):2509-2518.
(责任编辑:陈海霞)
