基于3DEEM-PARAFAC的短期稻虾共作土壤DOM荧光光谱分析
2021-07-23苏良湖王赛尔纪荣婷刘臣炜陈梅张龙江
苏良湖 王赛尔 纪荣婷 刘臣炜 陈梅 张龙江


摘要: 稻虾共作模式已在中国长江中下游地区广泛应用。为研究短期稻虾共作对土壤溶解性有机物(DOM)组成和腐殖化的影响,采用三维荧光光谱耦合平行因子法(3DEEM-PARAFAC)分析土壤DOM熒光组分和各组分变化规律,利用腐殖化指数(HIX)、腐殖酸与色氨酸荧光比值(A∶T)、新鲜指数(β:α)、McKnight荧光指数(MFI)、Y型荧光指数(YFI)等多种荧光光谱指数表征DOM腐殖化程度,并通过皮尔逊相关系数进行相关性分析。研究发现,土壤DOM包括3个荧光组分,C1为较低相对分子质量的腐殖质类物质,C2为较高芳香度的UVC类腐殖质,C3为酪氨酸类物质,未发现高相对分子质量腐殖质类物质。在0~20.0 cm表层土壤中,C1、C2组分荧光强度随采样时间的推迟呈先上升后下降趋势,峰值出现在水稻分蘖期或抽穗期,而C3组分荧光强度无明显变化规律。皮尔逊相关系数分析结果显示,腐殖质类物质C1荧光强度与C2荧光强度呈显著正相关性(r=0.99,P<0.001),蛋白质类物质C3荧光强度与其他荧光指数(强度)相关性均较弱(r<0.40)。HIX与C1荧光强度、A∶T呈显著正相关,均可被线性函数拟合。相较于MFI,YFI更能反映土壤中DOM的腐殖化变化特性,YFI与HIX可被指数函数较好拟合。研究认为,短期稻虾共作土壤的腐殖化特征主要受内源有机质降解影响,而受外源蛋白质类物质输入的影响较小,且难以通过分析溶解性有机碳含量来监测土壤有机质腐殖化程度。
关键词: 稻虾共作;土壤溶解性有机物(DOM);三维荧光光谱(3DEEM);平行因子(PARAFAC)分析
中图分类号: S153.6 文献标识码: A 文章编号: 1000-4440(2021)03-0639-12
Fluorescence spectrometric analysis of dissolved organic matter(DOM) in soil from a short-term integrated rice-crayfish system based on 3DEEM-PARAFAC
SU Liang-hu, WANG Sai-er, JI Rong-ting, LIU Chen-wei, CHEN Mei, ZHANG Long-jiang
(Nanjing Institute of Environmental Sciences, Ministry of Ecology and Environment, Nanjing 210042, China)
Abstract: Integrated rice-crayfish system has been widely used in the middle and lower reaches of Yangtze River in China. To study the effects of short-term integrated rice-crayfish system on composition and humification of dissolved organic matter (DOM) from the soil, three-dimensional excitation emission matrix fluorescence spectroscopy coupled parallel factor method (3DEEM-PARAFAC) was used to analyze the fluorescence components and the changes of each component of soil DOM. Different fluorescence spectrum indexes including humification index (HIX), ratio of humic acid fluoescence intensity to tryptophan fluorescence intensity (A∶T), freshness index (β∶α), McKnight fluorescence index (MFI), Y-type fluorescence index (YFI) were used to characterize the degree of DOM humification. Pearson correlation coefficient was used to analyze the correlation. The results showed that three fluorescence components were identified from soil DOM, containing humic substances with low relative molecular weight (C1), UVC humic substances with high aromatic degree (C2) and tyrosine-like substances (C3), no humic substance with relative high molecular weight was found. In the surface soil of 0-20.0 cm depht, the fluorescence intensity of C1 and C2 components increased firstly and then decreased as the sampling time pastponed, the highest value appeared at the tillering or heading stage of rice, while no definite trend was found for the C3 component. Pearson correlation coefficient analysis demonstrated that the fluorescence intensity of humic substances C1 and C2 showed significant positive correlation (r=0.99, P<0.001); the fluorescence intensity of protein substance C3 had weak relationship with other fluorescence indices (intensities) (r<0.40). HIX showed significant positive correlation with the fluorescence intensity of C1 and A∶T, which could be fitted by a linear function. Compared with MFI, YFI had sufcient distinguishing capacity to characterize the humification process of DOM in the soil; YFI and HIX could be fitted well by an exponential function. It can be concluded from the study that the humification characteristics of the soil in the short-term integrated rice-crayfish system are mainly affected by the degradation of endogenous organic matter, but are less affected by the input of exogenous protein substances. It is hard to monitor the humification degree of soil organic matter by analyzing dissolved organic carbon content of the soil.
Key words: integrated rice-crayfish system;soil dissolved organic matter (DOM);three-dimensional excitation emission matrix fluorescence spectrum (3DEEM);parallel factor (PARAFAC) analysis
稻鱼综合种养是绿色生态的农渔发展模式,是渔业产业扶贫和助力乡村振兴的重要抓手,对促进稳粮增收和水产品稳产保供具有重要作用[1]。其中,稻虾共作模式在中国发展迅速,在长江中下游地区被广泛应用。据统计,近十年来中国克氏原螯虾(Procambarus clarkii)产量快速增长,从2006年的1.31×105 t大幅跃升至2016年的8.52×105 t,占全球比例达83.6%~92.7%。2016年全国稻虾共作面积约4.2×105 hm2[2],主要分布在湖北、安徽、江苏、江西、湖南等省。全国适宜稻虾共作的面积高达4.5×106 hm2,占现有稻田总面积的15%,稻虾共作的发展潜力巨大[2]。
稻虾共作生态系统是一个以水稻为主体,以克氏原螯虾为绝对优势种群,以土壤为基础,并结合水体养殖的生态系统,包括生物圈、土壤圈、水圈在内的生物与环境系统[3]。稻田生态系统中引入克氏原螯虾,构成了比常规稻作生态系统更为复杂的食物链网络结构[3],克氏原螯虾的饲料、粪便排放及活动改变了稻田生态环境,使得稻田生态系统结构与功能更复杂,提高了能量、水、肥等的利用率,增强了稻田生态系统的稳定性及抗外界冲击的能力[4-5]。有研究结果显示,在水稻稳产增产的前提下,稻虾共作1 hm2化肥使用量减少48.46%,费用减少38.9%。1 hm2农药使用量减少1.07 kg,且无需使用除草剂[6]。而且,稻虾共作模式促进了系统中物质的循环,阻止了稻田物质流的外溢,使稻田生态系统从结构与功能上得到改善和提升[7]。
溶解性有机物(Dissolved organic matter,DOM)具有比固相有机质更多的活性点位,是土壤有机质中最活跃、最重要的组分[8]。DOM对土壤营养物质的活化、重金属和有机污染物的迁移转化等具有极其重要的作用[9],并在微生物生长代谢、土壤有机质分解转化等过程中发挥重要作用[10]。因此,解析稻虾系统土壤DOM的变化规律具有重要意义。目前关于稻虾共作的研究,主要聚焦在稻田土壤微生物群落结构[11-12]、线虫[13]、土壤理化性质[5]、养分循环[14-15]、温室气体排放[16]等方面,对稻田土壤DOM影响的研究还较少,尤其是DOM荧光光谱特征的变化规律鲜有报道。与其他分析技术相比,三维荧光分析具有灵敏度高、选择性强、信息量大等特点,可定性区分和定量测定DOM含量和组成特征。
为此,本研究采用三维荧光光谱耦合平行因子法(3DEEM-PARAFAC)分析土壤DOM荧光组分和各组分变化规律,利用多种荧光光谱指数表征DOM腐殖化程度,并通过皮尔逊相关系数分析各荧光指数(强度)的相关性,旨在揭示短期稻虾共作模式下稻田土壤DOM组分、来源及其DOM动态变化过程,为稻虾共作模式下土壤生态系统的健康发展及肥力培育提供理论依据。
1 材料与方法
1.1 试验设计
试验区位于生态环境部南京环境科学研究所黄山野外科研基地(安徽省黄山区三口镇,30.24°N,118.39°E),属亚热带季风性湿润气候,年均气温15.5 ℃,无霜期约220 d,年均降水量1 556 mm。2019年3月,参考湖南省地方标准《稻虾生态种养技术规程(DB43/T 1381-2017)》,建设了1.36 hm2的稻虾共作标准试验田(160 m×85 m),主要建设内容包括土地平整、开挖“回”形沟、建设进排水设施、安装防逃网和隔离网等。2019年6月底,移栽稻秧,按150 kg/hm2投放克氏原螯虾幼苗。稻虾共作系统中,不定期投放黄粉虫及虫粪分别作为克氏原螯虾饲料和水稻肥料,不施加化肥或农药(本研究称为“有机稻虾共作系统”)。以水稻生育期确定采样时间,分别于移栽前(3月24日,T1)、水稻分蘖期(6月28日,T2)、水稻抽穗期(9月12日,T3)、水稻收获期(11月19日,T4),在稻虾共作试验田取10个采样点(沿水稻田长边一侧均匀分布取样,S1~S10),同时在田块附近常规水稻田选取2个采样点(CK1、CK2),作为对照。分别采集各时期稻田0~40.0 cm土壤样品,并按深度分为0~10.0 cm、10.1~20.0 cm、20.1~30.0 cm和30.1~40.0 cm,剔除可见的动植物残体和石块等杂质,放置于通风阴凉处风干。
1.2 分析方法
1.2.1 DOM提取和溶解性有机碳(DOC)测定 将所有土壤样品风干并过40目筛,将5 g土壤样品称质量放入100 ml锥形瓶中,添加30 ml去离子水,土壤与水的质量比为1∶6[17]。将锥形瓶室温下在摇床160 r/min振荡3 h,静置后将样品通过0.45 μm微孔滤膜,即得到提取的DOM溶液。土壤的DOC含量利用湿式氧化法总有机碳分析仪(Aurora 1030C,美国OI分析仪器公司产品)测定。该分析仪由进样针模块、红外CO2分析仪等组成。用0.2 ml的2 mol/L HCl酸化样品(每次進样1.0 ml),将酸添加步骤中释放的CO2注入CO2分析仪。随后燃烧样品中任何残留的碳,并通过差值获得DOC含量。
1.2.2 三维荧光光谱分析 三维荧光光谱(Three-dimensional excitation emission matrix,3DEEM)采用吸收和三维荧光扫描光谱仪(Aqualog,美国HORIBA Jobin Yvon公司产品)分析,配以1 cm×1 cm石英荧光样品池。Aqualog荧光光谱仪包含1个像差校正的双光栅激发单色仪和1个发射检测器。荧光扫描光谱仪以氙气灯为激发光源,信噪比>20 000∶1。激发波长(Ex)范围为211~618 nm,扫描间隔为3 nm。发射波长(Em)范围为240~600 nm,采用电制冷CCD检测器,扫描间隔为3.54 nm。对于荧光光谱测试,DOM提取液与超纯水按照1∶4(体积比)稀释。对测得的三维荧光光谱,采用Aqualog V3.6软件处理数据,包括去除拉曼散射、消除一级二级瑞丽散射、内滤效应校正。内滤效应的校正公式如公式1所示:
Fideal=Fobs×10(AbsEx+AbsEm)/2(1)
其中,Fobs和Fideal分别为测量和校正后的荧光强度;AbsEx和AbsEm分别为激发波长和发射波长的吸光度。对处理后的三维荧光光谱,采用SOLO+MIA 8.6.1软件(美国Eigenvector Research公司产品)进行平行因子分析,并通过核一致性诊断和半劈裂分析(Split-half analysis)验证模型。由于荧光强度为负值在化学上是不可能的,因此将非负约束应用于模型参数[18]。通过OpenFluor在线数据库(https://openfluor.lablicate.com/)[19]设定Tuckers一致性系数为0.95,与相关研究结果比对,确定DOM的荧光组分。
1.2.3 荧光光谱指数 以校正后的荧光光谱计算不同荧光光谱指数(腐殖化指数、A∶T、新鲜指数、McKnight荧光指数、Y型荧光指数)。其中,腐殖化指数(HIX)指激发波长为254 nm时,发射波长在435~480 nm和300~345 nm处积分值(或平均值)的比值[20]。A∶T是腐殖酸与色氨酸荧光比值,由峰A[Ex(激发波长)=260 nm,Em(发射波长)=450 nm]与峰T(Ex=275 nm,Em=304 nm)强度之比计算[21]。新鲜指数(β∶α)是指Ex=310 nm时,Em在380 nm与420~435 nm内最大发射强度之比[21]。McKnight荧光指数(MFI)是Ex=370 nm处激发时,Em在450 nm与500 nm的荧光强度比值[22]。Y荧光指数(YFI)是Ex=280 nm处激发时,Em在350~400 nm与400~450 nm内平均荧光强度的比值[23]。
2 结果与分析
2.1 土壤DOM平行因子分析
对稻虾共作田样品(160个)和常规水稻田样品(32个)的土壤DOM分别进行平行因子(PARAFAC)分析,建立组分数量为3~10个的PARAFAC模型。研究发现,稻虾共作田和常规水稻田土壤的DOM荧光组分特性无明显差异,均包括3个有效荧光光谱组分。为比较常规水稻田和稻虾共作田DOM各组分荧光强度的变化趋势,对采集的所有土壤样品(共计192个)统一进行PARAFAC分析,并使用核一致性诊断和半劈裂分析验证组分数量的正确性。模型分析结果显示,构建的PARAFAC模型稳健;半劈裂分析结果显示,与总体模型相似度达96.9%。3种荧光组分(标记为C1,C2和C3)的代表性荧光光谱和荧光光谱负载如图1所示。这些成分属于腐殖质类(C1、C2)和酪氨酸类(C3)化合物,通常存在于土壤、水中。其中,C2的激发和发射负载中具有较大的重叠光谱(>120 nm),这表明C2具有更为复杂的DOM组成[24]。
2.2 EEM-PARAFAC組分荧光强度变化规律
EEM-PARAFAC各荧光组分的表征,对了解稻虾共作系统土壤DOM的演变特征具有重要意义。不同深度土壤(0~40.0 cm)DOM荧光成分的最大荧光强度(Fmax)的变化规律如图2、图3、图4所示。由图2、图3、图4可以看出,在4次采集的土壤样品中,不同深度土壤的腐殖酸类和蛋白质类物质的分布均没有明显规律。这显然与本研究中地块被激烈扰动密切相关。在稻虾共作系统建立过程中,需对面积不等的小田块进行开挖、平整等作业。在此过程中,由于土壤被激烈扰动,不同深度土壤的DOM规律性较差。而且,由于扰动过程中,原农田的纤维素类物质(杂草等)可能被翻抛到土壤底层,进而被缓慢腐殖化,这也将影响土壤DOM随深度的变化规律。
在有机稻虾共作系统中,所有样品不同深度的土壤DOM的C1组分和C2组分变化规律均一致,这表明该区域土壤DOM的2种腐殖酸类物质C1和C2具有类似来源及发生类似生化反应。在有机稻虾共作系统10.1~20.0 cm的土壤样品层,腐殖酸类物质荧光强度随采样时间的推迟呈现先上升后逐渐下降的趋势(除S4样品),表层土壤(0~10.0 cm)腐殖酸类物质荧光强度也主要呈现类似规律。这表明,插秧前土壤中含有的有机质物质进一步腐殖化,以及在水稻分蘖期或水稻抽穗期引入的外源有机类物质,使得土壤中腐殖质类物质的荧光强度显著上升。而后,0~20.0 cm土层土壤DOM腐殖酸类物质含量的降低,可能是部分源于腐殖酸的进一步矿化和土壤固相腐殖质类物质向水体中转移等原因。
此外,相对于10.1~20.0 cm土层,0~10.0 cm土层土壤腐殖质类物质的变化趋势更容易受到外源有机物、土壤有机物固-液相迁移等的影响,而使得其变化趋势不完全一致。如S2在0~10.0 cm土层中,其腐殖质类物质的含量随采样时间推迟呈现逐步上升的趋势,而S5则呈现逐步下降的趋势。不同深度土层的土壤蛋白质类物质C3,其荧光强度变化无明显规律。在常规水稻田(CK1和CK2样品),其10.1~20.0 cm土层土壤腐殖质类物质的荧光强度在采样期内随采样时间的推迟呈现显著下降的趋势,这与稻虾共作系统的土壤变化不同。这种差异性可能源于农田中土壤有机物固-液相迁移,而无外源有机质加入等因素导致的。
如前所述,有机稻虾共作系统对土壤的影响主要集中于表层(如0~20.0 cm),本研究进一步分析表层土壤PARAFAC 3种组分的平均荧光强度变化趋势,结果如图5所示。总体上,C1、C2组分的荧光强度随采样时间的推迟呈先上升后下降的趋势,峰值出现在水稻分蘖期(T2)或抽穗期(T3)。t检验结果显示,相较于T1, T2和T3的土壤DOM腐殖酸类荧光强度极显著增加(P<0.01),T4的腐殖酸类物质的荧光强度与T1差异不显著(P=0.067)。0~20.0 cm土层中,C3组分的荧光强度无明显变化趋势,这显示外源有机类物质(主要是黄粉虫粪)并不能提升土壤表层的蛋白质含量,可能原因在于:(1)黄粉虫粪颗粒较小,其DOM组分更容易迁移到水环境中;(2)黄粉虫粪含有的蛋白质类物质容易被农田系统中的微生物快速分解矿化。
2.3 土壤DOC质量浓度变化规律
由于受土方作业扰动影响,不同深度(0~10.0 cm、10.1~20.0 cm、20.1~30.0 cm和30.1~40.0 cm)土壤的DOC质量浓度并无明显的变化规律。本研究进一步分析表层0~20.0 cm土壤DOC质量浓度的变化趋势,如表1所示。T1不同土壤样品的DOC质量浓度差别较大(3.76~28.57 mg/L),这是由于研究区域内土壤性质差异引起的。Gao等[17]报道中国亚热带季风气候区农田土壤DOC质量浓度为24.00~86.00 mg/L,本研究地块DOC质量浓度显著低于该值,这与各地温度、降水和太阳辐射密切相关,也与当地耕作方式关系密切,因为这些因素可能会影响土壤DOM的含量、组成和结构[25]。0~20.0 cm取样深度不同取样点的土壤DOC质量浓度变化规律也不一致,如取样点S1、S2、S3、S5等随采样时间的推迟呈现先上升后下降的趋势,而取样点S10则呈现波动状态。在有机稻虾共作系统中,S1~S10样品在T1、T2、T3、T4的平均DOC质量浓度分别为(12.87±8.33) mg/L、(11.43±10.21) mg/L、(14.54±6.08) mg/L、(7.84±3.65) mg/L。t检验结果显示,T1、T2和T3之间的土壤DOC质量浓度无明显差异,T4的土壤DOC质量浓度显著低于T1(P<0.01)。这说明,水稻收获期排水是导致有机稻虾共作系统土壤DOC流失的重要原因。这与佀国涵等的研究结果不一致[5]。佀国涵等[5]发现稻虾共作模式显著提高了0~40.0 cm土层有机碳的含量,这种差异的原因可能是运行时间(长期,>10年)和田间管理方式等不同。
2.4 PARAFAC荧光组分鉴别
进一步将PARAFAC解析的荧光组分与OpenFluor数据库[19]、Coble[26]的前期研究结果进行比对,结果如表2所示。利用OpenFluor数据库识别的荧光组分与Coble的峰值法的报道非常接近。C1在420 nm处显示最大发射峰,分别在<250 nm和320 nm具有激发峰。C1是具有较低相对分子质量的腐殖类物质,经常出现在海洋、废水、湿地和农田等环境中,Coble[26]研究认为C1是陆地源腐殖质类峰A和峰C的混合物。C2在475 nm处显示最大发射峰,在270 nm处显示最大激发峰,在340 nm处显示较宽的次级激发峰。C2被认为是UVC类腐殖质物质[26],考虑到它们特别长的发射波长,该组分具有较高的芳香度[27]。位于Ex=270 nm、Em=305 nm的C3是酪氨酸类物质,代表氨基酸或结合蛋白[28],该化合物可表示氨基酸的多样性和蛋白质的丰度[17]。Gao等[17]研究了中国各地农业土壤中溶解性有机物的光谱特征,除了本研究发现的C1和C2腐殖质类组分,还观察到高相对分子质量的腐殖质类物质(Ex=400 nm、Em=525 nm)。这与本研究结果不同,这种差异性可能是由研究区域的土壤类型、土壤耕作方式等多因素引起的[17]。
2.5 不同荧光指数的变化特征
本研究進一步探索了腐殖化指数(HIX)、A∶T、新鲜指数(β∶α)、McKnight荧光指数和Y型荧光指数等多种荧光指数的变化特征,以表征稻虾系统中土壤DOM的组成、转化和腐殖化过程(表3)。HIX与土壤DOM的芳香性密切相关,与碳水化合物含量呈负相关关系[36]。通常,较高的HIX值与更稠合的芳族结构的富集和(或)脂族链的更多共轭有关[37]。在本研究中,S1~S10样品在T1、T2、T3、T4的HIX均值分别为1.777、2.847、2.161、1.275。初始HIX值显著高于Gao等[17]报道的1.1左右,这可能与本研究地块土壤具有更低DOC质量浓度有关。常规水稻种植地块CK1和CK2取样点,其土壤DOM腐殖化程度相对较高。随着有机稻虾共作系统的运行,t检验分析发现,T2土壤DOM的HIX显著高于T1(P<0.05),这与PARAFAC荧光组分C1、C2的变化趋势类似,因此认为HIX的上升主要归因于腐殖质类物质的形成,而非蛋白质类物质的快速降解。经过8个月(移栽前到收获期),t检验分析发现,T4土壤DOM的HIX显著低于T1(P<0.05)。
A∶T可用于描述难降解荧光物质和不稳定荧光物质之间的比率[38]。A∶T的变化与HIX非常相似,随采样时间的推迟整体呈现先上升后下降的趋势(除S2)。S1~S10样品在T1、T2、T3、T4的A∶T均值分别为0.615、1.230、0.934、0.327。t检验分析发现,T2和T4土壤DOM的A∶T均显著高于T1(P<0.01)。
在稻虾共作系统中,MFI随采样时间的推迟呈不规则的波动,S1~S10取样点MFI的最大值和最小值的变化小于0.2,S1~S10的平均MFI数值为1.432(T1)、1.381(T2)、1.38(T3)和1.411(T4)。t检验显示,S1~S10样品在T1~T4的MFI无显著差异。因此,MFI难以监测稻虾共作系统中土壤DOM的变化规律。而YFI具有区分能力,较好地描述了土壤DOM的腐殖化过程,总体上随采样时间的推迟呈先下降后上升的趋势。t检验显示,T3土壤DOM的YFI显著低于T1(P<0.05)。这与HIX和A∶T的趋势相反,这是由于土壤DOM中腐殖质类物质占据主导位置,而荧光指数通常与芳香族含量呈负相关[22]。t检验结果显示,S1~S10样品的β∶α在T1~T4间无显著差异。
2.6 不同荧光指数(强度)的相关性分析
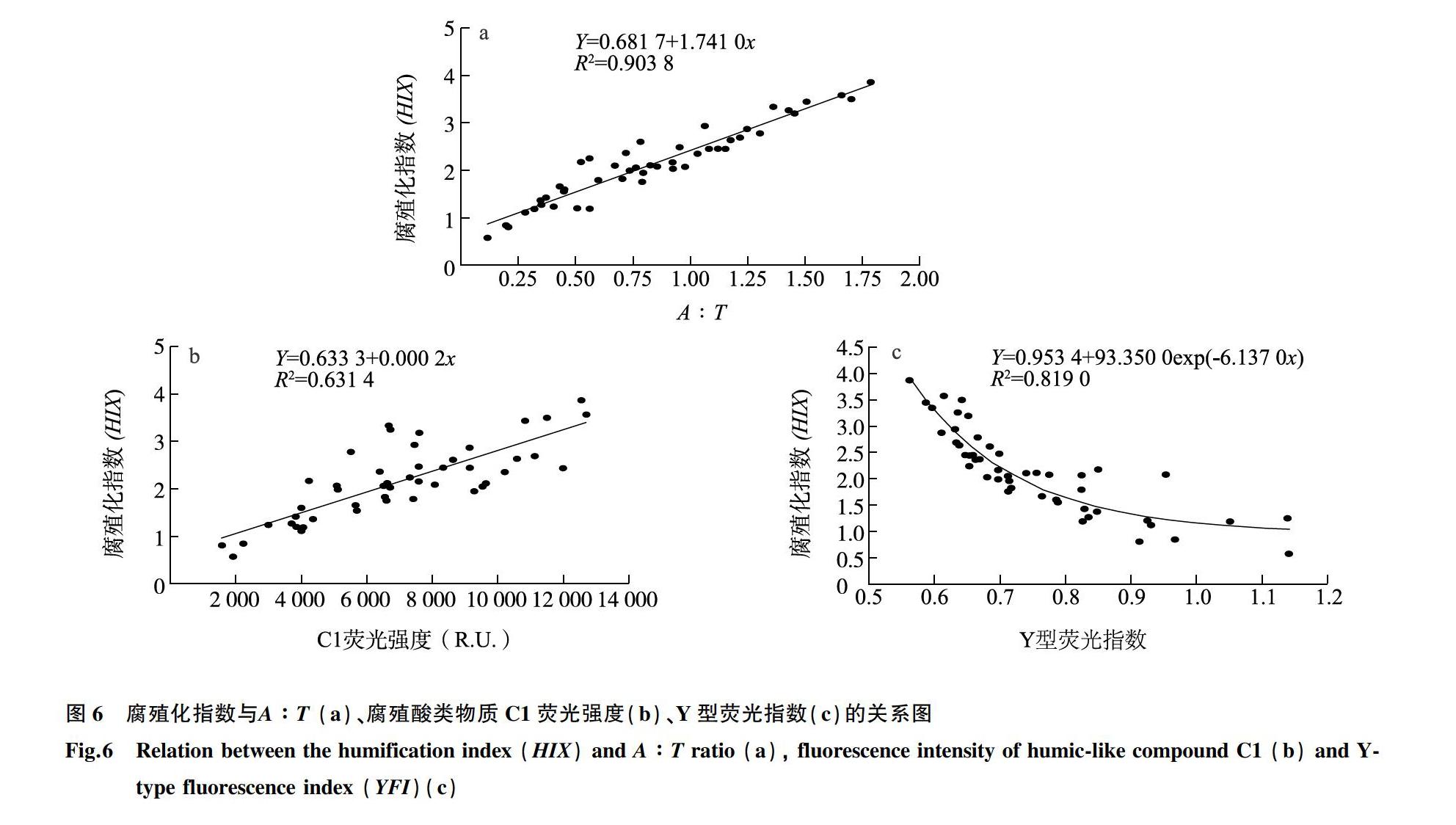
进一步通过皮尔逊相关系数(r)分析土壤表层(0~20.0 cm)DOM各种荧光指数(强度)的相关性,结果如表4所示。这些指数可综合使用,以进一步描述稻虾共作模式下土壤DOM特性。蛋白质类物质C3与其他荧光指数(强度)相关性均较弱(r<0.40)。尽管C2具有更高的DOM组分复杂性,腐殖质类物质C1和C2的高相关性,表明两者来源相同并经历类似的腐殖化进程。如A∶T的变化与HIX非常相似,均反映土壤DOM的腐殖化特性,A∶T与HIX表现出非常强的正相关性(r=0.952,P<0.001),并可被线性函数很好地拟合,R2Adj=0.903 8,如图6a所示。A∶T和HIX与腐殖质类物质C1和C2均呈现很强的正相关(r≈0.80,P<0.001),而与蛋白质C3相关性较低,C1荧光强度与HIX可被线性函数拟合,R2Adj=0.6314,如图6b所示。这表明土壤的腐殖化特征主要受内源有机质降解的影响,受外源蛋白质类物质(施加黄粉虫粪等有机肥)的影响较小。
β∶α与其他荧光指数(强度)的相关性均较弱,R≤0.40。相较于MFI,YFI更能反映土壤中DOM的腐殖化变化特性:YFI与C1荧光强度和C2荧光强度呈负相关,r值分别为-0.749(P<0.001)和-0.728(P<0.001),YFI与A∶T和HIX也呈负相关,r值分别达-0.787(P<0.001)和-0.834(P<0.001)。新产生的DOM(即较低的A∶T或HIX值),将具有较低的芳族含量和较高的荧光强度(即较高的YFI值),反之亦然。进一步分析HIX与YFI的关系,发现指数函数可较好拟合两者关系(R2Adj=0.819 0),如图6c所示,这表明土壤DOM荧光强度(YFI)主要受到腐殖化进程的影响。研究还发现,土壤DOC质量浓度与腐殖质物质C1(r=0.471,P<0.01)和C2(r=0.476,P<0.001)的荧光强度呈弱正相关,而DOC质量浓度与其他荧光指数的相关性均很弱(R<0.200)。这暗示,难以通过分析土壤溶解性有机碳含量来监测土壤有机质腐殖化程度。
3 结论
(1)通过三维荧光光谱耦合平行因子法(3DEEM-PARAFAC)分析,发现有机稻虾共作土壤DOM包括3个荧光组分,C1为较低相对分子质量的腐殖质类物质、C2为较高芳香度的UVC类腐殖质、C3为酪氨酸类物质,未发现高相对分子质量腐殖质类物质。0~20.0 cm表层土壤C1、C2组分荧光强度随采样时间的推迟呈先上升后下降趋势,峰值出现在水稻分蘖期或抽穗期,而C3组分荧光强度无明显变化规律。
(2)皮尔逊相关系数分析结果显示,腐殖质类物质C1荧光强度与C2荧光强度呈显著正相关(r=0.99,P<0.001),蛋白质类物质C3与其他荧光指数(强度)相关性均较弱(r<0.4)。HIX与C1荧光强度、A∶T表现出显著正相关,均可被线性函数拟合。相较于MFI,YFI更能反映土壤中DOM的腐殖化变化特性,YFI与HIX可被指数函数较好拟合。
(3)短期稻虾共作土壤的腐殖化特征主要受内源有机质降解影响,而受外源蛋白质类物质输入的影响较小,难以通过分析土壤溶解性有机碳含量来监测土壤有机质腐殖化程度。
参考文献:
[1] 农业农村部办公厅. 稻渔综合种养生产技术指南[农办渔(2020)11号]补标准号[EB/OL].(2020-03-31)[2020-11-08].http://www.gov.cn/zhengce/zhengceku/2020-04/03/content_5498676.htm.
[2] 曹凑贵,江 洋,汪金平,等. 稻虾共作模式的“双刃性”及可持续发展策略[J].中国生态农业学报, 2017, 25(9): 1245-1253.
[3] 肖求清. 稻虾共作对稻田生物多样性的影响[D].武汉:华中农业大学,2017.
[4] 程慧俊. 克氏原螯虾稻田养殖生态学的初步研究[D].武汉:湖北大学,2014.
[5] 佀国涵,彭成林,徐祥玉,等. 稻虾共作模式对涝渍稻田土壤理化性状的影响[J]. 中国生态农业学报,2017,25(1): 61-68.
[6] 奚业文,周 洵. 稻虾连作共作稻田生态系统中物质循环和效益初步研究[J]. 中国水产, 2016(3):78-82.
[7] 佀国涵. 长期稻虾共作模式下稻田土壤肥力变化特征研究[D]. 武汉:华中农业大学,2017.
[8] 杨佳波,曾希柏. 水溶性有机物在土壤中的化学行为及其对环境的影响[J]. 中国生态农业学报, 2007, 15(5): 206-211.
[9] 周江敏,代靜玉,潘根兴. 土壤中水溶性有机质的结构特征及环境意义[J]. 农业环境科学学报, 2003, 22(6): 731-735.
[10]赵劲松,张旭东,袁 星,等. 土壤溶解性有机质的特性与环境意义[J]. 应用生态学报, 2003, 14(1): 126-130.
[11]朱 杰,刘 海,吴邦魁,等. 稻虾共作对稻田土壤nirK反硝化微生物群落结构和多样性的影响[J]. 中国生态农业学报, 2018, 26(9): 1324-1332.
[12]SI G, PENG C, YUAN J, et al. Changes in soil microbial community composition and organiccarbon fractions in an integrated rice-crayfish farming system in subtropical China[J]. Scientific Reports, 2017, 7(1): 2856.
[13]刘赫群,李嘉尧,成永旭,等. 虾稻共作对稻田土壤线虫群落结构的影响[J]. 土壤, 2017, 49(6): 1121-1125.
[14]佀国涵,袁家富,彭成林,等. 稻虾共作模式氮和磷循环特征及平衡状况[J]. 中国生态农业学报, 2019, 27(9): 1309-1318.
[15]LI Q, XU L, XU L, et al. Influence of consecutive integrated rice-crayfish culture on phosphorus fertility of paddy soils[J]. Land Degradation & Development, 2018, 29(10): 3413-3422.
[16]孙自川. 稻虾共作下秸秆还田和投食对温室气体排放的影响[D]. 武汉:华中农业大学,2018.
[17]GAO J, LIANG C, SHEN G, et al. Spectral characteristics of dissolved organic matter in various agricultural soils throughout China[J]. Chemosphere, 2017, 176: 108-116.
[18]HUNT J F, OHNO T. Characterization of fresh and decomposed dissolved organic matter using excitation-emission matrix fluorescence spectroscopy and multiway analysis[J]. Journal of Agricultural and Food Chemistry, 2007, 55(6): 2121-2128.
[19]MURPHY K R, STEDMON C A, WENIG P, et al. OpenFluor- anonline spectral library of auto-fluorescence by organic compounds in the environment[J]. Analytical Methods, 2014, 6(3): 658-661.
[20]張广彩,于会彬,徐泽华,等. 基于三维荧光光谱结合平行因子法的蘑菇湖上覆水溶解性有机质特征分析[J]. 生态与农村环境学报, 2019, 35(7): 933-939.
[21]HANSEN A M, KRAUS T E C, PELLERIN B A, et al. Optical properties of dissolved organic matter (DOM): Effects of biological and photolytic degradation[J]. Limnology and Oceanogr-aphy, 2016, 61(3): 1015-1032.
[22]MCKNIGHT D, BOYER E, WESTERHOFF P, et al. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography, 2001, 46: 38-48.
[23]HEO J, YOON Y, KIM D H, et al. A new fluorescence index with a fluorescence excitation-emission matrix for dissolved organic matter (DOM) characterization[J]. Desalination and Water Treatment, 2016, 57(43): 20270-20282.
[24]MURPHY K R, STEDMON C A, GRAEBER D, et al. Fluorescence spectroscopy and multi-way techniques PARAFAC[J]. Analytical Methods, 2013, 5(23): 6557-6566.
[25]CHANTIGNY M H. Dissolved and water-extractable organic matter in soils: a review on the influence of land use and management practices[J]. Geoderma, 2003, 113(3): 357-380.
[26]COBLE P G. Marine optical biogeochemistry: the chemistry of ocean color[J]. Chemical Reviews, 2007, 107(2): 402-418.
[27]STEDMON C A, MARKAGER S, BRO R. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy[J]. Marine Chemistry, 2003, 82(3): 239-254.
[28]CHEN W, WESTERHOFF P, LEENHEER J A, et al. Fluorescence excitation-Emission matrix regional integration to quantify spectra for dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(24): 5701-5710.
[29]YAMASHITA Y, PANTON A, MAHAFFEY C, et al. Assessing the spatial and temporal variability of dissolved organic matter in Liverpool Bay using excitation-emission matrix fluorescence and parallel factor analysis[J]. Ocean Dynamics, 2011, 61(5): 569-579.
[30]SHUTOVA Y, BAKER A, BRIDGEMAN J, et al. Spectroscopic characterisation of dissolved organic matter changes in drinking water treatment: from PARAFAC analysis to online monitoring wavelengths[J]. Water Research, 2014, 54: 159-169.
[31]YAMASHITA Y, MAIE N, BRICEO H, et al. Optical characterization of dissolved organic matter in tropical rivers of the Guayana Shield, Venezuela[J]. Journal of Geophysical Research: Biogeosciences, 2010. Doi:10.1029/2009jg000987.
[32]DAINARD P G, GUGUEN C, MCDONALD N, et al. Photobleaching of fluorescent dissolved organic matter in Beaufort Sea and North Atlantic Subtropical Gyre[J]. Marine Chemistry, 2015, 177: 630-637.
[33]D′ANDRILLI J, FOREMAN C M, SIGL M, et al. A 21 000-year record of fluorescent organic matter markers in the WAIS Divide ice core[J]. Clim Past, 2017, 13(5): 533-544.
[34]YAMASHITA Y, BOYER J N, JAFF R. Evaluating the distribution of terrestrial dissolved organic matter in a complex coastal ecosystem using fluorescence spectroscopy[J]. Continental Shelf Research, 2013, 66: 136-144.
[35]RETELLETTI B S, KIM J H, RYU J S, et al. Exploring sediment porewater dissolved organic matter (DOM) in a mud volcano: clues of a thermogenic DOM source from fluorescence spectroscopy[J]. Marine Chemistry, 2019, 211: 15-24.
[36]KALBITZ K, SCHMERWITZ J, SCHWESIG D, et al. Biodegradation of soil-derived dissolved organic matter as related to its properties[J]. Geoderma, 2003, 113(3): 273-291.
[37]MARTINS O, DEWES T. Loss of nitrogenous compounds during composting of animal wastesa[J]. Bioresource Technology, 1992, 42(2): 103-111.
[38]EHNVALL B. Organic matter properties and their relation to phosphorus and nitrogen concentrations in Swedish agricultural streams[D]. Uppsala:Swedish University of Agricultural Sciences,2017.
(責任编辑:陈海霞)
