青藏高原金露梅茶对高血脂症大鼠肠道菌群的影响
2021-07-23李彩明张得宁刘力宽曲宣诏李锦萍龙主多杰
李彩明,张得宁 ,刘力宽,曲宣诏,李锦萍,龙主多杰,曾 阳,3,
(1.青海师范大学生命科学学院,青海西宁 810008;2.青海山水自然资源调查规划设计研究院(有限合伙),青海西宁 810000;3.高原科学与可持续发展研究院,青海西宁 810008)
高血脂症是血浆中的总胆固醇(cholesterol,TC)、甘油三酯(triglyceride,TG)与低密度脂蛋白胆固醇(low density lipoprotein,LDL)或高密度脂蛋白胆固醇(high density lipoprotein,HDL)异常的一种疾病,是诱发脑卒中、冠心病、动脉脂肪变性及非酒精性脂肪性肝炎(NASH)等心脑血管疾病的关键因素之一[1−2]。由于现代人的生活方式和高脂肪食品的过度摄入,导致目前高脂血症患者的数量不断增多且趋于年轻化,高血脂症的发病率在普遍上升[3]。
据研究,高脂饮食导致大鼠体内脂类代谢产生次级胆酸、硫化氢等产物增多,而破坏肠道微环境[4]。肠道微生物群的生存是从机体摄入的食物中获取营养和能量,同时产生代谢物,这些代谢物通过其同源受体发出信号来调节宿主代谢,胆汁酸就是一类这样的代谢物[5]。肠道菌群可通过间接调控胆汁酸代谢中的FXR信号通路[6],调整细胞脂肪酸的摄入来促进血脂在脂肪组织的储存,并分泌载脂蛋白,而改善高血脂症[7]。
金露梅(Potentilla fruticosaL.),蔷薇科(Rosaceae)委陵菜属(Potentilla)落叶灌木,产自青海、陕西、甘肃、西藏等地,生于山坡草地、砾石坡、灌丛及林缘,海拔1600~4000 m。其叶、花、根及全株均可入药[8]。《晶珠本草》记载金露梅可治妇女乳房胀满,《全国中草药汇编》记载其味甘、性凉,主治消化不良、浮肿、赤白带下、乳腺炎。金露梅的根、茎、叶、花和枝都具有非常强的药理活性[9−11],严培瑛等[12−14]研究发现,金露梅能够调节多种糖脂代谢相关激素的表达,部分恢复T2DM大鼠胰岛素水平及其中分离的化合物有抑菌等作用。李美华等[15]发现,金露梅水提物、95%甲醇提取乙酸乙酯萃取部位对α-淀粉酶、α-葡萄糖苷酶和醛糖还原酶的活性有较强的抑制作用,Rauf等[16]发现,金露梅有潜在的抗氧化特性、抗肿瘤特性和抗糖尿病作用,但是金露梅对高血脂症的研究,目前未见报道。
因此,本研究建立饮食性高血脂症Wistar大鼠模型,利用16S rDNA高通量测序方法检测分析Wistar大鼠的肠道菌群变化,探讨金露梅茶降血脂的可能机制,为青藏高原金露梅资源的有效合理利用提供科学依据。
1 材料与方法
1.1 材料与仪器
金露梅嫩叶、花 采集于青海省大通达坂山(海拔3006 m,37° 8' 42" N,101° 50' 32" E),经鉴定为金露梅(Potentilla fruticosaL.);SPF级Wistar雄性大鼠,体质量(170±10)g,批号:SCXK(京)2016-0011
购自北京维通利华实验动物技术有限公司;基础饲料、高脂饲料 购自北京维通利华实验动物技术有限公司;500 mL生理盐水 西安京西双鹤药业有限公司;TC、TG、LDL、HDL生化试剂盒 均购自南京建成生物工程研究所。
BS电子分析天平 上海友声衡器有限公司;超低温冰箱 Thermo Forma公司;高速冷冻离心机上海江东仪器厂;Bio-Rad XMARK全自动酶标仪美国伯乐生命医学产品(上海)公司;连续移液枪美国TOMOS公司;一次性96 孔板 德国 Greiner公司。
1.2 实验方法
1.2.1 金露梅茶及饮品的制备 课题组在传统制茶工艺及相关专利基础上稍做改进,制作金露梅茶[17],分别称取金露梅花茶、绿茶、红茶各50 g,加10 倍蒸馏水于加热套煮沸2 min,提取2 次,过滤,合并滤液,冷却至常温,得金露梅花茶、绿茶和红茶饮品,每天制备新鲜金露梅茶饮品待用。
1.2.2 金露梅茶的感官检测 样品中的感官检测依据本项目组制定金露梅茶企标Q/HQGQ0001S-2019 文件进行检测。
1.2.3 金露梅茶的重金属及水分、灰分测定 砷的测定按照GB 5009.11-2014 中茶叶类食品测定方法-氢化物发生原子荧光光谱法。铅的测定按照GB 5009.12-2017 中食品测定方法-石墨炉原子吸收光谱法。水分测定按照GB 5009.3-2016《食品中水分的测定方法》测定方法-直接干燥法。灰分按照准GB 5009.4-2016《食品中灰分的测定方法》中规定的方法。
1.2.4 高血脂症大鼠模型建立
1.2.4.1 造模方法 SPF级Wistar大鼠,普通饲料适应性喂养一周后称重,分为6 组,每组8 只,其中一组继续喂普通饲料,其余组开始喂高脂饲料。3 周后,称体重,随机再进行分组,除空白组外,其他各组大鼠采用特定高脂饲料进行饲养,并金露梅花茶、绿茶、红茶组大鼠将饮用水换成相应的金露梅花茶、绿茶、红茶饮品,空白、模型组给与相同量的饮用水,连续8 周,每周称量各组大鼠体重进行监测[18−19]。
1.2.4.2 指标测定 实验结束后,将大鼠麻醉,在超净工作台上对各组大鼠进行股动脉取血,收集血样,低温下进行离心,取血清保存于−20 ℃冰箱。TCHO、TG、HDL-C、LDL-C含量测定参照试剂盒说明书进行操作。
1.2.4.3 粪便收集 实验结束后,在超净工作台上,用提前消毒灭菌的冻存管收集各组大鼠粪便160 mg左右,快速置于液氮中冷冻,然后转入−80 ℃冰箱保存。所取样本送往北京诺禾致源科技股份有限公司进行16Sv4 区域测序分析。
测序分析过程如下:对送检样本进行DNA提取与检测,然后进行PCR扩增、产物纯化、文库制备及库检,基于IonS5TMXL测序平台,使用Cutadapt软件过滤和按barcode拆分样本后,进行OTUs(Operational Taxonomic Units)聚类和物种分类分析。根据OTUs聚类结果,一方面对每个OTU的代表序列做物种注释,得到对应的物种信息和基于物种的丰度分布情况。同时,对OTUs进行丰度、Alpha、Beta多样性计算及Venn图等分析,以得到样品内物种丰富度和均匀度信息、不同样品或分组间的共有和特有OTUs信息等。另一方面,根据物种注释结果,选取每个样品或分组在门、属分类水平(Phylum、Genus)上最大丰度排名前10 的物种,生成物种相对丰度柱形累加图,以便直观查看各样品在不同分类水平上,相对丰度较高的物种及其比例。
1.3 数据处理
结果均以每组动物的平均值±SD表示。采用SPSS 17.0 软件对所有数据进行统计学评价。采用组学数据处理方法进行基于有效数据的OTUs(Operational Taxonomic Units)聚类分析,再对所获得的OTU进行Alpha多样性和Beta多样性计算,结合t检验,以P<0.05 为阈值得出代表序列的物种注释、物种信息和基于物种的丰度分布情况。
2 结果与分析
2.1 金露梅茶的感官检测
感官指标检测结果为,花茶色泽标准为黄色,浸泡后汤色为黄色,红茶、绿茶色泽标准为绿黄色,浸泡后汤色为绿黄色,均无肉眼可见外来杂质,气味、滋味符合标准为清香醇和,滋味纯正。
2.2 金露梅茶重金属测定及水分、灰分测定
本实验用金露梅茶的重金属砷、铅含量在国家安全标准范围内,水分、灰分均符合国家标准,判定为合格,结果见表1。

表1 三种金露梅茶中水分、灰分和重金属的含量Table 1 Contents of water,ash and heavy metals in three kinds of Potentilla fruticosa tea
2.3 大鼠的一般行为学观察
连续喂养11 周后,各组大鼠体重无明显差异,空白对照组的大鼠精神状态良好,反应迅速敏捷,毛发有光泽,食量、排便量正常,模型组与对照组大鼠相比,精神状态和反应明显下降,毛发较粗糙且有少许脱落,进食量、排便量等均较对照组稍低,金露梅茶组与模型组相比,精神状态较好、毛色光滑,反应灵敏。
2.4 血脂四项测定结果
对实验各组大鼠血清中的TG、TC、LDL和HDL进行测定,结果见表2。由表2 可知,长期给予高脂饲料,模型组大鼠血液内TG、TC和LDL的含量较空白组明显上升,HDL含量明显下降。与模型组比较,金露梅花茶、绿茶、红茶组大鼠TG、TC含量显著下降(P<0.05 或P<0.01),LDL含量均下降,仅金露梅花茶差异显著(P<0.05),HDL含量均升高,金露梅红茶组差异显著(P<0.05)。说明金露梅茶可以调节高脂血症大鼠血液内 TG、TC、HDL、LDL的含量,课题组前期发现,金露梅茶能够调节多种糖脂代谢相关激素的表达[12],可能与金露梅茶含有丰富的营养物质有关。

表2 三种金露梅茶对大鼠血清生化指标的影响(n=8,x±SD)Table 2 Effects of three kinds of Potentilla fruticosa tea on serum biochemical indexes of rats(n=8,x±SD)
2.5 粪便肠道菌群16S rDNA高通量测序分析
2.5.1 各组肠道菌群总数OTU聚类与注释结果经OTU数据为计算依据构建VENN图进行菌群多样定性分析发现,喂养普通饲料组(K)与高脂饲料组(M)相比,共同含有的Core microbiome为1529 个,占到两组总数的70.8%。表明高脂饲料喂养大鼠8 周后,大鼠肠道菌群发生改变,有220 个OTU消失,同时产生了409 个特有的OTU。
与空白组相比,模型组OTU数升高;各给药组菌群的OTU值与模型组相比均有所下降,但差异不显著(P>0.05)。表明长期喂养高脂饲料使大鼠的肠道菌群OTU数量增加,金露梅茶干预后,OTU数量下降,说明金露梅茶的干预减少了肠道菌群的菌种数量和种类。而金露梅花茶组、绿茶组、红茶组与正常对照组的共有序列分别为1514 条、1471 条、1489 条;同时,高血脂模型组的OTU中有3.0%在其他组中没有出现,正常对照组和金露梅花茶组、绿茶组、红茶组干预组的这一数值分别是4.2%和2.8%、7.4%、5.7%。提示高血脂模型组大鼠肠道菌群多样性可能受到了一定影响,金露梅茶对肠道菌群具有一定的调节作用(表3、图1)。

表3 各组细菌总数OTU聚类与注释结果Table 3 OTU clustering and annotation results of total bacterial count in each group
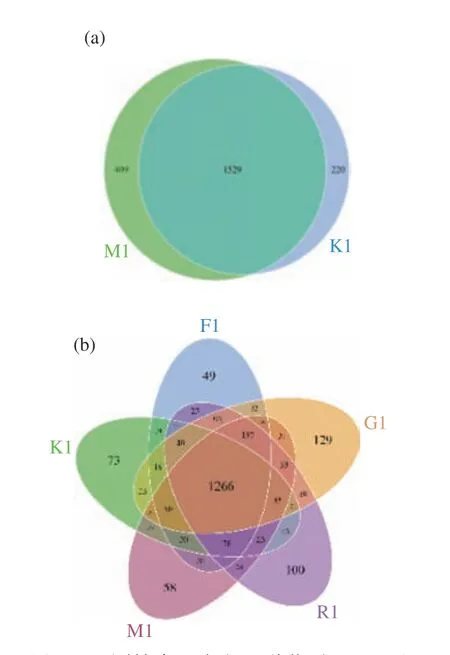
图1 不同饮食组大鼠肠道菌群Venn图Fig.1 Venn diagram of gut microbiota of different diet groups of rats
经PCA主成分分析,高脂饮食后,模型组与空白组的主成分区域较为明显地分开;各饮茶组与模型组主成分区域基本分开,表明不同茶组之间的肠道菌群存在差异,可调节高脂饲料喂养大鼠的肠道菌群结构(图2)。

图2 不同饮食组大鼠肠道菌群主成分分析Fig.2 Principal component analysis (PCA) of gut microbiota of different diet groups of rats
2.5.2 各组肠道微生物多样性与丰富度分析 Alpha Diversity用于分析样品内(Within-community)的微生物群落多样性,可以反映样品内的微生物群落的丰富度和多样性。Shannon和Simpson指数是同时考虑到物种丰富度和均匀度的多样性指数,Goods_coverage指数反应了测序的深度,稀释曲线(Rarefaction Curve)可直接反映测序数据量的合理性,并间接反映样品中物种的丰富程度,本研究中测定结果表明各组的样本测序深度已基本覆盖所有样品物种,丰富度较高(表4、图3)。同时通过T-test检验,wilcox秩和检验和Tukey检验分析组间物种多样性差异,结果显示高血脂模型组的肠道菌群多样性有所降低,而金露梅花茶、绿茶、红茶对恢复菌群多样性具有较好的调节作用,但各组间差异不显著(P>0.05)。模型组与空白组、金露梅茶组之间肠道菌群组成结构存在明显差异(表4、图4)。
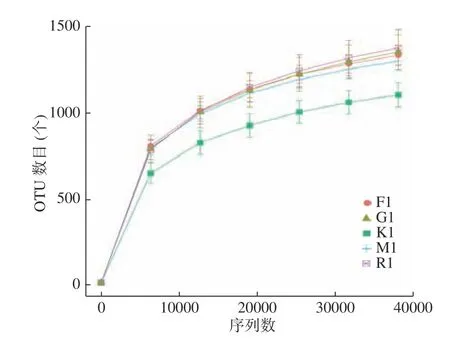
图3 不同饮食组大鼠肠道菌群聚类稀释曲线Fig.3 Cluster dilution curve of differences between groups of different diet groups of rats

图4 不同饮食组大鼠组间差异分析的箱型图Fig.4 Box diagram for analysis of differences between groups of different diet groups of rats
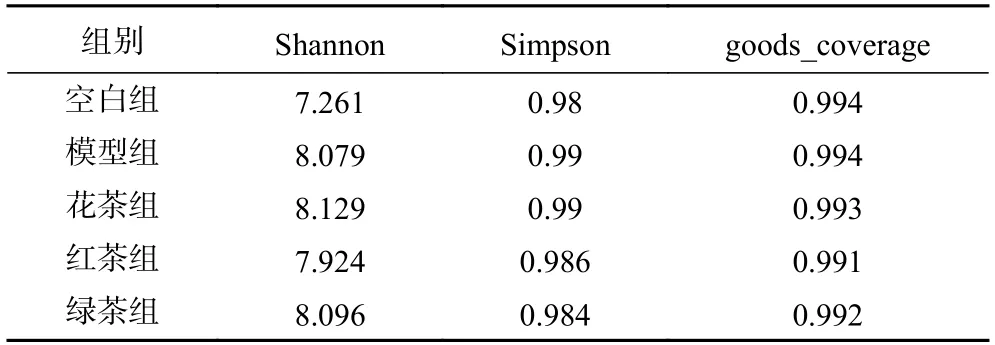
表4 Alpha Diversity分析相关指数Table 4 Alpha diversity analysis correlation index
2.5.3 各组在不同分类水平上的物种组成
2.5.3.1 门水平上各组肠道微生物丰度分析 各组大鼠肠道微生物在门水平上的构成处于前5 位的依次为:Firmicutes、Bacteroidetes、Tenericutes、Proteobacteria、unidentified_Bacteria。其 中,Firmicutes、Bacteroidetes是肠道中的优势菌群,经过分析发现,给予金露梅茶干预后,大鼠的Firmicutes丰度较模型组有所减少,Bacteroidetes的丰度与模型组相比增加。表明饮用金露梅茶可减少高脂饲料喂养大鼠的Firmicutes的丰度,增加Bacteroidetes的丰度(图5A)。
2.5.3.2 属相对丰度分析 与空白组比较,模型组大鼠肠道微生物在属水平上的构成处于前5 位组成丰度发生明显变化,Bacteroides、unidentified_Ruminococcaceae、unidentified_Clostridiales、Bacteroide丰度明显上升,Lactobacillus丰度下降,经金露梅花茶、绿茶、红茶干预后,大鼠肠道内Lactobacillus、Bacteroide丰度明显增加,而unidentified_Ruminococcaceae、unidentified_Lachnospiraceae丰度则明显下降(图5B)。

图5 大鼠肠道微生物相对丰富度Fig.5 Relative abundance of gut microbiota at species level of rats
3 讨论与结论
在中国,茶文化已有数千年,深刻影响着人们的生活习惯。在本研究中,模拟人饮茶习惯,分别给与大鼠普通饮用水及冲泡的茶水,研究金露梅茶对高血脂症的影响。研究结果显示,金露梅茶可不同程度地降低高脂饲料喂养大鼠的总胆固醇含量、甘油三酯含量、低密度脂蛋白胆固醇含量,升高高密度脂蛋白胆固醇含量,其原因可能是金露梅茶中含有的丰富的营养成分对机体产生的调节作用[20],同时研究数据显示,给予金露梅茶干预后,大鼠的厚壁菌门(Firmicutes)丰度较模型组有所减少,拟杆菌门(Bactercidetes)的丰度与模型组相比增加,与已有文献报道,肥胖或糖尿病患者一般表现为Firmicutes相对丰度增加,Bacteroidetes相对丰度减少,B/ F比值降低,药物干预后则表现为Firmicutes丰度减少,Bacteroidetes丰度增加结论一致[21−23]
同时本实验数据显示,与模型组相比,金露梅茶组乳杆菌属(Lactobacillus)、拟杆菌属(Bacteroides)丰度增加,毛螺菌科中未分类的属(unidentified_Lachnospiraceae)、瘤胃菌科中未分类的属(unidentified_Ruminococcaceae)丰度降低,关于文献报道,unidentified_Lachnospiraceae在肥胖动物肠道中具有更高的丰度,可能具有潜在的促肥胖作用[24]。Lactobacillus可通过增加抗炎因子IL-10 含量、提高肝脏GSH-Px、SOD和CAT活性,降低了MDA的活性,而减轻胰岛和腺泡细胞病变情况;同时,可影响Adipoq mRNA的表达水平;而Lactobacillus丰度的增加,会影响Bacteroidetes/Firmicutes的丰度比值而降低小鼠的血糖水平等机制参与糖脂代谢而产生降糖降脂的作用[25−26]。
文献报道,拟杆菌属(Bacteroides)、乳杆菌属(Lactobacillus)及双歧杆菌属(Bifidobacterium)可通过释放胆盐水解酶(bile salt hydrolase,BSH)而调节甘氨酸或牛磺酸以及游离胆汁酸调控脂质代谢的分子机制[26−27],这可能也是金露梅茶具有降血脂作用的潜在机制,具体机制有待进一步的研究。
综上,本研究表明青藏高原金露梅茶能够调节高血脂模型大鼠表型的血脂四项指标,机制可能是其上调有益肠道菌群而抑制有害肠道菌群,使菌群的数量及比例发生变化,通过影响高血脂大鼠的脂质代谢而起到调节高脂血症的作用。金露梅花茶、绿茶、红茶具有调节高脂血症大鼠血脂及肠道菌群谱的作用,使其有向正常对照组恢复的趋势,推测金露梅茶可能经肠道菌群干预脂质代谢途径发挥降血脂的功效,具体机制有待进一步研究。
