一种复方中草药对阿尔兹海默症模型小鼠认知功能障碍及肠道菌群的影响
2021-07-23张维捷谢兴非
张维捷,谢兴非,闫 鹤
(华南理工大学食品科学与工程学院,广东广州 510000)
阿尔兹海默症是中枢神经系统一种常见的进行性神经退行性疾病,患者主要有认知功能障碍、记忆力逐渐衰退、行为异常及社交障碍等症状[1−2]。目前全球有超过4600 万人受阿尔兹海默症影响(alzheimer’s disease,AD)[3],但仍没有对阿尔兹海默症的治疗方法。
近年来越来越多的研究表明肠道菌群失调对脑缺血、帕金森病、阿尔茨海默病等中枢神经系统疾病的发生发展产生重要影响[4]。有研究表明阿尔兹海默症患者相比于正常人其肠道菌群的物种丰富度和多样性都有所降低,其中双歧杆菌丰度显著减少[5]。此外,阿尔兹海默症患者体内的促炎细胞因子IL-1β、IL-6、CXCL2 和NLRP 3 水平相对较高,抗炎细胞因子IL-10 水平相对较低[6]。而阿尔兹海默症患者肠道菌群中大肠杆菌与志贺氏菌(Escherichia/Shigella)的丰度比值与促炎细胞因子IL-1β、CXCL 2 和NLRP 3 的水平呈正相关;直肠真杆菌(E.rectale)的丰度与IL-1β、CXCL 2 和NLRP 3 水平呈负相关,与IL-10 呈正相关[7]。肠道菌群组成的改变可能导致肠道屏障和血脑屏障通透性增加,另外有些肠道菌群还会产生淀粉样蛋白、脂多糖和其他毒素,促进炎症反应及对大脑的毒性作用,进而影响大脑功能[8−13]。另外肠道菌群还可能直接通过合成各种神经递质和神经调节剂(如5-羟色胺、褪黑素和γ-氨基丁酸)影响大脑的功能[14]。Akbari等[15]的研究显示补充嗜酸乳杆菌(Lactobacillus acidophilus)、干酪乳杆菌(Lactobacillus casei),双岐杆菌(Bifidobacterium bifidum)的阿尔兹海默症患者中血浆MDA和血清hs-CRP水平显著降低,且其认知功能、炎症反应和代谢状态得到改善。综上可知,肠道菌群与阿尔兹海默症有紧密联系,且某些特定肠道菌群可能是治疗阿尔兹海默症的助剂。
包括多种药食同源成分的复方中草药如复方C地黄、开心散、益智汤等可能通过多种作用机制发挥对阿尔兹海默症的改善作用。前人研究发现开心散可显著降低东莨菪碱所致的小鼠脑组织一氧化氮合酶表达升高,抑制胆碱酯酶活性,说明开心散可能具有调节胆碱能神经系统活动的功能从而起到保护神经元、促进记忆的作用,并在AD治疗中发挥优势[16]。此外,益智汤能显著增高老年性痴呆模型大脑皮质和海马锥体细胞的尼氏体含量,改善学习记忆关键脑区的神经元结构,从而发挥神经元营养和保护作用[17]。逍遥散是由白术、茯苓、白芍等包含多种食品成分组成的一种传统复方中草药,有研究发现逍遥散亦可通过调节脑部乙酰胆碱酯酶的活性来达到防治阿尔兹海默症的作用[18]。另外,沈小丽等[19]研究发现逍遥散通过提高盲肠处动物乳杆菌(Lactobacillus animali)、伯克霍尔德氏菌(Burkholderiales bacterium)的相对丰度来调节抑郁模型大鼠的肠道功能。但逍遥散对阿尔兹海默症模型肠道菌群的作用还知之甚少。
本研究采用Morris水迷宫行为学试验检测小鼠认知功能的变化、并对小鼠粪便菌群基因组16S rRNA V4~V5 区进行系统分析,旨在探究以逍遥散为基础的复方中草药(Compound Chinese Herbal Medicine,CCHM)对肠道菌群的调节作用,进而基于肠道菌群探究其改善阿尔兹海默症症状的机制。
1 材料与方法
1.1 材料与仪器
试验小鼠:SPF级APP/PS-1 双转基因雄性C57BL/6 小鼠8 只(灰黑色)、同批出生野生型正常C57BL/6 小鼠5 只 广东省南模中心提供,许可证号:SCXK(粤)2015-0001,饲养于暨南大学实验动物管理中心,在有充足食物与水,温度为(23±2) ℃和湿度为 45%±10% 的空间里以12 h光照处理/12 h黑暗处理的周期进行培养,动物实验是按照中国动物实验监督委员会制定的指导方针进行的;复方中草药是一个以逍遥散方为基础的复方,由组分Ⅰ和组分Ⅱ两部分组成:组分Ⅰ是逍遥散方(主要包含八种中草药:北柴胡30 g、当归30 g、白芍30 g、白术30 g、茯苓30g、甘草15 g、生姜10 g、薄荷10 g)的提取产物;组分Ⅱ为绿茶提取物,主要活性物质为绿茶多酚,茶多酚含量为50%,儿茶素含量为44%,没食子酸酯含量为18%,咖啡因含量为8%;QIAmp DNA Stool Mini Kit、Qiagen Gel Extraction Kit纯化试剂盒 德国Qiagen公司。
Gene Amp PCR system 2700 美国Applied Biosystem公司;核酸电泳仪、Gel Doc EQ凝胶成像系统 美国BIO-RAD公司;NanoDrop 2000、高速离心机 美国Thermo公司;HiSeq 2000 DNA测序仪 美国Illumina公司。
1.2 实验方法
1.2.1 中草药提取 参考刘伟[20]的试验方法进行组分Ⅰ的提取,流程包括:取适量中草药与蒸馏水以1:10(W:V)混合,浸泡2 h;水煎2 h,收集水煎液;向药渣中加入8 倍体积的蒸馏水再提取2 次,每次水煎1 h即可;合并3 次水煎液,50 ℃下浓缩至膏状,喷雾干燥成干粉并包装。其提取物的主要活性成分包括阿魏酸(0.05 mg/g)、芍药苷(4.88 mg/g)和橙皮苷(5.14 mg/g)等。参考Cheng等[21]提供的试验方法进行组分Ⅱ中绿茶多酚的提取。
1.2.2 动物分组及处理 将野生型(wild-type,WT)正常小鼠设为WT组(n=5);AD模型小鼠随机分成两组:一组为AD组(n=5),另一组为CCHM组(n=3),并接受复方中草药的灌胃。根据之前研究复方中草药对抑郁动物模型治疗效果最佳的使用剂量[22]确定该实验剂量为:组分Ⅰ 164.6 mg/(kg·d) 和组分Ⅱ 15.625 mg/(kg·d)。干预前,使用无菌水将中草药粉末调至适当浓度(组分Ⅰ:41.15 mg/mL,组分Ⅱ:7.82 mg/mL),保存于4 ℃冰箱备用。经过8 周的复方中草药干预后,将3 组小鼠进行行为学测试初步检验干预效果。并在末次中草药灌胃24 h后收集各组小鼠粪便样本,保存于−80 ℃冰箱,每组随机挑选三只小鼠粪便样本用于16S rRNA基因高通量测序。
1.2.3 行为学实验 参照文献方法[23−24]进行行为学Morris水迷宫实验,分别采用逃避潜伏期、穿越目标平台次数等指标衡量小鼠认知功能。水迷宫直径120 cm,高50 cm,站台直径9 cm,高30 cm,水面高于站台1 cm,水中加入适量白色食用色素,使小鼠看不到平台及池底,水池温度维持在22~24 ℃,摄像头位于水池正上方,调整池面摄像头,使其视野覆盖整个水池,电脑系统设定游泳时间(80 s)和平台上停留时间(15 s),选择小鼠实验模式,调整红线圆圈使之分别准确框定水池及平台范围,向水池内注入自来水,为避免环境对小鼠的判断产生干扰,调整灯光以免水面反射,四周墙壁杜绝挂物,室内务必保持安静。实验主要分为两部分:一是定向航行实验,即设置平台,每天灌胃后1 h内进行,每只小鼠面对池壁投入水中,记录小鼠自入水到稳定爬上平台所需时间(即逃避潜伏期)。小鼠若能在80 s内爬上站台并稳定站立15 s,记录实用时间;若入水后80 s内未能找到站台并站立15 s,记录80 s,可将动物引导上站台稳定站立15 s后拿下来,休息30~60 s再进行下一次训练,共训练5 d,第6 d记录逃避潜伏期;二是空间探索实验,即撤除站台,观察小鼠在一定时间(30 s)内穿越原站台次数,从第7 d开始,进行空间探索实验,记录小鼠站台穿越次数。
1.2.4 肠道菌群16S rRNA V4~V5 区高通量测序首先,对粪便前处理,采用QIAmp DNA Stool Mini Kit基因组提取试剂盒提取粪便细菌基因组;其次,对粪便细菌16S rRNA的V4~V5 区进行扩增;然后将样品委托给上海美吉生物医药科技有限公司进行建库、测序;最后,基于有效测序数据进行OTUs(Operational Taxonomic Units)聚类和物种分类分析。对OTUs聚类结果进行Alpha多样性(Shannon和Chao1 指数)和Beta多样性分析。其中Beta多样性分析通过基于Bray_curtis距离矩阵的PCoA直观展示各样品间差异大小。为进一步挖掘各组间肠道微生物差异,选用单因素方差分析(one-way analysis analysis of variance,ANOVA)对各组物种进行差异统计检验。最后基于PICRUSt 2 软件通过 KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库比对,对肠道微生物功能进行预测以及差异统计检验。
1.3 数据处理
选用SPSS 25.0 统计软件对行为学实验结果和粪便差异物种进行单因素方差分析(ANOVA),P<0.05 认为具有统计学差异。
2 结果与分析
2.1 复方中草药干预后AD模型小鼠行为学的变化
Morris水迷宫实验反映出小鼠的认知功能比变化,主要评价指标包括逃避潜伏期和穿越目标平台次数;逃避潜伏期短,穿越目标平台次数多说明小鼠认知能力强,反之则弱。如表1 所示,经过8 周的复方中草药干预后,CCHM组小鼠相比于AD组小鼠其逃避潜伏期缩短(P<0.05),穿越平台次数显著增加(P<0.05),并且结果接近于WT组,表明该复方中草药能提高阿尔兹海默症模型小鼠的学习记忆能力。综上可推测,复方中草药对阿尔兹海默症症状的改善有一定的推动作用。
表1 各组小鼠行为学结果()Table 1 Behavioral results of mice in each group ()
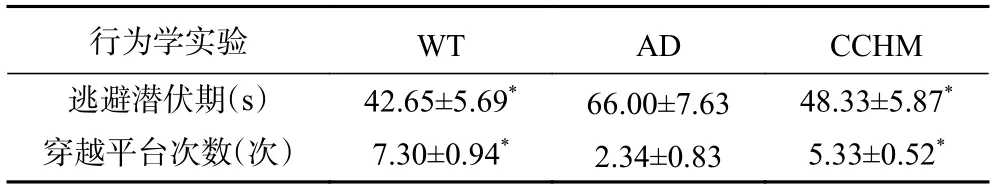
表1 各组小鼠行为学结果()Table 1 Behavioral results of mice in each group ()
注:*表示与AD组相比差异显著,*P<0.05;WT:野生型对照;AD:阿尔兹海默症;CCHM:复方中草药;图4、图6同。
2.2 复方中草药对肠道菌群的影响
2.2.1 复方中草药干预对肠道粪便菌群多样性的影响 Alpha多样性的大小决定了微生物菌群的丰富度和均匀性。Chao1 指数是丰富度估计量;而Shannon指数是计算菌群多样性;包含物种间个体分配的均匀性以及物种数两部分。指数值越大,代表群落丰富度与多样性程度越高。如图1 所示,相比于WT组,AD组Shannon与Chao1 指数显著降低(P<0.05),表明AD组Alpha多样性更低,但经8 周的复方中草药干预后菌群Alpha多样性显著升高(P<0.05)。与Strati等[25]的研究结果一致,表明健康组微生物的多样性和丰富度都较高,并且复方中草药的干预可以提高肠道物种的丰富度和多样性。
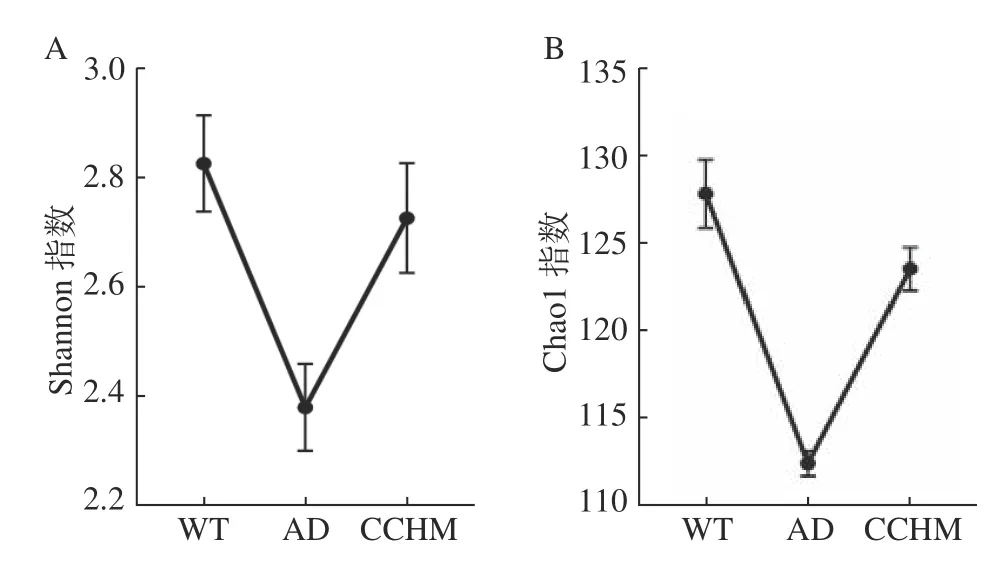
图1 各组粪便样品物种丰富度与多样性Fig.1 Species richness and diversity of fecal samples in each group
2.2.2 复方中草药对肠道菌群结构的调节作用 进一步通过PCoA直观展示各个样品间的差异大小,PCoA是一种研究数据相似性或者差异性的可视化方法,如果两个样品距离较近,则表示这两个样品的物种组成较相近。基于Bray_curtis距离矩阵的PCoA可以直观看出三组间粪便菌群结构不同,AD组和WT组菌群结构存在差异;经8 周复方中草药干预后,CCHM组粪便菌群结构偏离AD组,并接近于WT组(图2)。这说明AD模型小鼠菌群结构异于正常小鼠的菌群结构,而复方中草药干预可以改善AD模型小鼠菌群结构。
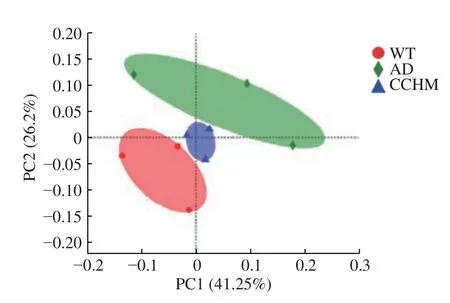
图2 基于OTU水平的β-多样性分析Fig.2 Analysis of β-diversity on the OTU level
2.2.3 复方中草药干预后肠道优势物种的变化 如图3 所示,各组小鼠肠道优势OTU主要属于:拟杆菌目S24-7 菌科(Bacteroidales_S24-7_group:OTU107、OTU237、OTU86、OTU18、OTU39、OTU215、OTU125)、毛螺菌科(Lachnospiraceae:OTU75、OTU168、OTU99、OTU377、OTU332、OTU311)、理研菌科(Rikenellaceae:OTU24)、脱硫弧菌属(Desulfovibrio:OTU265)、Marvinbryantia(OTU318)、布劳特氏菌属(Blautia:OTU81、OTU206)、乳酸菌属(Lactobacillus:OTU391)、别样杆菌属(Alistipes:OTU361)、螺杆菌属(Helicobacter:OTU399)、不动杆菌属(Acinetobacter:OTU306)、拟普雷沃菌属(Alloprevotella:OTU241)、乳梭菌属(Lachnoclostridium:OTU363)、Erysipelatoclostridium(OTU62)。相比于WT组,AD组中某些优势OTU相对丰度发生变化,如OTU107、OTU124、OTU265 和OTU18 等,复方中草药干预后群落OTU得到了调整且趋近于WT组,该结果与菌群的Alpha及Beta多样性分析结果相一致。而通过单因素方差分析发现复方中草药对AD模型小鼠粪便菌群中的优势OTU没有显著影响。
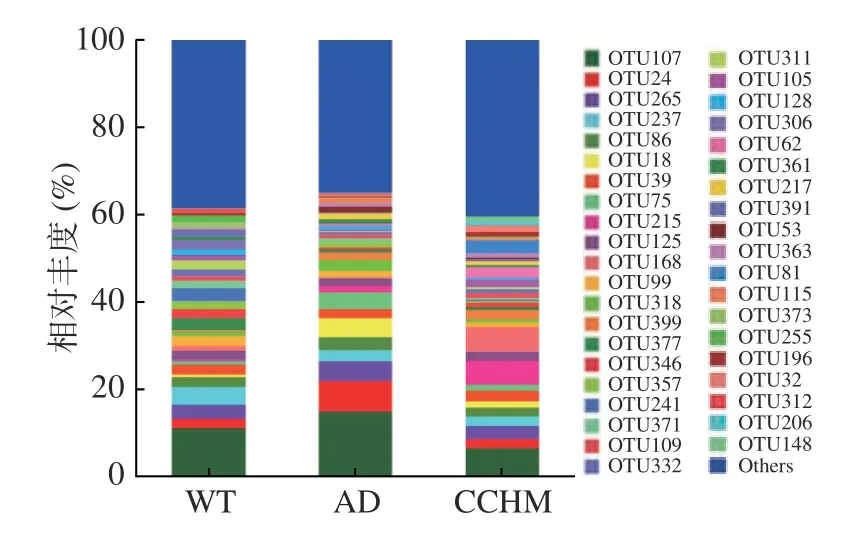
图3 各组大鼠肠道菌群OTU水平相对丰度Fig.3 Relative abundance of dominant OTUs in microbial communities from different groups
2.2.4 复方中草药干预后肠道特定微生物丰度的变化 为进一步探究各组间物种的差异,进行了OTU水平单因素方差分析,结果如图4 所示,相比于WT组,AD组中OTU345、OTU380(Lachnospiraceae)、OTU22(Enterorhabdus)、OTU374(Roseburia)、OTU401(Enterorhabdus)、OTU264(Bacteroidales_S24-7_group)相对丰度显著降低(P<0.05),经复方中草药干预后丰度增加,其中OTU345、OTU380 和OTU264 达到显著性水平(P<0.05)。此外,通过对三组小鼠肠道菌群科水平进行分析,同样发现相比于WT组Lachnospiraceae相对丰度在AD组中明显降低,而复方中草药干预后丰度显著增加(图5A、B)。之前研究结果表明相比于健康人群,阿尔兹海默症患者肠道菌群中Lachnos piraceae丰度降低[26]。Lachnospiraceae具有强大的产丁酸盐能力[27],丁酸盐作为一种多功能分子,可保护神经并改善脑健康。在创伤性脑损伤小鼠模型中,向腹膜内注射丁酸盐能够减轻神经功能缺损、脑水肿、神经元改变和血脑屏障损伤,从而达到神经保护作用[28]。在小鼠的AD模型中,丁酸盐对学习和记忆有显著改善,并使得学习相关的基因表达增加[29−30]。在CCHM组中显著增加的OTU264 属于Bacteroidales_S24-7_group,该菌科丰度在模型组中降低可贡献拟杆菌门丰度降低,进而导致厚壁菌门与拟杆菌门比例失调(图5C),该比例失调与神经性疾病的发生存在着重要联系[31]。因此由以上结果可推断,复方中草药可能通过调节特定物种的丰度来改善AD模型小鼠认知功能障碍。
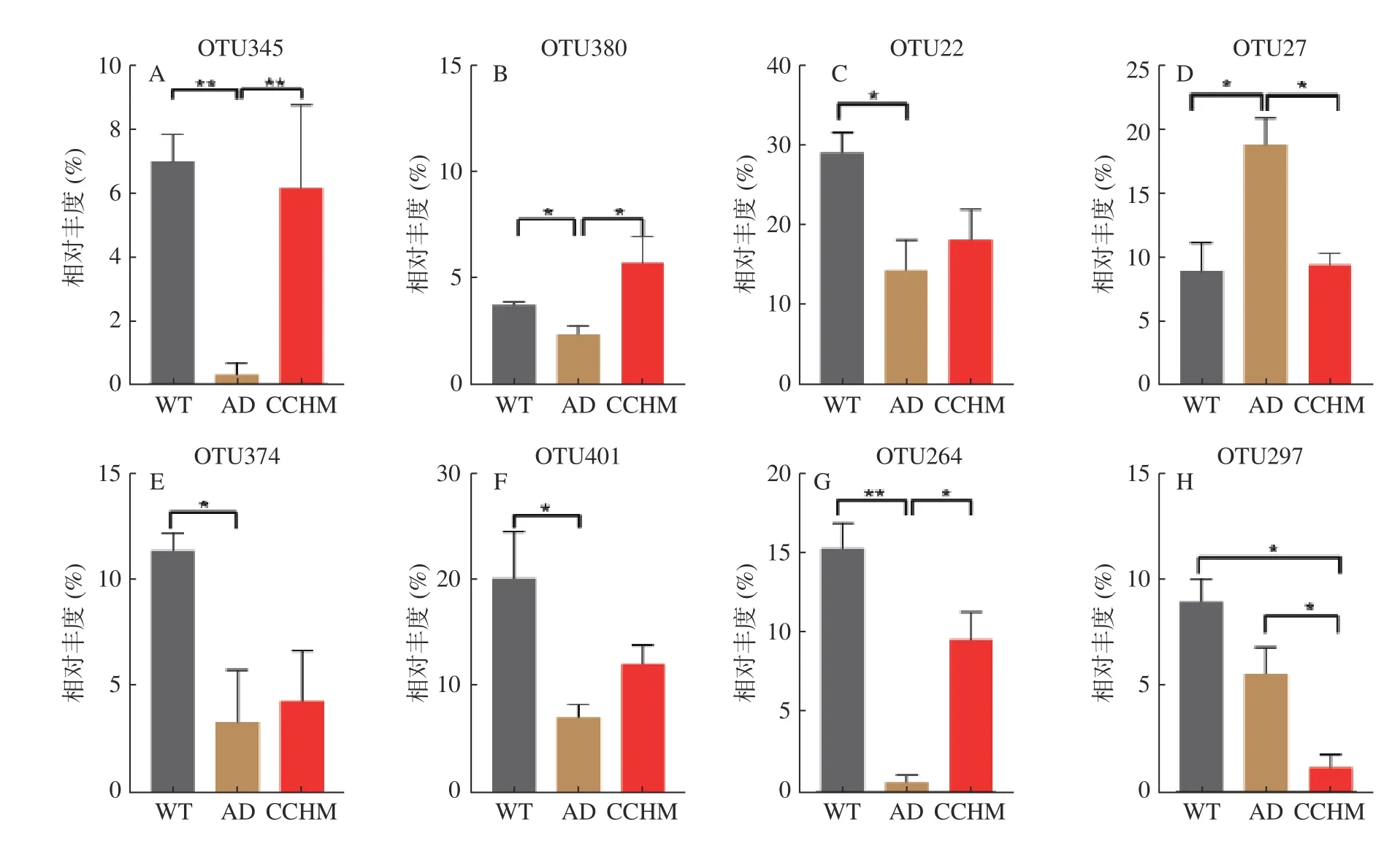
图4 三组小鼠基于OTU水平的相对丰度比较Fig.4 Comparison of relative abundance at the OTU level between four groups
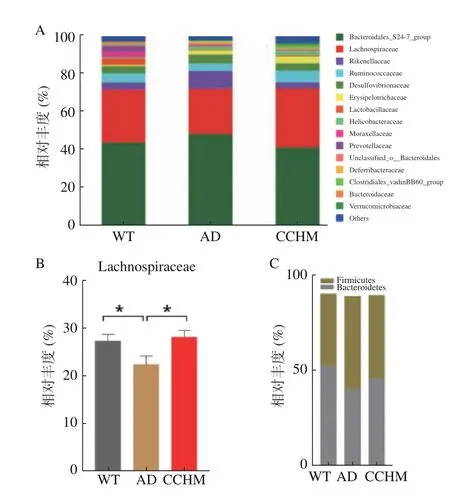
图5 三组小鼠粪便微生物相对丰度比较Fig.5 Comparison of relative abundance of fecal microorganisms among three groups of mice
2.2.5 复方中草药干预后肠道特定微生物功能丰度的变化 基于PICRUSt2 软件将每个OTU对应的Greengene ID与KEGG(Kyoto Encyclopedia of Genes and Genomes)功能数据库进行比对,获得281 个预测功能,利用单因素方差分析对不同组功能丰度进行统计,P值小于0.05 认为具有统计学意义。统计分析得到10 个具有显著差异的功能(图6)。相比于WT组,组氨酸代谢、精氨酸和脯氨酸代谢、烟酸及烟酰胺代谢、维生素B6代谢、氧化磷酸化作用、脂肪酸代谢、生物素代谢、脂肪酸生物合成等在AD模型组中显著上升,而复方中草药的干预可以减少这些功能的丰度。其中在AD模型组中氨基酸代谢的差异与Zheng等[32]的精神疾病小鼠肠道微生物氨基酸代谢紊乱的结论相一致。因此由结果可知,AD模型小鼠的肠道微生物功能与WT组差异较大,而通过复方中草药的干预可以调节肠道菌群组成结构,进而缓解菌群代谢功能上的紊乱。
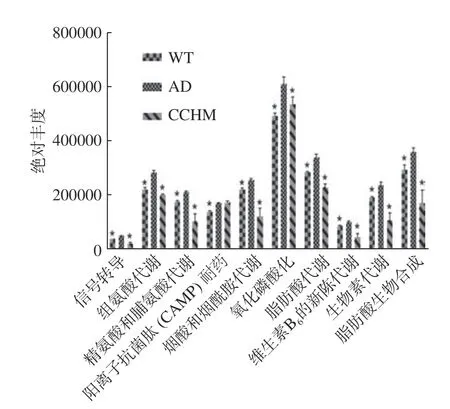
图6 三组小鼠肠道微生物显著差异的功能比较Fig.6 Comparison of significantly different gut microbial functions among three groups
3 结论
以逍遥散为基础的复方中草药可以改善APP/PS-1 双转基因AD模型小鼠认知功能障碍,且能调节肠道菌群组成、结构及特定物种的丰度,如复方中草药显著提高了OTU345、OTU380 和OTU264的丰度(P<0.05),其中OTU345、OTU380 注释到可产生丁酸盐的毛螺菌科(Lachnospiraceae)。另外还能一定程度上缓解由AD引起的肠道微生物功能紊乱。由此说明复方中草药可通过调节肠道菌群的结构、组成和功能,缓解AD症状,进一步为其使用提供了理论依据。
