锰氧化菌激活及生物氧化锰去除乙炔基雌二醇试验研究
2021-07-22翟俊夏亦寒成水平田雨王泉峰
翟俊 夏亦寒 成水平 田雨 王泉峰

摘 要:利用污水廠好氧污泥进行锰氧化细菌的激活试验,探究pH值以及初始Mn2+浓度对激活效果的影响,采用高通量测序技术分析激活前后微生物群落变化,利用X射线衍射(X-ray diffraction,XRD)技术对产生的生物氧化锰进行表征,研究pH值和投加量对生物氧化锰去除乙炔基雌二醇(17α-ethinylestradiol,EE2)的影响。结果表明:pH值为7、初始Mn2+浓度为1 mmol/L时,Mn2+氧化率7 d内能达到83.3%,锰氧化菌激活效果最好。XRD结果表明:生物氧化锰主要含有MnO2、Mn3O4、Na3Mn(PO3)CO3等3种成分。高通量测序结果表明:经过激活后,芽孢杆菌属(0.75%)、不动杆菌属(1.26%)、假单胞菌属(1.36%)、鞘氨醇杆菌属(1.81%)、黄杆菌属(2.39%)、微杆菌属(2.97%)、气单胞菌属(7.35%)的丰度显著增加,典型的锰氧化细菌菌属总丰度达到17.89%。EE2在反应pH值为4.0、生物氧化锰投加量为20 mg/L的条件下去除效果最好,48 h后EE2的去除率可达97.7%,其中,生物氧化锰对EE2的去除率可达76.9%。
关键词:乙炔基雌二醇;锰氧化菌;高通量测序;生物氧化锰
中图分类号:X522 文献标志码:A 文章编号:2096-6717(2020)04-0154-08
收稿日期:2020-09-26
基金项目:国家自然科学基金(51878093)
作者简介:翟俊 (1977- ),男,教授,博士生导师,主要从事废水处理理论与技术研究,E-mail:zhaijun99@126.com。
Received:2020-09-26
Foundation item:National Natural Science Foundation of China (No. 51878093)
Author brief:ZHAI Jun (1977- ), professor, doctorial supervisor, main research interests: wastewater treatment theory and technology, E-mail: zhaijun99@126.com.
Activation of manganese-oxidizing bacterium and removal of 17 α-ethinylestradiol by biogenic manganese oxides
ZHAI Jun1, XIA Yihan1, CHENG Shuiping2, TIAN Yu1, WANG Quanfeng1
(1. College of Environment and Ecology, Chongqing University, Chongqing 400045, P. R. China; 2. College of Environmental Science and Engineering, Tongji University, Shanghai 200092, P. R. China)
Abstract: Aerobic sludge from the wastewater treatment plant was sampled as inoculation bacteria, and the effects of pH and initial Mn2+ concentration on the activation of manganese-oxidizing bacterium were studied. High-throughput sequencing technology was used to analyze the variation of microbial communities before and after activation. On this basis, the biogenic manganese oxides produced by manganese-oxidizing bacterium were characterized by X-ray diffraction. Besides, the effects of pH and biogenic manganese oxides dosage on the removal of EE2 by biogenic manganese oxides were analyzed. The results show that the best activation effect of manganese oxidizing bacterium is obtained when the initial Mn2+ concentration is 1 mmol/L at pH 7.0 and 83.3% Mn2+ is transformed into biogenic manganese oxides after 7 days under this condition. XRD results show that the biogenic manganese oxides produced mainly include MnO2, Na3Mn(PO3)CO3, and Mn3O4. According to the results of high-throughput sequencing, the abundance of Bacillus(0.75%), Acinetobacter(1.26%), Pseudomonas(1.36%), Sphingobacterium(1.81%), Flavobacterium(2.39%), Exiguobacterium(2.97%), Areomonas(7.35%) increases significantly, and the total relative abundance of typical manganese-oxidizing bacterium reaches 17.89%. When the biogenic manganese oxides dosage is 20 mg/L at pH 4.0, EE2 has the best removal efficiency. After 48 h, the removal rate of EE2 reaches 97.7%, in which 76.9% is removed by biogenic manganese oxides.
Keywords:17α-ethinylestradiol; manganese-oxidizing bacterium; high-throughput sequencing; biogenic manganese oxides
乙炔基雌二醇(17α-ethinylestradiol,EE2)是一种典型的人工合成类固醇雌激素,主要应用于治疗脱发症、乳腺癌、前列腺等疾病,其中,大量未被人体利用的EE2以及代谢物会排放进入环境[1]。据统计,目前中国自然水体内的EE2浓度为5.7~70 ng/L[2-4]。然而,即使在如此低浓度的条件下,EE2也会对环境中非目标生物的生长、发育以及繁殖产生明显影响,甚至会通过食物链富集对生态安全和人类健康产生潜在威胁[5]。
污水处理厂是污水中各种污染物去除的主要场所,但其设计的初衷并不是为了完全去除有机药物,因此,对EE2的去除率较低,且吸附于污泥的EE2容易造成二次污染[6]。目前的EE2处理工艺,如高级氧化、膜工艺及过滤法等,虽然有较好的去除效果,但因其能耗较大及毒性副产物产生等问题,大规模应用受到限制[7],因此,开发低环境风险的EE2处理技术具有重要的环境意义。
生物氧化锰是微生物(锰氧化细菌或真菌)氧化Mn2+而生成的一种无定形矿物[8]。大量研究表明,生物氧化锰具有优异的吸附和氧化性能,能够有效去除环境中许多种类的有机和无机污染物[8]。因此,利用生物氧化锰去除EE2具有较大的应用前景。锰氧化细菌(manganese-oxidizing bacterium,MnOB)可以通过直接[9-10]和间接氧化[11-12]两种机制实现对Mn2+的氧化。例如,MnOB可以分泌胞外锰氧化因子(如多糖、蛋白質)直接催化氧化Mn2+[9-10]。另外,MnOB自身生长代谢活动导致的环境条件改变(如提高pH值和DO)会加速Mn2+的化学氧化过程,实现间接氧化[11-12]。相关研究表明,温度、pH值、Mn2+浓度等因素均会影响MnOB的活性[13],进而对生物氧化锰的生成产生影响。但关于这些条件对MnOB及生物氧化锰去除EE2效果的影响还鲜有报道。
笔者以污水厂好氧污泥作为菌源,在不同pH值及初始Mn2+浓度条件下对MnOB进行激活。利用XRD对最优激活条件下生成的生物氧化锰进行分析,并通过高通量测序分析激活反应前后微生物群落的变化,以生物氧化锰为氧化剂,研究pH值和投加量对生物氧化锰去除EE2的影响,研究结果可为生物氧化锰去除EE2提供技术支持。
1 材料与方法
1.1 试验材料
菌源:试验菌源取自重庆豪洋水务沙坪坝排水公司氧化沟好氧段污泥。培养基采用Leptothrix培养基[14],根据试验需要加入一定量的Mn2+(MnCl2·4H2O),缓冲溶液为MES缓冲溶液(pH值为5.0及6.0)或HEPES缓冲溶液(pH值为7.0及8.0)。
1.2 试验设计
1.2.1 MnOB激活
将5%的好氧污泥接种于100 mL培养基中,pH值分别设置为5.0、6.0、7.0、8.0,体系初始Mn2+浓度为1 mmol/L,设置3个平行,于28 ℃、转速140 r/min的摇床中避光培养7 d。定期对体系内Mn2+浓度、生物氧化锰浓度进行测定。
研究初始Mn2+浓度的影响时,操作同上,pH值为试验得到的最优pH值,初始Mn2+浓度设置为0.5、1、2.5、5、10 mmol/L,其他条件同上。
将菌源接种至培养基中,在上述试验得到的最优pH值及Mn2+浓度下培养7 d。取适量菌悬液,用无菌水清洗,并以2 000 r/min离心10 min,以去除杂质,重复以上步骤10次,所得样品部分在4 ℃冰箱中保存,以用于后续EE2去除试验。其余样品进行纯化程序,获得纯化生物氧化锰用于XRD分析。纯化程序为[15]:样品在10 mL苯酚中超声提取45 min,并以50∶50苯酚∶氯仿、氯仿和12∶5∶3甲醇∶氯仿∶水为溶剂提取10 min。用无菌水冲洗样品10次,并酸化至pH值为3。以150 r/min离心30 min,
去上清液,在0.17% NaOH溶液中振荡4 h,最后,用无菌水清洗样品10次,保存备用。
纯化后得到的生物氧化锰经冷冻干燥(-50 ℃)、研磨、过筛,进行XRD表征。此外,为分析激活前后微生物群落的变化,在激活反应前后,取适量污泥样品,提取总DNA后进行16SrDNA高通量测序。
1.2.2 生物氧化锰去除EE2
取最优激活条件下产生的生物氧化锰进行EE2去除试验。根据不同pH值设置为5组,体系pH值分别为4.0、5.0、6.0、7.0、8.0,生物氧化锰浓度为20 mg/L,有机药物浓度为1 mg/L。每组试验取3次平行试验的平均值作为试验数据。此外,为了排除体系中生物相对有机药物去除的贡献,每组试验设置一个对照组。对照组通过加入50 μL 10%抗坏血酸以使生物氧化锰溶解,其余条件同上,定期取样对体系内EE2浓度进行测定。
研究生物氧化锰投加量的影响时,体系pH值为试验得到的最优pH值,分别控制体系的生物氧化锰浓度为5、10、20 mg/L,其余试验及测试条件同上。
1.3 测试方法
1.3.1 化学测试方法
采用高碘酸钾分光光度法[16]进行Mn2+浓度的测定。采用亮柏蓝分光光度法[17]进行生物氧化锰浓度的测定。采用液相色谱法进行EE2浓度的测定,其中:色谱柱为Eclipse XDB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈和水,体积比为60∶40;进样量20 μL;流速1.0 mL/min;柱温26 ℃;检测波长205 nm;保留时间2.977 min。
1.3.2 XRD表征
采用布鲁克D8 ADVANCE X射线衍射仪对生物氧化锰进行物相分析,其测试条件为Cu kα辐射源,扫描范围为10°~90°(2θ),扫描速率2.0 (°)/min,步幅0.02°。
1.3.3 微生物多样性分析
混合液离心后去上清液,按照PowerSoil DNA试剂盒说明提取总DNA,随后用核酸浓度测定仪测定样品DNA浓度(NanoDrop2000,美国Thermo Fisher Scientific公司)。对检测合格的DNA进行PCR扩增后进行16SrDNA高通量测序(上海美吉生物技术有限公司)。PCR扩增引物为338F(3-ACTCCTACGGGAGGCAGCAG-5)及806R(3-GGACTACHVGGGTWTCTAAT-5)[18]。PCR产物片段验证采用2%琼脂糖凝胶电泳。
2 结果与讨论
2.1 MnOB激活
2.1.1 pH值的影响
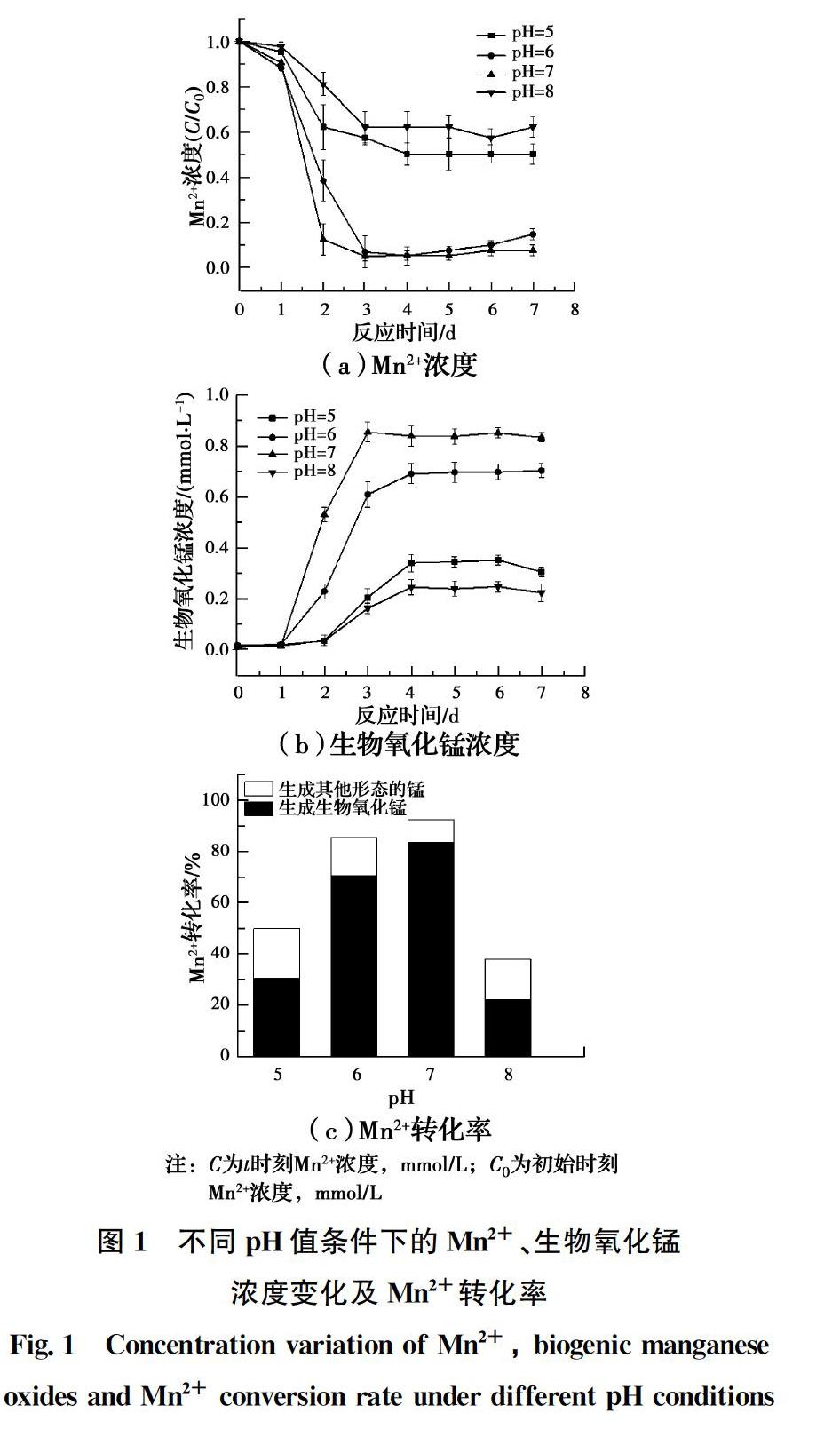
不同pH值条件下,Mn2+、生物氧化锰浓度变化及Mn2+转化率见图1。反应7 d后,Mn2+及生物氧化锰浓度均达到稳定,激活反应完成。在pH值为7.0时,7 d后体系内Mn2+去除率达到92.4%,而Mn2+的氧化率达到83.3%,氧化率显著高于其他试验组,以激活反应完成后Mn2+的氧化率作为衡量激活反应效果的指标,pH值为7.0时,MnOB激活效果最好,这与Zhou等[19]及崔馨文[20]的研究结果一致。在试验pH值范围内,Mn2+的氧化主要是生物氧化而非生物化学氧化,因为pH值小于9时动力学上不利于Mn2+的化学氧化[21]。因此,pH值对Mn2+氧化速率的影响主要是对MnOB活性的影响,中性条件对MnOB的生长更
有利[20],这可能是中性条件下Mn2+的氧化率高的主要原因。因此,在研究初始Mn2+浓度的影响时,控制pH值为7.0。
2.1.2 初始Mn2+浓度的影响
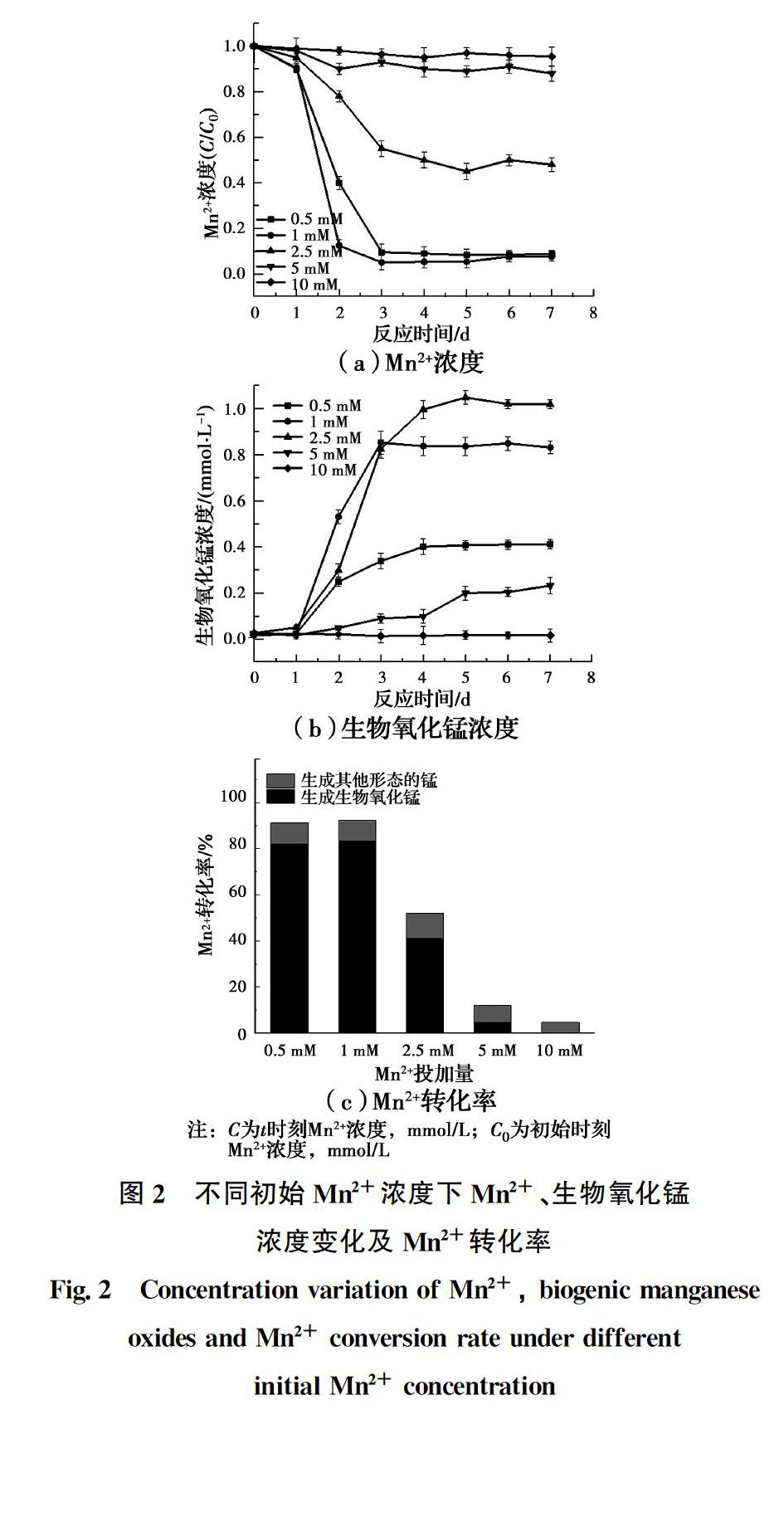
不同初始Mn2+浓度下,Mn2+、生物氧化锰浓度变化及Mn2+转化率见图2。反应7 d后体系的Mn2+及生物氧化锰浓度均达到稳定,激活反应完成。初始Mn2+浓度为1 mmol/L时,7 d后Mn2+去除率达到92.4%,其中,90.15%转化为生物氧化锰,Mn2+的氧化率达到83.3%,而初始Mn2+浓度为2.5 mmol/L时,虽然生物氧化锰的生成量最高,但其Mn2+的氧化率较低,因此,以激活反应完成后Mn2+的氧化率作为衡量激活反应效果的指标,初始Mn2+浓度为1 mmol/L时,MnOB激活效果最好。而当初始Mn2+浓度高于
5 mmol/L时,Mn2+利用较差,MnOB受到极大的抑制,此时MnOB激活失败。崔馨文[20]对来自好氧污泥的MnOB进行Mn2+抗性研究时发现,地衣芽胞杆菌(Bacillus megaterium)及巨大芽孢杆菌(Bacillus licheniformis)在Mn2+浓度高于8 mmol/L时均不能生长。Zhou等[19]发现高浓度Mn2+对海洋沉积物中MnOB同样有抑制作用,这与试验结果一致。
2.2 生物氧化锰的XRD表征
XRD测试结果如图3所示。样品的2θ角特征峰出现在19.823°、20.962°、26.580°、36.501°、34.776°、59.890°等处。通过与相应矿物的标准XRD卡片进行对比可以确定,MnOB激活产生的生物氧化锰主要包含MnO2、Na3Mn(PO3)CO3、Mn3O4等化合物。Zhou等[19]在对海洋沉积物中的MnOB生成的生物氧化锰进行XRD分析时,也发现了Na3Mn(PO4)CO3。Chubar等[22]研究发现,Shewanella putrefaciens产生的Mn3(PO4)2、MnCO3会通过离子交换和表面络合形成Na3Mn(PO3)CO3,这可能是生物氧化锰中未发现MnCO3的原因。
MnOB激活产生的生物氧化锰主要包含MnO2、Na3Mn(PO3)CO3、Mn3O4等化合物,與化学合成的氧化锰相比,生物锰氧化物具有更好的氧化和吸附能力[8],另外,生物锰氧化物可以在锰氧化微生物作用下进行持续再生[15],因此,生物锰氧化物在污染物的处理效果和成本上比化学合成锰氧化物更有优势。
2.3 微生物群落的变化
在最优条件下,激活反应前后各取适量生物样品进行16SrDNA高通量测序,并对数据样本进行alpha多样性分析,以探究微生物多样性的变化。微生物16SrDNA的alpha多样性指数表见表1。由表1可以看出,激活反应前后Chao指数、ACE指数及Shannon指数减小,Simpson指数增大,说明激活反应前后群落的丰富度及多样性均在下降。
为了确定主导生物氧化锰生成的微生物,对比了相对丰度显著提高的属与目前已知存在MnOB的菌属。结果表明,激活反应后有9种菌属的相对丰度显著提高,其中,有7种已证明存在的MnOB属,包括变形菌门中的气单胞菌属[23](Aeromonas)、假单胞菌属[24](Pseudomonas)、不动杆菌属[25](Acinetobacter)、厚壁菌门中的芽孢杆菌属[24](Bacillus)、微杆菌属[26](Exiguobacterium)、拟杆菌门中的黄杆菌属[27](Flavobacterium)、鞘氨醇杆菌属[26](Sphingobacterium),上述菌属的相对丰度变化情况见图4。其相对丰度在激活反应后分别增加了7.2%、1.34%、1.1%、0.75%、2.96%、2.33%、1.47%,总相对丰度由0.74%增加至17.89%,这表明试验成功激活了环境样本中的MnOB。此外,两种未报道存在MnOB的菌属,包括变形菌门的从毛单胞菌属(Comamonas)和嗜氢菌属(Hydrogenophaga),其相对丰度在激活反应后也显著增加,分别从0.06%、0.5%增加到1.60%、0.83%,说明这两个属中也可能存在可以氧化Mn2+的细菌,也可能是两个属中存在对高浓度Mn2+较为耐受的微生物。
2.4 生物氧化锰去除EE2
2.4.1 pH值的影响
图5为不同pH值条件下EE2的去除情况。图中,pH值为4.0时,试验组(生物氧化锰+生物相)对EE2的去除率达到97.7%,其中,生物氧化锰的贡献率达到76.9%,去除效果最好。随着pH值的升高,试验组对EE2的去除效果逐渐变差,pH值为8.0时生物氧化锰对EE2的去除效果显著降低,这与郭淑文[28]和孔祥震[29]的研究结果一致。这可能是由于pH值的增加会降低锰氧化物的表面电子转移速率及产物脱附速率。此外,由于生物氧化锰对EE2的去除可能引起EE2从生物相解吸附,这可能解释了试验组初始阶段EE2浓度的上升。
2.4.2 生物氧化锰投加量的影响
基于试验结果,在研究生物氧化锰投加量的影响时,控制pH值为4.0。图6为不同生物氧化锰投加量下EE2的去除情况。试验结果表明,生物氧化锰投加量为20 mg/L时,试验组(生物氧化锰+生物相)对EE2去除效果最好,去除率达到97.7%,其中生物氧化锰的贡献率为76.9%。生物氧化锰投加量越大,试验组去除率越大,生物氧化锰对EE2去除的贡献率也越大,这是由于投加量的增加会增加去除反应结合位点,促进反应的进行。与之类似,生物氧化锰的增加同样增加了生物相的质量,因此,提高了生物相对EE2的吸附率。
3 结论
从氧化沟好氧段污泥中能够激活富集得到锰氧化菌群。当培养条件pH值为7.0、初始Mn2+浓度为1 mmol/L时,MnOB的激活效果最好,其对Mn2+的氧化率能够达到90.15%。生成的生物氧化锰主要包含MnO2、Na3Mn(PO3)CO3、Mn3O4等3种物质。激活反应后,7个已知存在的MnOB属,包括芽孢杆菌属、微杆菌属、气单胞菌属、假单胞菌属、不动杆菌属、黄杆菌属、鞘氨醇杆菌属,丰度显著提高,激活反应后,其总丰度达到17.89%。pH值为4.0、生物氧化锰投加量为20 mg/L时,EE2的去除效果最好,48 h后试验组(生物氧化锰+生物相)对EE2的去除率可达97.7%,其中生物氧化锰的贡献率达到76.9%。在中性条件下,试验组对EE2的去除率低于酸性条件,但仍可以达到85%,这为生活污水中的EE2的去除提供了一个高效可行的方向。参考文献:
[1] ZHANG A, LI Y M, CHEN L. Distribution and seasonal variation of estrogenic endocrine disrupting compounds,N-nitrosodimethylamine, and N-nitrosodimethylamine formation potential in the Huangpu River, China [J]. Journal of Environmental Sciences, 2014, 26(5): 1023-1033.
[2] ALMEIDA , SILVA M G, SOARES A M V M, et al. Concentrations levels and effects of 17alpha-Ethinylestradiol in freshwater and marine waters and bivalves: A review [J]. Environmental Research, 2020, 185: 109316.
[3] 王欣. 内分泌干扰物分析方法优化及在禽畜粪便堆肥过程中的降解特征[D]. 上海: 上海交通大学, 2018.
WANG X. Optimization of analytical methods for endocrine disrupting chemicals and degradation in manure composting process [D]. Shanghai: Shanghai Jiaotong University, 2018. (in Chinese)
[4] ZHAO X M, GRIMES K L, COLOSI L M, et al. Attenuation, transport, and management of estrogens: A review [J]. Chemosphere, 2019, 230: 462-478.
[5] 周秋紅, 龙天渝, 何靖, 等. 锰铁改性针簇莫来石对水中BPA和EE2的去除[J]. 环境科学, 2020, 41(2): 763-772.
ZHOU Q H, LONG T Y, HE J, et al. Removal of BPA and EE2 from water by Mn-Fe embedded in acicular mullite [J]. Environmental Science, 2020, 41(2): 763-772. (in Chinese)
[6] MAURCIO R, SEMEDO F, DIAS R, et al. Efficacy assessment of peracetic acid in the removal of synthetic 17α-ethinyl estradiol contraceptive hormone in wastewater [J]. Journal of Environmental Sciences (China), 2020, 89: 1-8.
[7] 翟俊, 王熔, 黄泽金, 等. 异化Mn(Ⅳ)还原菌激活及其对有机药物去除[J]. 中国环境科学, 2019, 39(1): 298-305.
ZHAI J, WANG R, HUANG Z J, et al. Activation of Dissimilatory Mn(IV) reducing bacteria and their removal of typical pharmaceuticals [J]. China Environmental Science, 2019, 39(1): 298-305. (in Chinese)
[8] HE Z F, WEI Z, ZHAO Y H, et al. Enhanced performance of tetracycline treatment in wastewater using aerobic granular sludge within situ generated biogenic manganese oxides [J]. Science of the Total Environment, 2020, 735: 139533.
[9] DICK G J, CLEMENT B G, WEBB S M, et al. Enzymatic microbial Mn(II) oxidation and Mn biooxide production in the Guaymas Basin deep-sea hydrothermal plume [J]. Geochimica et Cosmochimica Acta, 2009, 73(21): 6517-6530.
[10] FRANCIS C A, TEBO B M. Enzymaticmanganese(II) oxidation by metabolically dormant spores of diverse Bacillus species [J]. Applied and Environmental Microbiology, 2002, 68(2): 874-880.
[11] 邓加聪, 林晓芳, 赖露, 等. 鞘细菌对锰离子的转化作用研究[J]. 广州化工, 2019, 47(21): 72-74.
DENG J C, LIN X F, LAI L, et al. Study on Transformation of Manganese by Sheath bacteria [J]. Guangzhou Chemical Industry, 2019, 47(21): 72-74. (in Chinese)
[12] SHOIFUL A, KAMBARA H, CAO L T T, et al.Mn(II) oxidation and manganese-oxide reduction on the decolorization of an azo dye [J]. International Biodeterioration & Biodegradation, 2020, 146: 104820.
[13] NECULITA C M, ROSA E. A review of the implications and challenges of manganese removal from mine drainage [J]. Chemosphere, 2019, 214: 491-510.
[14] GUO J, GUO H, LIU J, et al.Manganese(II) oxidizing bacteria as whole-cell catalyst for β-keto ester oxidation [J]. International Journal of Molecular Sciences, 2020, 21(5): 1709.
[15] TRAN T N, KIM D G, KO S O. Synergistic effects of biogenic manganese oxide andMn(II)-oxidizing bacterium Pseudomonas putida strain MnB1 on the degradation of 17 α-ethinylestradiol [J]. Journal of Hazardous Materials, 2018, 344: 350-359.
[16] 水質锰的测定 高碘酸钾分光光度法: GB 11906—1989 [S]. 北京: 中国标准出版社, 1989.
Water quality-Determination of manganese-Potassium periodate spectrophotometric method: GB 11906—1989 [S]. Beijing: Standards Press of China, 1989. (in Chinese)
[17] MARTNEZ-RUIZ E B, COOPER M, FASTNER J, et al. Manganese-oxidizing bacteria isolated from natural and technical systems remove cylindrospermopsin [J]. Chemosphere, 2020, 238: 124625.
[18] 彭宇科, 路俊玲, 陈慧萍, 等. 蓝藻水华形成过程对氮磷转化功能细菌群的影响[J]. 环境科学, 2018, 39(11): 4938-4945.
PENG Y K, LU J L, CHEN H P, et al. Dynamic changes of nitrogen-transforming and Phosphorus-accumulating bacteria along with the formation of cyanobacterial blooms [J]. Environmental Science, 2018, 39(11): 4938-4945.(in Chinese)
[19] ZHOU H, PAN H X, XU J Q, et al. Acclimation of a marine microbial consortium for efficient Mn(II) oxidation and manganese containing particle production [J]. Journal of Hazardous Materials, 2016, 304: 434-440.
[20] 崔馨文. 锰氧化细菌的分离鉴定及其锰氧化能力的研究[D]. 哈尔滨: 哈尔滨工业大学, 2014.
CUI X W. Isolation, identification of manganese-oxidizing bacte-rium and its manganese oxidation characteristics[D]. Harbin: Harbin Institute of Technology, 2014. (in Chinese)
[21] ZHANG J H, LION L W, NELSON Y M, et al. Kinetics of Mn(II) oxidation by Leptothrix Discophora SS1 [J]. Geochimica et Cosmochimica Acta, 2002, 66(5): 773-781.
[22] CHUBAR N, AVRAMUT C, VISSER T. Formation of manganese phosphate and manganese carbonate during long-term sorption of Mn2+ by viable Shewanella putrefaciens: effects of contact time and temperature [J]. Environmental Science: Processes & Impacts, 2015, 17(4): 780-790.
[23] RYANG P K, SEO K J. A study on the manganese oxidation and characteristics of Aeromonas sp. MN44 [J]. Journal of Life Science, 2005, 15(1): 94-99.
[24] TEBO B M, JOHNSON H A, MCCARTHY J K, et al. Geomicrobiology of manganese(II) oxidation [J]. Trends in Microbiology, 2005, 13(9): 421-428.
[25] HOSSEINKHANI B, EMTIAZI G. Synthesis and characterization of a novel extracellular biogenicmanganese oxide (bixbyite-like Mn2O3) nanoparticle by isolated acinetobacter sp [J]. Current Microbiology, 2011, 63(3): 300-305.
[26] 趙焱, 李冬, 曾涛涛, 等. 锰氧化还原菌Exiguobacterium sp·MB4酶学特性研究[J]. 黑龙江大学自然科学学报, 2009, 26(5): 647-651.
ZHAO Y, LI D, ZENG T T, et al. Enzyme characteristics of manganese redox bacteriumExiguobacterium sp MB4 [J]. Journal of Natural Science of Heilongjiang University, 2009, 26(5): 647-651. (in Chinese)
[27] BROMFIELD S M, SKERMAN V B D. Biological oxidation of manganese in soils [J]. Soil Science, 1950, 69(5): 337-418.
[28] 郭淑文. 生物氧化锰对双酚A和乙炔基雌二醇的氧化降解研究[D]. 重庆: 重庆大学, 2014.
GUO S W. Preparation of biogenic manganese oxides and oxidative degradation of bisphenol A and 17α-ethynylestradiol [D]. Chongqing: Chongqing University, 2014. (in Chinese)
[29] 孔祥震. 生物锰氧化物的制备及对17α-乙炔雌二醇处理效能研究[D]. 哈尔滨: 哈尔滨工业大学, 2013.
KONG X Z. Preparation of biogenic manganese oxides and treat-ment performance of 17α-ethynylestradiol [D]. Harbin: Harbin Institute of Technology, 2013.(in Chinese)
(编辑 胡玲)
