薯蓣皂苷元改善类风湿关节炎模型大鼠关节肿胀的效果及作用机制研究
2021-07-22张华燕何援军
张华燕,何援军
(浙江衢化医院,浙江 衢州 324004)
类风湿关节炎(rheumatoid arthritis,RA)是以炎性细胞浸润为特征,导致滑膜、关节软骨及骨退变的一种慢性全身性自身免疫性疾病[1],具有发病率高、病程长、难治愈、致残率高的特点,10%的患者会在数年内丧失劳动力[2-3]。RA早期表现为关节游走性疼痛及功能障碍,晚期则表现为关节僵硬与畸形[4]。由于RA的病因与发病机制尚不明确,而抗生素类药物在本病治疗中效果有限,并存在一定不良反应,因此寻找更加安全有效的治疗方法具有重要的价值。薯蓣皂苷元为穿山龙的根茎提取物,是穿山龙总皂苷的主要成分,具有舒筋活络、祛风止痛的功效[5]。现代医学研究显示,薯蓣皂苷元能够减轻炎性反应[6-9]。为探讨薯蓣皂苷元对于RA关节肿胀的改善效果及作用机制,我们进行了动物实验,现总结报告如下。
1 材料与仪器
1.1 实验动物6周龄SPF级雄性SD大鼠70只,体质量180~200 g,由上海南方模式生物科技股份有限公司提供,实验动物生产许可号:SCXK(沪)2019-0002。在温度23~25 ℃、湿度60%~65%环境中,昼夜12 h交替适应性饲养。实验方案通过医学动物实验伦理委员会批准。
1.2 主要试剂薯蓣皂苷元(北京索莱宝科技有限公司,纯度≥98%),鸡源性Ⅱ型胶原(Sigma-Aldrich公司),Nod样受体蛋白3(Nod-like receptor protein 3,NLRP3)炎性体通路激活剂尼日利亚菌素钠盐(西安乐森生物科技有限公司),甲醇、氯仿(郑州建祥化工产品有限公司),兔抗鼠白细胞介素(interleukin,IL)-1β、NLRP3单克隆抗体、半胱氨酸天冬氨酸蛋白酶1(Caspase-1)多克隆抗体、辣根过氧化物酶标记的山羊抗兔二抗(Abcam公司),IL-1β、IL-6、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)、谷胱甘肽(glutathione,GSH)检测试剂盒(上海恒远生物公司),丙二醛(malondialdehyde,MDA)检测试剂盒(武汉赛培生物科技有限公司),超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒(江苏凯基生物技术股份有限公司)。
1.3 实验仪器ST-360酶标仪(上海科华生物股份有限公司),WMS-1030生物显微镜(上海豫光仪器有限公司)。
2 方 法
2.1 造模及分组从70只大鼠中随机选取55只,按照李立萍等[10]的方法建立Ⅱ型胶原诱导的RA大鼠模型。具体方法如下:按照30 mg·kg-1腹腔注射3%戊巴比妥钠麻醉大鼠后,在右后足跖皮内注射100 μL Ⅱ 型胶原乳剂(鸡源性Ⅱ型胶原溶于0.01 mol·L-1乙酸中,使终浓度为5 mg·mL-1,与等体积弗氏完全佐剂冰浴混合,充分乳化制成);1周后,在右后肢注射100 μLⅡ型胶原乳剂加强免疫1次。剩余15只纳入空白组,先给予等量0.01 mol·L-1乙酸,1周后仍给予等量0.01 mol·L-1乙酸。4周后,由2名实验人员观察大鼠的关节肿胀程度,依据文献[11]进行关节炎指数评定:无关节炎为0分;个别足趾及足底肿胀为1分;大部分足趾及足底肿胀为2分;踝关节及以下肿胀为3分;肿胀累及踝关节以上,不能负重为4分。取2名实验人员评定的平均值作为最终评定结果,评分≥2分判定为造模成功。
将造模成功的48只大鼠随机分为模型组、薯蓣皂苷元组、激活剂组,每组16只。造模成功后2 d,薯蓣皂苷元组按100 mg·kg-1腹腔注射薯蓣皂苷元(薯蓣皂苷元溶于甲醇,用生理盐水稀释至甲醇体积分数为5%),空白组、模型组及激活剂组注射等量含5%甲醇的生理盐水。1 h后激活剂组按100 mg·kg-1腹腔注射尼日利亚菌素钠盐[尼日利亚菌素钠盐溶于二甲基亚砜(dimethyl sulfoxide,DMSO),用生理盐水稀释至DMSO体积分数为5%],薯蓣皂苷元组、空白组、模型组注射等量含5% DMSO的生理盐水。每天干预1次,共干预2周。
2.2 实验指标测定干预2周后,先对各组大鼠进行关节炎指数评定,然后将各组大鼠麻醉后自腹腔静脉取血5 mL,干燥管和抗凝管中各保存2.5 mL,以4000 r·min-1离心10 min(离心半径8 cm),分别从干燥管和抗凝管中提取上清液,即为血清和血浆,于-20 ℃保存,用于炎症因子和氧化应激因子含量检测。
采血后,在各组大鼠右后肢踝关节正中做纵切口,分离肌肉,继续分离可见平滑光亮的滑膜组织,用手术刀分离关节囊的滑膜层和纤维层,取出滑膜层组织。一部分HE染色后进行滑膜组织病理学观察,另一部分(-80℃保存)以Western Blot法检测滑膜组织NLRP3炎性体信号通路相关蛋白含量。
2.2.1关节肿胀情况评定 采用关节炎指数[11]评定各组大鼠右后肢的肿胀情况。
2.2.2外周血炎症因子含量测定 取-20 ℃保存的血清,室温下解冻,用ELISA试剂盒测定IL-1β、IL-6、TNF-α含量。按照ELISA试剂盒说明书加样,用全自动酶标仪测定450 nm处的吸光度(A值),通过绘制标准曲线得出IL-1β、IL-6、TNF-α含量。
2.2.3外周血氧化应激因子含量测定 取保存在-20 ℃的血浆,室温下解冻,分别测定其中MDA、SOD、GSH的含量,均按照对应试剂盒说明书加样。以硫代巴比妥酸法测定并计算MDA含量,以嘌呤氧化酶法测定并计算SOD含量,以ELISA法测定并计算GSH含量。
2.2.4滑膜组织病理学观察 用于组织病理学观察的滑膜组织样品,用10%甲醛固定36 h,经流水冲洗、9%硝酸脱钙、闭光过夜、梯度乙醇脱水(低浓度到高浓度)、二甲苯透明处理后,置于已溶化的石蜡中包埋、切片,切片厚度5 μm。将切片于热水中烫平,贴于载玻片上,在45 ℃恒温箱烘干。二甲苯、梯度乙醇脱蜡至水(高浓度到低浓度),蒸馏水浸泡片刻,苏木精水溶液染色5 min,酸水及氨水中分色,各5 s。流水冲洗1 h后入蒸馏水片刻。在70%、90%乙醇中各脱水10 min。酒精伊红染色液染色3 min,再经无水乙醇脱水、二甲苯透明、树胶封片后,在显微镜观察。
2.2.5滑膜组织NLRP3炎性体信号通路相关蛋白含量测定 取-80 ℃保存的关节滑膜组织,液氮速冻研磨后加入蛋白提取裂解液,冰上裂解、离心后取上清液。加入SDS上样缓冲液,95 ℃水浴使蛋白变性,进行SDS-PAGE凝胶电泳,电转至聚偏二氟乙烯膜,5%脱脂牛奶室温封闭2 h;洗膜后加入1∶1000稀释的IL-1β、Caspase-1及NLRP3一抗,4 ℃孵育过夜;洗膜后加入1∶4000辣根过氧化物酶标记的二抗,室温孵育1 h,洗膜后加入ECL发光液显影。采用Image J软件分析图像,以β-actin为内参,IL-1β、Caspase-1及NLRP3相对表达量用蛋白条带灰度值/β-actin蛋白条带灰度值表示。
2.3 数据统计方法采用SPSS24.0软件进行数据统计分析。各组大鼠的关节炎指数、外周血炎症因子含量、外周血氧化应激因子含量、滑膜组织NLRP3炎性体信号通路相关蛋白含量的组间总体比较均采用单因素方差分析,组间两两比较均采用LSD-t检验。检验水准α=0.05。
3 结 果
3.1 关节肿胀情况评定结果各组大鼠的关节炎指数比较,差异有统计学意义。激活剂组和薯蓣皂苷元组的关节炎指数均低于模型组(P=0.001,P=0.000),薯蓣皂苷元组的关节炎指数低于激活剂组(P=0.000)。见表1。
3.2 外周血炎症因子含量测定结果各组大鼠的血清IL-1β、IL-6、TNF-α含量比较,组间差异均有统计学意义。模型组、激活剂组及薯蓣皂苷元组的血清IL-1β、IL-6、TNF-α含量均高于空白组(IL-1β:P=0.001,P=0.000,P=0.002;IL-6:P=0.001,P=0.000,P=0.016;TNF-α:P=0.000,P=0.002,P=0.043);激活剂组和薯蓣皂苷元组的血清IL-1β、IL-6、TNF-α含量均低于模型组(IL-1β:P=0.003,P=0.000;IL-6:P=0.002,P=0.000;TNF-α:P=0.031,P=0.001);薯蓣皂苷元组的血清IL-1β、IL-6、TNF-α含量均低于激活剂组(P=0.021,P=0.002,P=0.046)。见表1。
3.3 外周血氧化应激因子含量测定结果各组大鼠的血浆MDA、SOD、GSH含量比较,组间差异均有统计学意义。模型组、激活剂组及薯蓣皂苷元组的血浆MDA含量均高于空白组(P=0.000,P=0.000,P=0.001),血浆SOD、GSH含量均低于空白组(SOD:P=0.000,P=0.000,P=0.001;GSH:P=0.000,P=0.000,P=0.002);激活剂组及薯蓣皂苷元组的血浆MDA含量均低于模型组(P=0.000,P=0.000),血浆SOD、GSH含量均高于模型组(SOD:P=0.000,P=0.000;GSH:P=0.001,P=0.000);激活剂组的血浆MDA含量高于薯蓣皂苷元组(P=0.007),血浆SOD、GSH含量均低于薯蓣皂苷元组(P=0.002,P=0.003)。见表1。

表1 各组大鼠关节炎指数、外周血炎症因子及氧化应激因子含量
3.4 滑膜组织病理学观察结果空白组关节滑膜组织结构、形态正常;模型组关节滑膜组织有炎性细胞浸润,滑膜细胞增生,血管扩张,形成血栓;激活剂组关节滑膜组织病理变化较模型组改善,但有轻微滑膜细胞增生;薯蓣皂苷元组关节滑膜组织病理变化明显改善。见图1。
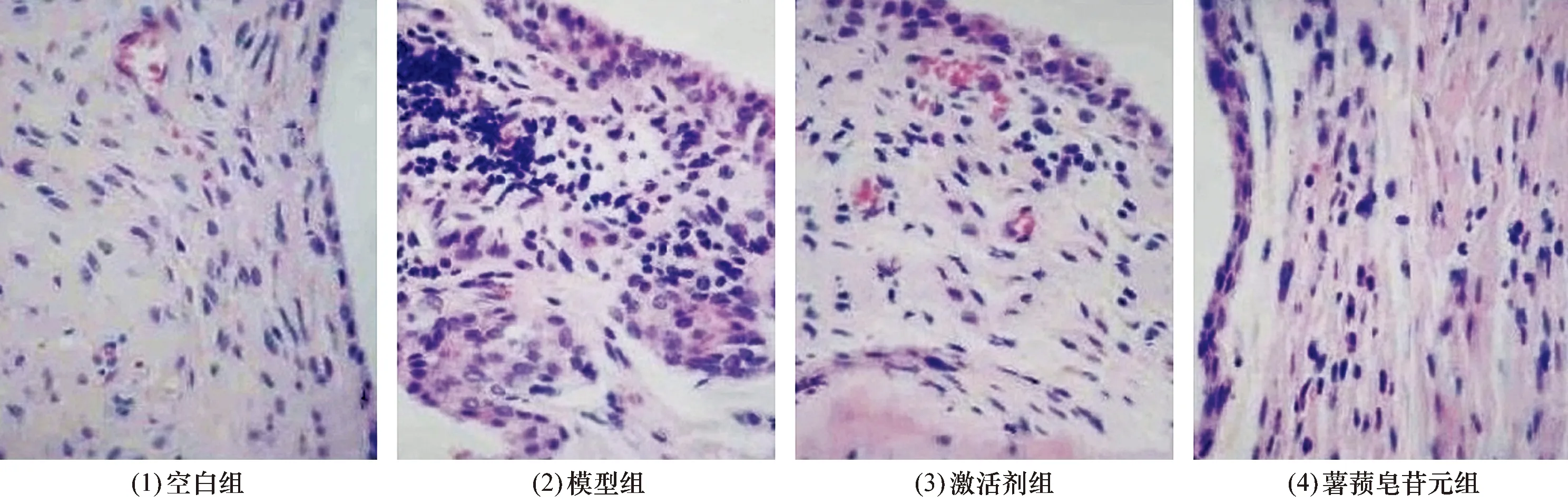
图1 各组大鼠膝关节滑膜组织HE染色图片(×200)
3.5 滑膜组织NLRP3炎性体信号通路相关蛋白含量测定结果各组大鼠关节滑膜组织IL-1β、Caspase-1、NLRP3含量比较,组间差异均有统计学意义;模型组、激活剂组及薯蓣皂苷元组滑膜组织IL-1β、Caspase-1、NLRP3含量均高于空白组(IL-1β:P=0.000,P=0.001,P=0.042;Caspase-1:P=0.000,P=0.000,P=0.006;NLRP3:P=0.000,P=0.001,P=0.013);激活剂组和薯蓣皂苷元组的IL-1β、Caspase-1、NLRP3含量均低于模型组(IL-1β:P=0.001,P=0.000;Caspase-1:P=0.006,P=0.000;NLRP3:P=0.007,P=0.000);薯蓣皂苷元组的IL-1β、Caspase-1、NLRP3含量均低于激活剂组(P=0.007,P=0.018,P=0.046)。见表2、图2。
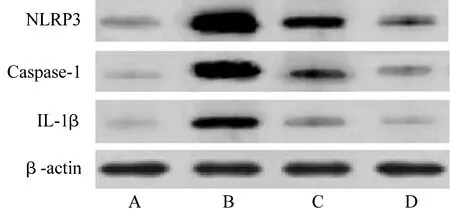
图2 各组大鼠滑膜组织IL-1β、Caspase-1、NLRP3含量Western Blot法检测结果
4 讨 论
RA的病因以及发病机制比较复杂,至今仍未完全明确,但一般认为是因某种未知的外来抗原作用于有易感基因的个体,机体对外来抗原出现免疫反应的同时,通过分子模拟或诱导自身免疫耐受的破坏而引起自身免疫反应[12-13]。目前治疗RA的药物主要有非甾体抗炎药、慢作用抗风湿药和免疫抑制剂,这类药物虽能较好地控制临床症状,但不能有效防止骨侵蚀[14-15]。近年来,中医药在治疗RA方面已显现出一定的优势,并受到了国内外学术界的青睐。
组别样本量/只IL-1β1)含量(x±s)Caspase-12)含量(x±s)NLRP33)含量(x±s)空白组150.46±0.070.54±0.080.69±0.08模型组161.02±0.101.16±0.121.27±0.12激活剂组160.72±0.080.90±0.101.01±0.11薯蓣皂苷元组160.56±0.060.73±0.080.88±0.09F值31.02523.65828.754P值0.0000.0000.000
现代医学研究证明,穿山龙的有效成分甾体皂苷能改善免疫功能,发挥调节免疫、抗炎、镇痛、抗肿瘤、止咳祛痰、降糖降尿酸等药理作用[7,16]。Song等[17]的研究表明,穿山龙可能是通过抑制外周炎症介质的产生而起到镇痛作用。Ou-Yang等[18]认为,穿山龙能明显抑制肉芽组织增生和炎症早期的毛细血管渗出。魏志萍等[19]研究发现,薯蓣皂苷元可通过抑制环氧合酶2的表达,抑制TNF-α诱导的关节炎大鼠成纤维样滑膜细胞异常增殖。王文云等[20]研究发现,薯蓣皂苷元可以通过促进M2型小胶质细胞极化,并抑制M1型小胶质细胞极化发挥抗炎作用。本研究中,与模型组相比,薯蓣皂苷元组大鼠关节炎指数降低,炎症因子IL-1β、IL-6、TNF-α含量降低,氧化应激因子MDA含量降低,氧化应激因子SOD、GSH含量升高,而且关节滑膜组织病变明显改善,提示薯蓣皂苷元能调节RA模型大鼠的免疫反应,缓解关节肿胀。
NLRP3炎性体是一种存在于细胞质的蛋白复合物,能被多种内外因素所激活;活化其效应蛋白Caspase-1,可将无活性的促炎细胞因子IL-1β和IL-18的前体剪切加工成熟并释放,参与机体抵抗病原体的免疫应答反应;一旦体内对NLRP3炎性体的调控失衡,可生成过量的IL-1β和IL-18,从而引发一系列炎症性疾病[21-22]。研究发现,抑制NLRP3炎性体通路,能够抑制炎症因子的表达,缓解机体内炎症反应[23-24]。本研究中,薯蓣皂苷元组和激活剂组滑膜组织中IL-1β、Caspase-1、NLRP3含量均低于模型组,但激活剂组滑膜组织中IL-1β、Caspase-1、NLRP3含量高于薯蓣皂苷元组,提示薯蓣皂苷元可能通过下调IL-1β、Caspase-1、NLRP3的表达,抑制NLRP3炎性体通路发挥治疗作用。
本研究结果提示,薯蓣皂苷元能有效缓解RA大鼠的关节肿胀,其作用机制可能是通过下调IL-1β、Caspase-1、NLRP3的表达,抑制NLRP3炎性体信号通路介导的炎性反应。
