人参皂苷Rh2调控盘状结构域受体1对糖尿病大鼠肾纤维化和细胞凋亡的影响
2021-07-22沈炳香王法财何春远赵为陈
沈炳香,王法财,周 艺,李 婷,何春远,赵为陈
1安徽医科大学附属六安医院药学部,安徽 六安 237005;2中南大学湘雅药学院药理学系,湖南 长沙410078
糖尿病肾病(DN)是糖尿病严重的微血管并发症之一,占终末期肾病(ESRD)约30%~47%[1],其10年死亡率是健康人群的6倍[2]。肾小管间质纤维化以及高血糖引起的肾组织细胞凋亡是DN重要的病理基础[3,4]。研究证实,高糖能够诱导肾小管上皮细胞凋亡,导致尿蛋白产生、细胞外基质的沉积以及肾小球硬化[5]。因此,探究DN 肾间质纤维化以及细胞凋亡的发生机制及其药物治疗,对于防治DN具有重要意义。人参皂苷Rh2(G-Rh2)是从红参中分离Rg3并经人肠道菌转化而得到的主要代谢产物,其具有抗炎、抗氧化、抗肿瘤以及抑制纤维化等作用[6-7]。研究表明,在糖尿病大鼠心肌纤维化模型中,G-Rh2能够通过调控PPARδ-STAT3信号,降低心肌胶原沉积,改善糖尿病心肌纤维化[8]。本实验前期研究发现,在DN大鼠模型中,G-Rh2能够通过抑制Caspase-1介导的细胞焦亡,改善DN肾损伤[9]。以上研究表明G-Rh2在糖尿病血管病变中发挥重要作用,但是有关其对DN肾纤维化和细胞凋亡的影响及作用机制尚不清楚。
盘状结构域受体1(DDR1)是近年来发现的一种新型酪氨酸蛋白激酶受体,参与包括细胞凋亡,增殖,迁移以及组织炎症和纤维化等[10]。以往文献显示,DDR1在多种组织和器官中广泛表达,尤其是肺、脾、肾和小肠组织[11]。DDR1能够通过胶原基质调节人肺成纤维细胞迁移,促进成纤维细胞穿越基底膜屏障[12]。在博来霉素诱导小鼠肺纤维化模型中,组织学检测DDR1表达上调[13]。另外,在肾小管上皮细胞中敲除DDR1基因可以延缓遗传性Ⅳ胶原疾病肾纤维化[10]。在高糖诱导的血管内皮细胞凋亡中DDR1表达上调,抑制DDR1能够降低高糖诱导的血管内皮细胞凋亡[14]。以上研究表明DDR1在纤维化和细胞凋亡中发挥重要作用。但是有关DDR1在糖尿病肾病肾纤维化和细胞凋亡中作用尚不清楚。因此,本研究拟通过构建DN大鼠模型,探究G-Rh2能否通过调控DDR1抑制肾纤维化和细胞凋亡,以期为DN治疗提供新的思路。
1 材料和方法
1.1 材料
1.1.1 实验动物 雄性,SPF级,6~8周龄,体质量180~200 g的SD大鼠,购买自中南大学湘雅医学院实验动物学部(许可证:SCXK(湘)2017-0006)。
1.1.2 实验药物与主要试剂 人参皂苷Rh2(上海顺勃生物工程技术有限公司,纯度≥98,批号:112246-15-8);链脲佐菌素(STZ)(Sigma-Aldrich,批号:V900890);胰岛素测定试剂盒(上海酶联科技生物有限公司,批号:ml064302);苏木素伊红(HE)染色试剂盒(碧云天生物技术,批号:C0105S);过碘酸-雪夫(PAS)染色试剂盒(碧云天生物技术,批号:C0142S);马松(Masson)染色试剂盒(Sigma-Aldrich,批号:1.00485);TUNEL染色试剂盒(碧云天生物技术,批号:C1098);兔SP免疫组化试剂盒(北京中杉金桥生物技术公司,批号:SP-9001);CollagenI 兔单克隆抗体(Abcam,批号:ab260043);CollagenIII 兔多克隆抗体(Abcam,批号:ab7778);Caspase-3兔单克隆抗体(Abcam,批号:ab32351);Bcl-2兔多克隆抗体(碧云天生物技术,批号:AF0060);DDR1兔单克隆抗体(Cell Signaling Technology,批号:3917);β-actin 小鼠单克隆抗体(碧云天生物技术,批号:AF5001);辣根过氧化物酶标记山羊抗兔(碧云天生物技术,批号:A0208);辣根过氧化物酶标记山羊抗小鼠(碧云天生物技术,批号:A0216)。
1.1.3 仪器 血糖仪器(长沙三诺生物传感技术有限公司);荧光倒置显微镜(日本尼康);组织匀浆仪(武汉微塞尔生物科技有限公司);酶标仪(北京普朗医疗公司);高速冷冻离心机(Beckman-Coulter);ChemiDoc XRS+成像系统(Bio-Rad)。
1.2 方法
1.2.1 动物建模与给药 实验SD大鼠随机分为对照组、糖尿病肾病组(DN)、人参皂苷Rh2 药物干预组(GRh2),每组各10只,适应性喂养1周。DN和G-Rh2药物干预组大鼠腹腔注射STZ(60 mg/kg)构建糖尿病模型,连续3 d血糖值≥16.7 mmol/L视为造模成功,成功造模7 d后进行尿蛋白定性检测,尿蛋白为阳性为DN模型构建成功[9]。对照组大鼠给予注射等量的柠檬酸缓冲溶液。在DN大鼠造模成功的第2 d,G-Rh2组大鼠灌胃G-Rh2(20 mg·kg-1·d-1),连续用药12周,DN组和对照组灌胃等量的生理盐水。
1.2.2 大鼠相关指标检测(1)血糖:大鼠尾静脉取血,血糖仪检测血糖值;(2)胰岛素:大鼠心脏取血,4 ℃,3000 r/min,离心10 min分离血浆,胰岛素试剂盒检测其含量;(3)肌酐、尿素氮、尿蛋白:采用全自动生化分析仪,并按照南京建成生物公司试剂盒说明书进行检测。
1.2.3 肾脏组织病理取材 G-Rh2药物灌胃处理12 周,大鼠腹腔注射戊巴比妥钠麻醉,仰卧位固定大鼠,打开胸腔,待心脏取血完成后剪开左心耳,4%的多聚甲醛持续灌流直至心脏、肺呈现乳白色,利用手术镊和手术剪刀剥离周围结缔组织摘取大鼠左肾并采用生理盐水清洗血渍,最后放置于液氮罐内保存留存。
1.2.4 大鼠肾组织形态学观察 4%的多聚甲醛固定大鼠肾组织,石蜡切片厚度约5 μm,行HE、PAS和Masson染色,于200倍显微镜下观察各组大鼠肾组织形态学。Masson染色观察胶原显示蓝色。
1.2.5 TUNEL染色 大鼠肾组织经石蜡切片、常规脱水,按照试剂盒说明书行TUNEL组织荧光染色。光学显微镜下观察肾组织细胞凋亡情况,凋亡细胞呈荧光绿色。于400倍显微镜下随机性选取6个视野(视野下需包含肾小球结构)。细胞凋亡指数(%)=荧光绿色细胞凋亡数目/蓝色细胞核细胞总数目×100%。
1.2.6 免疫组织化学 大鼠肾组织经石蜡切片、常规脱水,按照兔SP免疫组化试剂盒行免疫组化染色,DAB显色。于200倍显微镜下观察DDR1表达与分布,组织中DDR1着色呈棕褐色。
1.2.7 蛋白质免疫印迹 提取肾组织总蛋白并测定其浓度,取40 μg蛋白样品进行SDS-PAGE凝胶电泳,将蛋白转移至PVDF 膜上,5%的脱脂牛奶封闭非特异性位点2 h;4 ℃条件下,孵育CollagenI兔单克隆抗体(1∶1000),CollagenIII兔多克隆抗体(1∶1000),Caspase-3兔单克隆抗体(1:1000),Bcl-2兔多克隆抗体(1∶1000),DDR1兔单克隆抗体(1∶1000)和β-actin小鼠单克隆抗体(1∶5000)16 h;TBST清洗3次,5 min/次;室温条件下,孵育辣根过氧化物酶标记山羊抗兔(1∶5000)或者辣根过氧化物酶标记山羊抗小鼠(1∶5000)1 h;TBST清洗3次,5 min/次;发光试剂显影,ChemiDoc XRS+成像系统拍照并进行目的蛋白表达分析。目的蛋白表达水平以目的条带灰度值比β-actin条带灰度值表示。
1.2.8 统计学分析 采用SPSS20.0软件进行分析,定量资料以均数±标准差表示,多组均数比较采用方差齐性检验和单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 G-Rh2对DN大鼠生化指标的影响
与对照组相比,DN组大鼠血糖、尿蛋白、肌酐和尿素氮水平明显升高(P<0.01),胰岛素水平明显降低(P<0.01)。与DN组相比,G-Rh2组大鼠血糖、尿蛋白、肌酐和尿素氮水平降低(P<0.01),胰岛素水平升高(P<0.01,表1)。
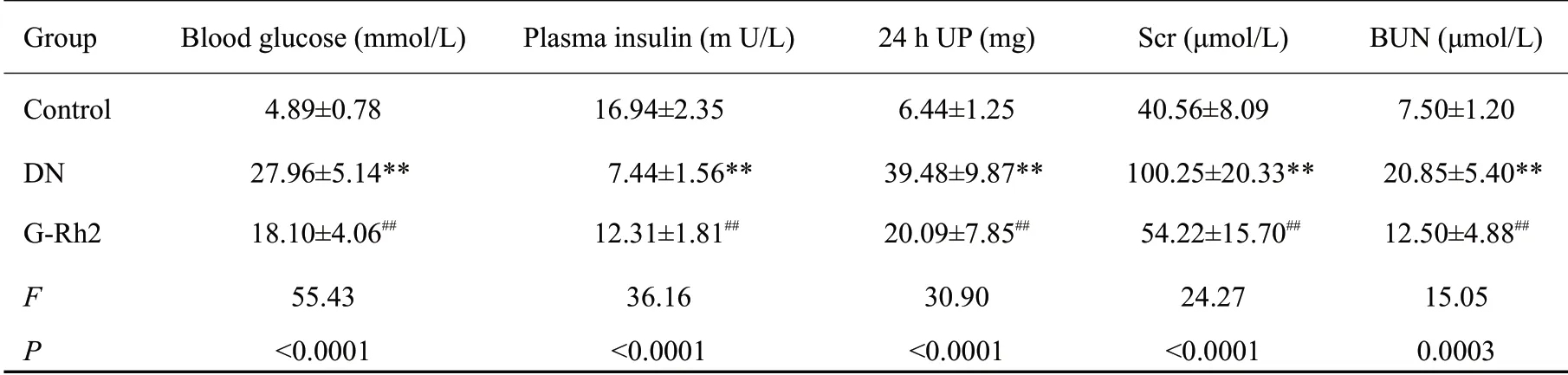
表1 各组大鼠血糖、胰岛素、肌酐、尿素氮和尿蛋白水平比较Tab.1 Blood glucose,insulin,creatinine,urea nitrogen and urinary proteins levels in each group(n=6,Mean±SD)
2.2 G-Rh2对DN大鼠肾纤维化的影响
HE染色和PAS染色显示,对照组大鼠肾组织肾小球结构完整,清晰、肾小管上皮细胞排列规则;DN组大鼠肾组织肾小球体积增大且基底膜增厚,肾小管结构紊乱,且部分空泡变性,有典型的病理学改变;G-Rh2组大鼠肾组织上述病变减轻。Masson染色显示,与对照组相比,DN组和G-Rh2组胶原沉积增多;与DN组相比,G-Rh2组胶原沉积减少(图1)。Western blot显示,与对照组相比,DN 组CollagenI、CollagenIII 表达上调(P<0.01);与DN组相比,G-Rh2组CollagenI、CollagenIII表达下调(P<0.05或P<0.01,图2)。

图1 各组大鼠肾组织形态学变化和纤维化程度Fig.1 Hisotological changes and degree of fibrosis in the kidney tissue of the rats in each group.
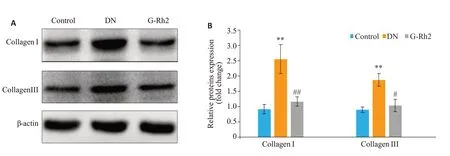
图2 各组大鼠肾组织Collagen I和Collagen III表达Fig.2 Expression of collagen I and collagen III in the kidney tissue of the rats in each group.**P<0.01 vs control group;#P<0.05,##P<0.01 vs DN group.A:Western blotting of collagen I and collagen III expressions;B:Quantitative analysis of the results.
2.3 G-Rh2对DN大鼠细胞凋亡的影响
TUNEL染色显示,与对照组相比,DN组细胞凋亡指数增加(P<0.01);与DN组相比,G-Rh2组细胞凋亡指数显著降低(P<0.01,图3)。Western blot检测显示,与对照组相比,DN组Cleaved-caspase-3表达上调,Bcl-2表达下调(P<0.01);与DN 组相比,人参皂苷Rh2 组Cleaved-caspase-3表达降低(P<0.05),Bcl-2表达升高(P<0.05,图4)。

图3 TUNEL染色观察大鼠肾组织凋亡情况Fig.3 TUNEL staining for observing renal cell apoptosis of the rats.**P<0.01 vs control group;##P<0.01 vs DN group.A:TUNEL staining of the renal tissue.B:Quantitative analysis of the results.

图4 各组大鼠肾组织Cleaved-caspase-3和Bcl-2表达Fig.4 Expression of cleaved caspase-3 and Bcl-2 in the kidney tissue of the rats in each group.**P<0.01 vs control group;#P<0.05,##P<0.01 vs DN group.A:Western blotting of the expressions of cleaved caspase-3 and Bcl-2 proteins.B:Quantitative analysis of the results.
2.4 G-Rh2对DN大鼠DDR1表达的影响
Western blot检测显示,与对照组相比,DN组肾组织DDR1表达明显上调(P<0.01);与DN组相比,G-Rh2组DDR1 表达显著降低(P<0.01)。免疫组化检测,DDR1在肾小管细胞中呈现高表达,与对照组相比,DN组和G-Rh2 组肾组织DDR1 表达增加,但G-Rh2 组DDR1表达低于DN组(图5)。

图5 各组大鼠肾组织DDR1表达Fig.5 DDR1 expression in the kidney tissue of the rats in each group.**P<0.01 vs control group;##P<0.01 vs DN group.A:Western blotting for detecting DDR1 expression.B:Quantitative analysis of the results.C:Representative results of immunohistochemical staining for detecting DDR1 expression in the 3 groups.
3 讨论
血糖异常升高被认为是DN发病的基础,高血糖可以通过多种基质损伤肾小管上皮细胞,主要包括炎症风暴,氧化应激,细胞凋亡以及纤维化等。其中肾细胞凋亡以及肾间质纤维化已经成为DN的主要病理特征[15,16]。研究表明,细胞凋亡能够导致肾细胞外基质沉积、肾小管上皮细胞肥大以及肾小球膜扩张,进而导致肾小管间质纤维化和肾小球硬化[17,18]。另外,肾纤维化作为糖尿病肾损伤的重要环节,其可以引起ESRD[19,20]。临床研究证实,通过有效控制血糖以及血压能够改善DN患者的病症[21-23]。然而,目前临床上主要以血管紧张素转化酶抑制剂和血管紧张素受体阻断剂药物治疗DN,但是单一药物治疗只能针对DN某个特定病因,长期服用具有一定的毒副作用[9]。因此,探寻中药活性单体对于治疗DN尤为重要。
G-Rh2 在肿瘤,心血管,神经系统中均被广泛研究。研究表明G-Rh2能够调控氧化应激,细胞凋亡以及纤维化等途径发挥心血管疾病的治疗作用[7-9]。本研究首先探究G-Rh2对DN大鼠的治疗作用。结果显示,与DN组相比,G-Rh2能够有效降低DN大鼠血糖、尿蛋白、肌酐和尿素氮。初步表明G-Rh2对DN具有治疗作用。既往研究证实,在DN大鼠模型中,G-Rh2能够通过调控基质金属蛋白酶表达,缓解DN肾损伤[24]。另外,在70%胰腺部分切除型成年C57BL/6J小鼠中,G-Rh2能够通过调控Akt/Foxo1/PDX-1信号,抑制胰岛β细胞凋亡,促进细胞增殖,进而降低血糖,改善小鼠葡萄糖耐受量[25]。以上研究均表明G-Rh2在糖尿病中具有一定的治疗潜力。本研究通过DN大鼠给予G-Rh2灌胃处理12周,探究G-Rh2能否通过抑制DN肾纤维化和细胞凋亡,改善DN 肾损伤。结果显示,与DN 组相比,GRh2组大鼠肾病理损伤减轻,胶原沉积减少,肾组织细胞凋亡降低。进一步Western blot检测显示,与DN肾病组相比,G-Rh2组大鼠肾组织CollagenI、CollagenIII以及Cleaved-caspase-3均表达下调,Bcl-2表达上调。以上研究结果表明G-Rh2能够通过抑制肾组织细胞凋亡和纤维化进而改善DN肾损伤。那么有关G-Rh2对DN 肾纤维化和细胞凋亡的调控机制又是如何呢?DDR1是与细胞凋亡和纤维化密切相关的受体酪氨酸蛋白激酶家族蛋白成员之一[26]。既往研究发现在单侧输尿管梗阻的大鼠肾纤维化模型中,抑制DDR1能够降低炎症细胞迁移进而阻止纤维化进程[27]。另外,DDR1基因缺失小鼠能够免受血管紧张素II介导的蛋白尿和肾小球纤维化[28]。新近研究也证实抑制DDR1能够降低高糖诱导的血管内皮细胞凋亡[14]。以往研究表明抑制DDR1可能成为防治纤维化和细胞凋亡的重要途径[10,11]。因此,本研究进一步检测G-Rh2对DN肾组织DDR1表达的影响。结果显示,与对照组相比,DN组DDR1表达上调;与DN组相比,G-Rh2组DDR1表达下调。本研究结果表明G-Rh2抗DN肾纤维化和细胞凋亡可能与下调DDR1表达相关。以往文献研究证实DDR1可以通过PI3K、Rac1和c-Jun等信号促进胶原蛋白合成,诱导纤维化[28]。另外,DDR1亦可以通过Notch1、Hes、Jak2信号调控细胞凋亡和增殖[29-30]。但是本研究仅仅从动物实验上初步揭示G-Rh2可能通过下调DDR1,抑制DN肾纤维化和细胞凋亡,缓解DN肾损伤。因此,在后续的实验研究中拟从细胞水平探究G-Rh2调控DDR1抑制肾纤维化和细胞凋亡的分子机制。既往研究显示在低氧/复氧诱导的心肌细胞损伤模型中,HMGB1能够通过调控DDR1,抑制mTOR磷酸化,促进Beclin-1、LC3-Ⅱ/LC3-Ⅰ,降低p62的表达,诱导自噬[31]。另外,体内外实验也证实抑制DDR1表达能够增强自噬水平进而减轻骨关节炎[32]。而自噬是细胞将自身受损的细胞器或错误折叠的蛋白质包裹、吞噬、并运输到溶酶体进行降解,实现自身物质代谢更新,能量再循环利用的生物学过程。因此,在激活自噬的同时也会增强溶酶体功能,这与本课题组前期研究证实G-Rh2 可以通过增强cathepsin B 和cathepsin L活性,改善溶酶体功能,从而发挥DN保护作用一致[9]。上述研究提示:G-Rh2极有可能通过调控DDR1,改善溶酶体功能,并最终抑制DN肾纤维化和细胞凋亡。
综上所述,本研究通过构建DN模型探究G-Rh2对肾纤维化和细胞凋亡的影响。结果显示G-Rh2能够通过下调DDR1,抑制肾纤维化和细胞凋亡,缓解DN肾损伤。以上研究结果初步证实了G-Rh2在DN中的治疗作用,为后期临床应用提供了实验依据。