2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷可减轻脂多糖诱导的大鼠急性肺损伤
2021-07-22陈加宝
陈加宝,刘 华
广东药科大学附属第一医院全科医学科,广东 广州510030
急性肺损伤(ALI)是由于各种肺内外非心源性致病因素引起的进行性缺氧性呼吸衰竭,其病理表现为肺泡炎症性渗出、肺血管通透性增加引起肺水肿,进而导致气体交换障碍且急性恶化,是临床上致死率极高的难治性危急重症,其发病率和死亡率一直居高不下[1,2]。目前,临床上主要治疗手段包括药物治疗和机械通气等综合措施[3]。单纯使用保护性机械通气治疗虽能起到一定的肺保护作用,但未能有效降低患者的死亡率[4,5]。药物治疗作为对ALI患者采用的一种综合性治疗手段目前已经取得了良好的理论支持和前期研究基础[6,7],早期进行有效的药物治疗性干预,减少呼吸机的依赖是优化生存的关键和挑战。因此,迫切需要进一步研究探求治疗ALI的新药物,以为临床综合性治疗提供多样化的药物选择,进而减少呼吸机依赖。
炎症反应在ALI的发生发展中起着重要作用,通过信号转导途径激活炎性细胞并大量释放炎性细胞因子如TNF-α、IL-1β和IL-6等[8],引起肺组织出血、水肿及大量中性粒细胞浸润。因此,抑制ALI所致炎症反应的产生与发展可能是ALI治疗研究的关键点。二苯乙烯苷(TSG),化学名2,3,5,4'-四羟基二苯乙烯-2-O-β-D-葡萄糖苷,是中药何首乌的主要活性成分,该化合物具有多种生物活性和药用价值,已被证实在肠道炎症、肝炎、心肌纤维化、血管性痴呆等防治中显出良好的抗炎、抗氧化效果[9,10]。除此之外,还具有抗骨质疏松、降血脂、抗肿瘤等作用[11,12]。因此,TSG在ALI治疗上或许也能发挥出意想不到的抗炎效果。另外,NF-κB信号通路在脂多糖(LPS)诱导的ALI炎症级联反应过程中被激活,诱导炎性细胞因子的产生,并参与肺组织炎症的过程,阻碍NF-κB信号通路有助于减轻ALI[13]。例如,特异性干扰剂siRNA通过抑制NF-κB 通路降低NF-κB p65蛋白的表达从而抑制脓毒症早期炎症反应,有效减轻ALI[14]。NF-κB抑制剂吡咯烷二硫代氨基甲酸酯(PDTC)也被证明可逆转NF-κB通路,从而改善ALI的炎症损害[15]。而据研究,TSG可通过阻碍核转录因子NF-κB 的表达抑制多种组织细胞炎症反应的发生[16,17]。目前在ALI治疗中,尚未有TSG与NF-κB信号通路的提及,或许TSG亦可通过阻碍NF-κB信号通路从而起到治疗ALI的作用。研究TSG对ALI的治疗效果有望为临床综合性治疗提供多样化的药物选择,减少呼吸机依赖。因此,本研究通过尾静脉注射LPS建立大鼠ALI模型,观察TSG抗炎及抗氧化疗效,探讨其相关可能机制,为临床有效治疗ALI提供一种新的药物备选方法。
1 材料和方法
1.1 动物
雄性SD 大鼠,体质量180~220 g,购于南方医科大学动物实验中心,合格证号SCXK(粤)2016-0041。饲养环境温度20~25 ℃,相对湿度40%~70%,自由饮水,食物充足供应,12 h 昼夜交替照明。本实验符合动物伦理委员会要求。
1.2 药物与试剂
TSG(春秋生物,纯度98%),脂多糖(LPS,Sigma),大鼠TNF-α、IL-6ELISA试剂盒(博士德生物),超氧化物歧化酶(SOD)、丙二醛(MDA)测试盒(建成生物),GAPDH抗体(Abcam),NF-KB p65兔单克隆抗体、辣根标记羊抗兔IgG抗体(Bioworld)。
1.3 仪器
AB204-N 万分之一精密分析天平(Mettler Toledo),3K15高速冷冻离心机(Sigma),Varioskan全波长酶标仪(Thermo Fisher scientific),PowerPAC200电泳仪(Bio-Rad)。
1.4 实验方法
1.4.1 动物造模及分组 将36只健康雄性SD大鼠随机分为正常对照组、LPS组、TSG低剂量组、TSG高剂量组,每组9只。TSG低剂量组及高剂量组分别予TSG 50 mg/(kg·d)和100 mg/(kg·d)连续灌胃1周,给药容量为每100 g大鼠1 mL,正常组、LPS组予同等剂量的蒸馏水。末次给药0.5 h后,LPS组、TSG低剂量组和TSG高剂量组尾静脉注射LPS(5 mg/kg),正常组注射等量的生理盐水,6 h后处死大鼠。
1.4.2 肺组织病理形态学 取右上肺组织,4%多聚甲醛溶液固定,常规脱水、透明、浸蜡、包埋、切片(5μm),HE染色。显微镜下观察肺组织形态学改变并进行病理损伤评分[18]。
1.4.3 肺组织湿/干质量比(W/D)测定 麻醉处死大鼠,取右肺副叶、下叶,用滤纸吸干表面水分后称其质量,即为湿质量(W);将上述肺组织置于60 ℃恒温烤箱中,干燥48 h,再次称其质量得干质量(D)。计算肺湿/干质量的比值(W/D)。
1.4.4 肺组织SOD活性和MDA含量的测定 另取大鼠右中肺组织,4 ℃下用电动匀浆器制成10%肺组织匀浆,离心(3000 r/min)10 min后取上清,检测肺组织SOD活性和MDA含量。按试剂盒说明书进行操作。
1.4.5 血清中炎症因子TNF-α、IL-6浓度的检测 经腹主动脉采血5 mL,离心(4 ℃,3000 r/min)10 min后取上清。采用酶联免疫吸附测定法(ELISA法)测定血清中TNF-α、IL-6的浓度变化。按试剂盒说明书进行操作。
1.4.6 Western blot检测肺组织中NF-κB p65蛋白表达于研磨后的肺组织加入RIPA 裂解液,提取总蛋白。BCA蛋白定量试剂盒测定蛋白浓度后,加入上样缓冲液loading buffer,10%SDS-PAGE凝胶电泳分离,半干转膜法将分离的蛋白转移到PVDF膜上。牛奶室温封闭2 h,用NF-KB p65兔单克隆抗体(稀释比例为1∶2000)孵育,4 ℃过夜;用辣根标记羊抗兔IgG抗体(稀释比例为1∶40 000)37 ℃孵育2 h,曝光显色,以GAPDH为内参照。
1.4.7 统计学方法 所有实验数据均以均数±标准差表示,采用SPSS 16.0 统计软件对资料进行统计分析,组间比较采用单因素方差分析,方差齐则采用LSD 检验,方差不齐则采用Games-Howell检验。当P<0.05 时认为差异有统计学意义。
2 结果
2.1 各组大鼠肺组织病理形态学变化及评分
正常组肺组织结构清晰,未见明显病理性变化。LPS组可见肺泡间隔增厚,间质充血水肿,炎性细胞浸润。而TSG组肺损伤表现明显减轻(图1)。与对照组相比,LPS组病理评分升高(P<0.001),而TSG组病理评分显著低于LPS组(P<0.001,图2)。
2.2 各组大鼠肺组织湿/干质量比值(W/D)
与正常对照组相比,LPS组大鼠肺湿/干质量比值显著升高(P<0.001),TSG低、高剂量组可显著降低肺湿/干质量比值(P<0.001,图3)。

图3 各组大鼠肺组织湿/干质量比值比较Fig.3 Wet-to-dry ratio of the lung tissue in each group.*P<0.001 vs control,#P<0.001 vs LPS group.
2.3 TSG对ALI大鼠肺组织SOD活性和MDA含量的影响
与正常对照组比较,LPS组肺组织中SOD活性明显降低(P<0.001);与LPS组比较,TSG低剂量组与TSG高剂量组SOD活性均明显升高(P<0.001),但仍低于正常对照组(P<0.001,图4)。与正常对照组比较,LPS组肺组织中MDA含量明显升高(P<0.001);与LPS组比较,TSG低剂量组与TSG高剂量组MDA含量均明显降低(P<0.001),但仍高于正常对照组(P<0.001,图4)。
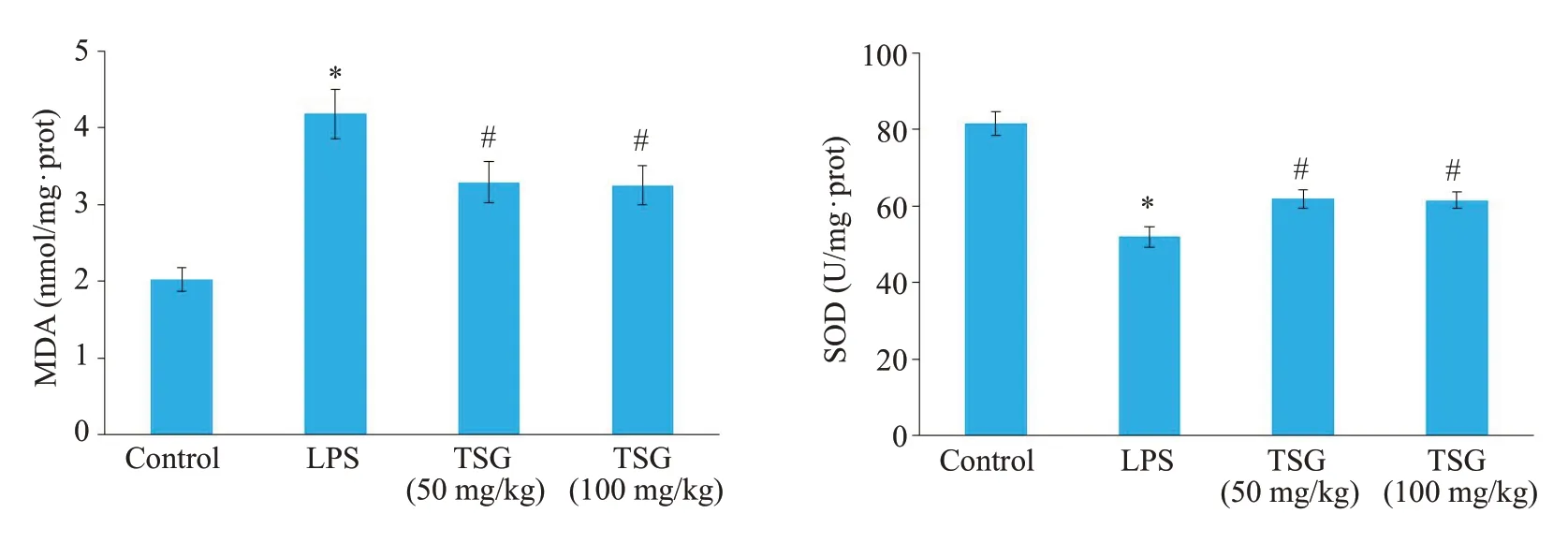
图4 各组大鼠肺组织MDA、SOD水平比较Fig.4 MDAand SOD levels in the lung tissue in each group.*P<0.001 vs control,#P<0.001 vs LPS group.
2.4 TSG对ALI大鼠血清炎症因子TNF-α、IL-6的影响
与正常对照组比较,LPS组大鼠血清中炎症因子TNF-α、IL-6的浓度显著升高(P<0.001,图5)。与LPS组比较,TSG低剂量组和TSG高剂量组TNF-α、IL-6的浓度均显著降低(P<0.001,图5)。

图5 各组大鼠血清炎症因子水平比较Fig.5 Serum levels of inflammatory factors in each group.*P<0.001 vs control,#P<0.001 vs LPS group.
2.5 TSG对ALI大鼠肺组织中NF-κB p65蛋白表达的影响
与正常对照组比较,LPS组大鼠肺组织中NF-κB p65蛋白表达水平显著升高(P<0.001,图6)。与LPS组比较,TSG低剂量组和TSG高剂量组中NF-κB p65蛋白表达水平显著降低(P<0.001,图6)。

图6 各组大鼠肺组织NF-κB p65蛋白的表达差异Fig.6 Expression level of NF-κB p65 protein in the lung tissue in each group.A:Western blots of NF-κB p65.B:Quantitative analysis of the gray value of NF-κB p65 protein.*P<0.001 vs control,#P<0.001 vs LPS group.
3 讨论
ALI在临床上病死率一直居高不下,很大一部分原因是缺乏根本有效的治疗手段,对于寻找ALI新的治疗手段问题仍然很严峻。各学者经过多年的研究针对该病也制作了不同的动物模型,目前常用的方法是通过LPS诱导建立大鼠急性肺损伤模型,LPS是革兰氏阴性细菌细胞壁的主要成分,通过产生大量促炎性细胞因子、趋化因子,使炎症细胞浸润,引起肺泡毛细血管损伤,导致急性肺水肿的形成[19]。TSG具有抗细胞凋亡及纤维化作用,它可减低血管紧张素Ⅱ诱导的心肌纤维化程度及心肌组织Ⅰ、Ⅲ型胶原蛋白、纤维连接蛋白和PAI-1的表达,且能抵抗多柔比星所致的心肌细胞凋亡[20,21]。本实验通过LPS复制大鼠急性肺损伤模型可看出大鼠肺组织出现了明显肺水肿,而从各组大鼠肺组织病理形态学变化及评分可看出TSG组肺病理损伤表现明显减轻,其通过抑制肺组织细胞凋亡、水肿及间质纤维化缓解了ALI所致的病理损伤。这说明TSG可有效减轻LPS引起的肺组织充血、水肿及细胞凋亡,抑制肺间质纤维化形成。
在对OVA致敏的哮喘气道炎症上TSG表现出明显的抗炎作用,可有效减少肺内炎性细胞聚集和黏液高分泌[22]。此外,TSG显著减弱了LPS诱导的RAW264.7细胞的激活和促炎症细胞因子TNF-α、IL-6的分泌[23]。促炎症细胞因子TNF-α、IL-6可刺激肺巨噬细胞和呼吸道上皮细胞释放趋化因子,诱导单核巨噬细胞表达黏附因子,从而促进炎症反应[24]。TNF-α和IL-6还可诱导其他细胞炎症因子的表达并激活NF-κB信号通路,使炎症反应进一步进展[25]。NF-κB是一种广泛表达的核转录因子,在调节炎症、细胞凋亡、氧化应激和肿瘤增殖及转移等多种生理病理过程起着重要作用。NF-κB信号通路在ALI的炎症过程中起关键作用,抑制NF-κB信号通路可大大降低ALI炎症的严重程度[13]。如特异性干扰剂siRNA、NF-κB抑制剂PDTC均被证实通过抑制NFκB 通路降低NF-κB p65蛋白的表达从而抑制炎症反应,有效减轻ALI[14,15]。TSG可阻碍NF-κB信号通路的激活,抑制多种炎症反应的发生。在非酒精性脂肪肝中,TSG可通过阻碍NF-κB信号通路逆转高脂饮食引起的非酒精性脂肪肝,减轻慢性低度炎症反应[16]。在牙龈卟啉单胞菌刺激诱导的人牙龈成纤维细胞炎症反应中,TSG通过抑制牙龈细胞NF-κB信号通路激活,改善牙周炎的发展过程[17]。此外,也有研究证明TSG可通过抑制LPS刺激下显著激活增加的NF-κB从而减轻小胶质细胞的炎症反应,降低炎症因子TNF-α、IL-6的表达[26]。本研究结果显示通过TSG治疗干预可显效抑制ALI大鼠肺组织中NF-κB p65蛋白水平的表达,其炎症因子TNF-α和IL-6水平也明显降低,说明TSG能够通过抑制NF-κB信号通路从而改善LPS所致的急性肺损害,降低炎症因子,抑制炎症反应。
氧化应激在ALI的发生发展中起着重要作用,可增强促炎因子的表达,且炎症细胞可诱导细胞内活性氧过度生成,形成恶性循环,促进ALI的发生和发展[27]。因此,抗氧化应激或许可以缓解ALI所造成的肺损伤。据报道,TSG可保护小鼠耳蜗UB/OC-2细胞,减轻氧化应激引起的细胞凋亡[28]。同时,TSG可通过抑制氧化损伤对MC3T3-E1成骨细胞进行有效保护,从而改善骨质疏松[29]。另外,TSG还可通过增强糖尿病大鼠SOD活性、引发MDA水平降低的抗氧化应激作用使糖尿病肾病程度明显降低[30]。MDA是生物膜上不饱和脂肪酸受自由基攻击发生脂质过氧化的产物,它与体内脂质过氧化程度和自由基损伤水平呈正相关[31]。而过度氧化会降低SOD活性,SOD为体内抗氧化物质,是清除氧自由基的重要酶系,可阻止氧化应激反应进一步扩大,其活性降低使过氧化反应增强,氧化损伤不断恶化[32]。通过本次研究显示,TSG可使MDA水平显著降低,并改善了SOD活性,以此说明TSG能够减轻由LPS引起的氧化应激反应所致的肺组织损伤。
综上所述,本次研究证明,TSG可减轻LPS引起的肺组织充血、水肿及细胞凋亡,抑制肺组织纤维化。同时,TSG可以改善由LPS引起的氧化应激所致的肺组织损伤。此外,TSG可通过抑制ALI大鼠肺组织中NF-κB信号通路的表达,降低其炎症因子TNF-α和IL-6的产生,以此减轻LPS所致的肺损伤。由此证实TSG可减轻脂多糖诱导的大鼠急性肺损伤,其保护作用可能与抑制NF-κB通路的激活,降低NF-κB p65蛋白的表达,提高抗氧化能力,减少炎症因子的释放有关。然而,本实验低剂量TSG和高剂量TSG并未对炎症反应的缓解能力表现出明显差异性,其治疗的最佳剂量仍有待进一步研究。