鹅星状病毒XX株的分离鉴定及遗传特征分析
2021-07-22金前跃郭永刚李俊朋秦保亮王寅彪郭振华邢广旭邓瑞广张改平
金前跃,郭永刚,李俊朋,秦保亮,王寅彪,郭振华,王 丽,邢广旭,邓瑞广,张改平,8
(1.河南省农业科学院 动物免疫学重点实验室,河南 郑州 450002; 2.河南省农业科学院 中英禽病国际研究中心,河南 郑州 450002; 3.江苏高校动物重要疾病与人兽共患病防控协同创新中心,江苏 扬州 225009;4.河南牧业经济学院 动物医药学院,河南 郑州 450046; 5.平顶山市农业科学院 畜牧研究中心,河南 平顶山 467001;6.新乡市动物疫病预防控制中心,河南 新乡 453003; 7.新乡医学院 公共卫生学院,河南 新乡 453003;8.河南农业大学 动物医学院,河南 郑州 450002)
鹅星状病毒(Goose astrovirus,GAstV)属于星状病毒科(Astroviridae,AstV)、禽星状病毒属(Avastrovirus,AAstV),是一种无囊膜、单链正义RNA病毒[1]。GAstV基因组全长6.1~7.9 kb,包含5′非翻译区(UTR)、3′UTR及多聚腺苷酸(PolyA)尾及3个开放性阅读框(ORF),分别为编码蛋白酶的ORF1a、编码RNA聚合酶的ORF1b、编码衣壳蛋白(Capsid)的ORF2[2-4]。禽星状病毒主要分为3个群,分别为禽星状病毒1群(AAstV-1)、禽星状病毒2群(AAstV-2)和禽星状病毒3群(AAstV-3)[5]。GAstV属于禽星状病毒1群(AAstV-1),是一种新发的星状病毒。
GAstV主要感染5~20日龄的雏鹅,临床表现为严重痛风症状。剖检病死雏鹅,可见内脏器官表面有大量尿酸盐沉积,部分死亡雏鹅关节腔内有白色尿酸盐沉积,死亡率高达20%~70%[6-10]。
2017年以来,雏鹅痛风病例在山东、江苏、安徽、河南、辽宁、广东等主要养鹅地区不断出现,且呈上升趋势,对国内养鹅业造成了巨大影响。国内多家科研单位相继分离到GAstV,ZHANG等[11]从华南地区分离到了GD株,YANG等[12]和ZHANG等[13]分别从华北地区分离到了AstV/SDPY/Goose/1116/17、AAstV/Goose/CHN/2017/SD01株,徐蓉等[14]从华东地区分离到了JSHA株。河南省多地也出现了雏鹅痛风疫情,病死鹅表现出典型的内脏痛风症状,给河南省养鹅产业造成了重大损失。
为明确GAstV河南流行株的基因组特征,从河南省新乡市原阳县某鹅场采集了患有痛风的病鹅样品,通过盲传和PCR检测分离了GAstV,并对分离毒株进行全基因组测序和遗传特征分析,为有效防控雏鹅痛风疫情提供技术支持,并为GAstV在河南省的流行病学研究奠定基础。
1 材料和方法
1.1 主要试剂
DME/F12培养基购自HyClone公司;青链霉素混合液、胰蛋白酶购自Solarbio公司;胎牛血清购自Gibco公司;Premix ExTaqDNA聚合酶、病毒基因组提取试剂盒(MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0)、反转录试剂盒(PrimeScript RT Master Mix)购自Takara公司。
1.2 病料和细胞
患有痛风的雏鹅来源于河南省新乡市原阳县某鹅场。解剖后,收集肝脏、肾脏等组织,冻存于-40 ℃冰箱。鸡肝癌细胞系(LMH)由本实验室保存,利用含10%胎牛血清的DME/F12培养基于含5% CO2的37 ℃培养箱中进行培养。
1.3 病料的处理
无菌条件下取适量病料,以1∶3的质量体积比加入含青链霉素的无菌磷酸盐缓冲液(PBS)彻底研磨。将组织研磨液收集于无菌Eppendorf管中,在-80 ℃和室温间反复冻融3次,10 000 r/mim离心15 min,使用0.22 μm的滤器过滤上清液并冻存于-80 ℃冰箱。
1.4 病毒的分离
待细胞瓶中的LMH细胞生长至约80%时,弃去培养基并用无菌PBS清洗3次。使用无血清DME/F12(含1 mg/L胰酶)培养基将上述处理后的病料研磨液稀释50倍后接种于细胞上,在37 ℃、5% CO2的培养箱中孵育1.5 h。然后弃去病毒液,加入含2%胎牛血清的DME/F12(含1 mg/L胰酶)培养基继续培养72 h。之后通过-80 ℃与室温间反复冻融,2 000 r/min离心15 min,收集病毒液。无菌过滤后,再次接种于LMH细胞盲传3代,然后继续传至第6代,获得稳定毒株。
1.5 病毒的鉴定
1.5.1 PCR检测 根据AstV/SDPY/Goose/1116/17毒株(GenBank登录号:MH052598.1)的RNA聚合酶基因ORF1b序列设计引物。PCR上游引物序列为5′-ACCCCTGGTTATCCAAAATTTAAGT-3′,下游引物序列为5′-CCGCCAGAAGAGAGGCTTGGGCAAC-3′,预期片段大小为420 bp。
按照病毒核酸提取试剂盒说明书提取病毒总RNA,使用反转录试剂盒进行反转录,获取病毒cDNA作为PCR模板。PCR反应条件:预变性95 ℃ 5 min;变性95 ℃ 30 s,退火58 ℃ 30 s,延伸72 ℃ 1 min,循环30次;72 ℃延伸10 min,4 ℃停止反应。GAstV ORF1b阳性质粒与PBS分别作为阳性对照及阴性对照。采用1.0%的琼脂糖凝胶电泳对PCR产物进行鉴定。
1.5.2 全基因组测序 按照病毒基因组提取试剂盒说明,提取GAstV的全基因组,反转录后交由杭州联川生物进行全基因组二代测序。
1.6 遗传特征分析
根据分离毒株的全基因组测序结果进行遗传特征分析,主要包括同源性分析、系统进化分析、ORF2编码蛋白氨基酸序列比对。本研究所用毒株序列信息见表1。
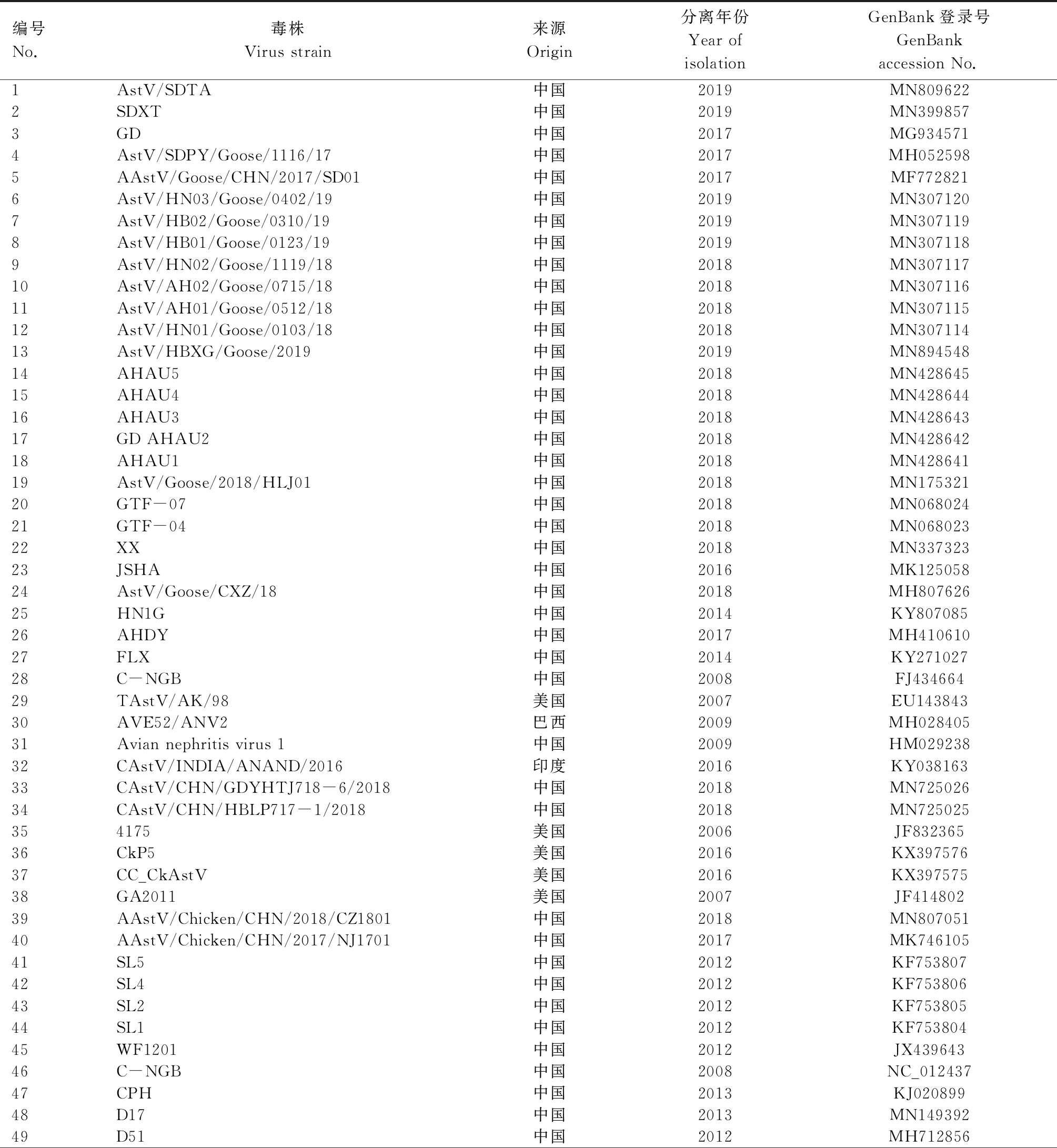
表1 研究所用毒株序列信息
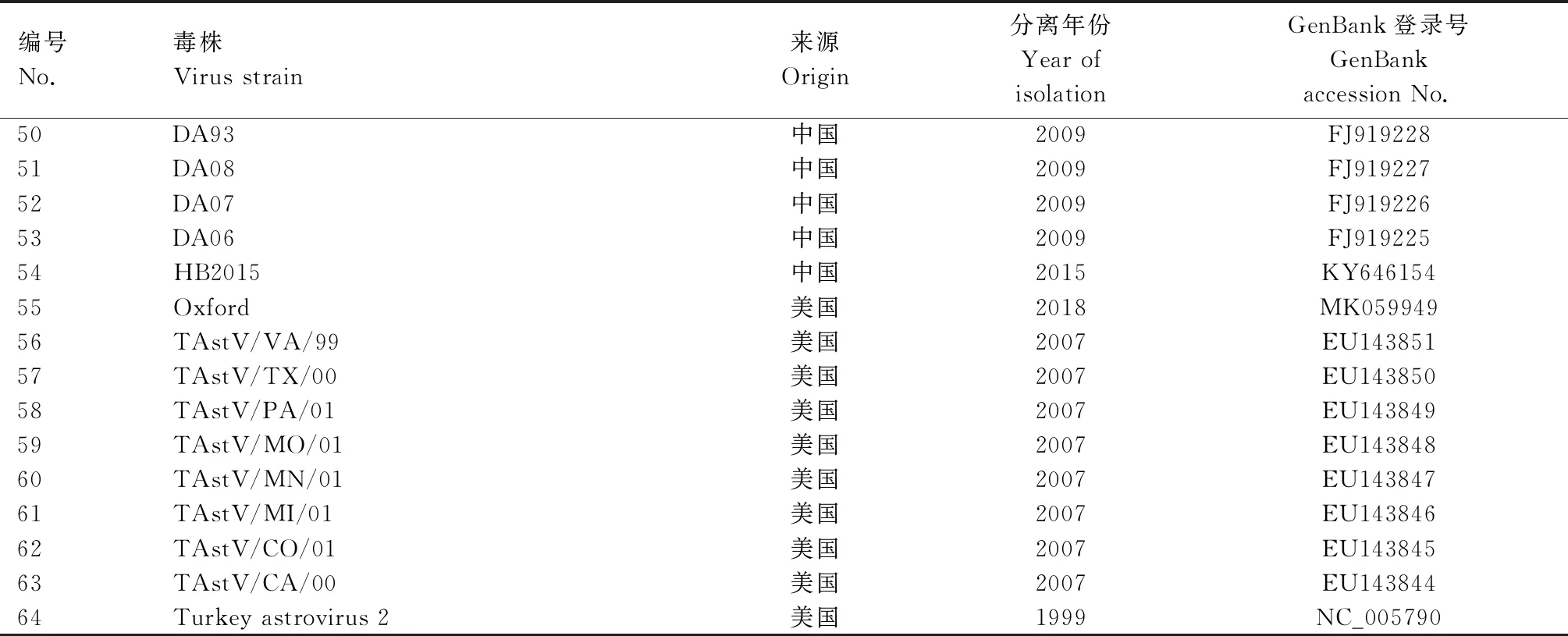
续表1 研究所用毒株序列信息
1.6.1 同源性分析 利用DNAStar软件MegAlign中的Clustal W Method模块,将分离株的全基因组、ORF1b、ORF2的核苷酸及氨基酸序列与GenBank中相关序列进行同源性分析。
1.6.2 系统进化分析 将分离株的全基因组序列与GenBank中禽星状病毒相关序列进行比对。利用Mega 6.06软件中的Clustal W程序完成分离株全基因组序列比对,并采用邻接法构建遗传进化树,步长值(Bootstrap value)设置为1 000。
1.6.3 ORF2编码蛋白氨基酸序列比对 利用DNAStar软件MegAlign功能的Clustal W Method模块,将分离毒株与GenBank中GAstV流行毒株的ORF2编码蛋白氨基酸序列进行多重比对分析。
2 结果与分析
2.1 患痛风雏鹅临床解剖特征
患病雏鹅解剖后可见明显的全身性痛风症状,肾脏肿大、发白,输尿管、胆囊、关节腔内都有尿酸盐沉积,心脏、肝脏、腺胃、肠道也不同程度附着有白色尿酸盐(图1)。
2.2 分离毒株PCR鉴定结果
将处理过的病料研磨液接种LMH细胞(未见明显的细胞病变),收集1—6代病毒液,提取核酸并反转录获得cDNA,进行PCR检测后,均扩增得到了420 bp大小的条带(图2),符合预期大小。表明成功分离了1株GAstV,命名为XX株。
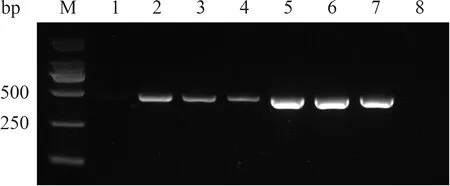
M.DNA Marker;1—6.1—6代收集的病毒液;7.阳性对照;8.阴性对照
2.3 分离毒株全基因组序列分析
本研究分离的GAstV XX株(GenBank登录号:MN337323)的基因组全长为7 252 bp,包含长度为245 bp(1—245)的5′UTR和228 bp(7 025—7 252)的3′UTR,ORF包括ORF1a(246—3 350)、ORF1b(3 341—4 891)、ORF2(4 910—7 024)。ORF1a、ORF1b编码非结构蛋白,包含蛋白酶、RNA聚合酶等,ORF1a和ORF1b之间有10 bp的重叠序列;ORF2编码病毒结构蛋白,主要包括衣壳蛋白及其表面的刺突蛋白(Spike)。
2.4 分离毒株遗传特征分析
2.4.1 同源性分析 全基因组及各基因序列的同源性分析结果(表2)表明,GAstV XX株基因组与导致雏鹅痛风的代表性毒株GD、AstV/SDPY/Goose/1116/17、AAstV/Goose/CHN/2017/SD01的核苷酸同源性分别为98.1%、98.7%、98.7%。GAstV XX株的ORF1b、ORF2基因与导致雏鹅痛风的代表性毒株GD、AstV/SDPY/Goose/1116/17、AAstV/Goose/CHN/2017/SD01核苷酸同源性为98.6%~ 99.4%,氨基酸同源性为98.6%~ 99.8%。可见,GAstV XX株与当前导致雏鹅痛风的流行毒株同源性较高。
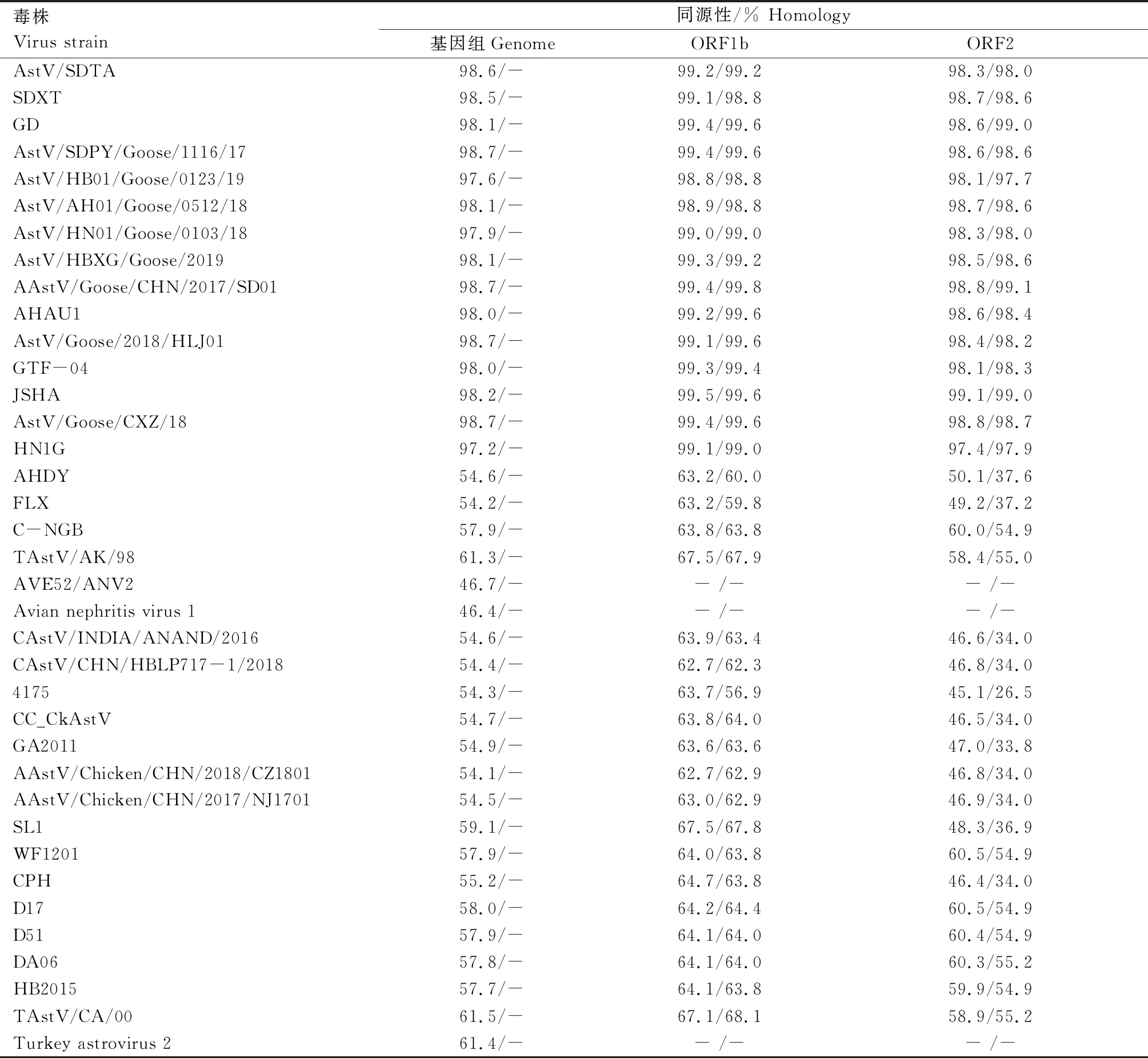
表2 分离毒株与代表性毒株的同源性
2.4.2 系统进化分析 为进一步确定GAstV XX株与其他毒株的遗传进化关系,构建了基于基因组的系统进化树(图3)。系统进化分析结果显示,GAstV XX株与当前导致雏鹅痛风的GD、AstV/SDPY/Goose/1116/17、AAstV/Goose/CHN/2017/SD01等毒株处于同一进化分支,属于禽星状病毒1群。
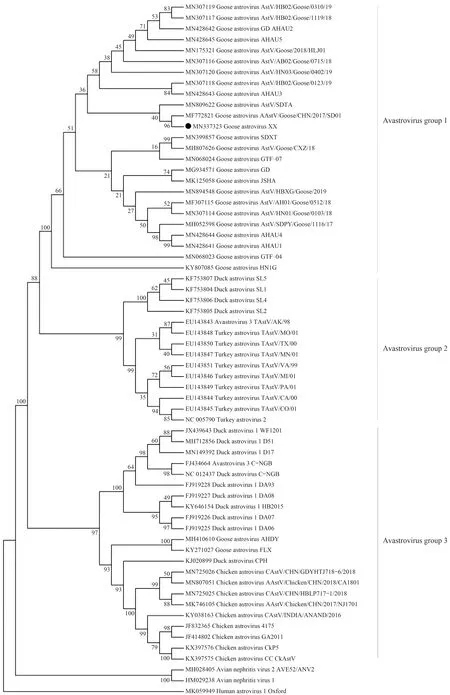
图3 GAstV的系统进化分析
2.4.3 ORF2编码蛋白氨基酸序列比对 GAstV XX株的ORF2编码蛋白氨基酸序列与其他流行毒株同源性较高,但也存在一些氨基酸位点的突变(表3)。这些突变主要集中在224(T→A)、225(Q→R)、379(P→T)、424(M→I)、464(N→A)、594(S→N)等位点。
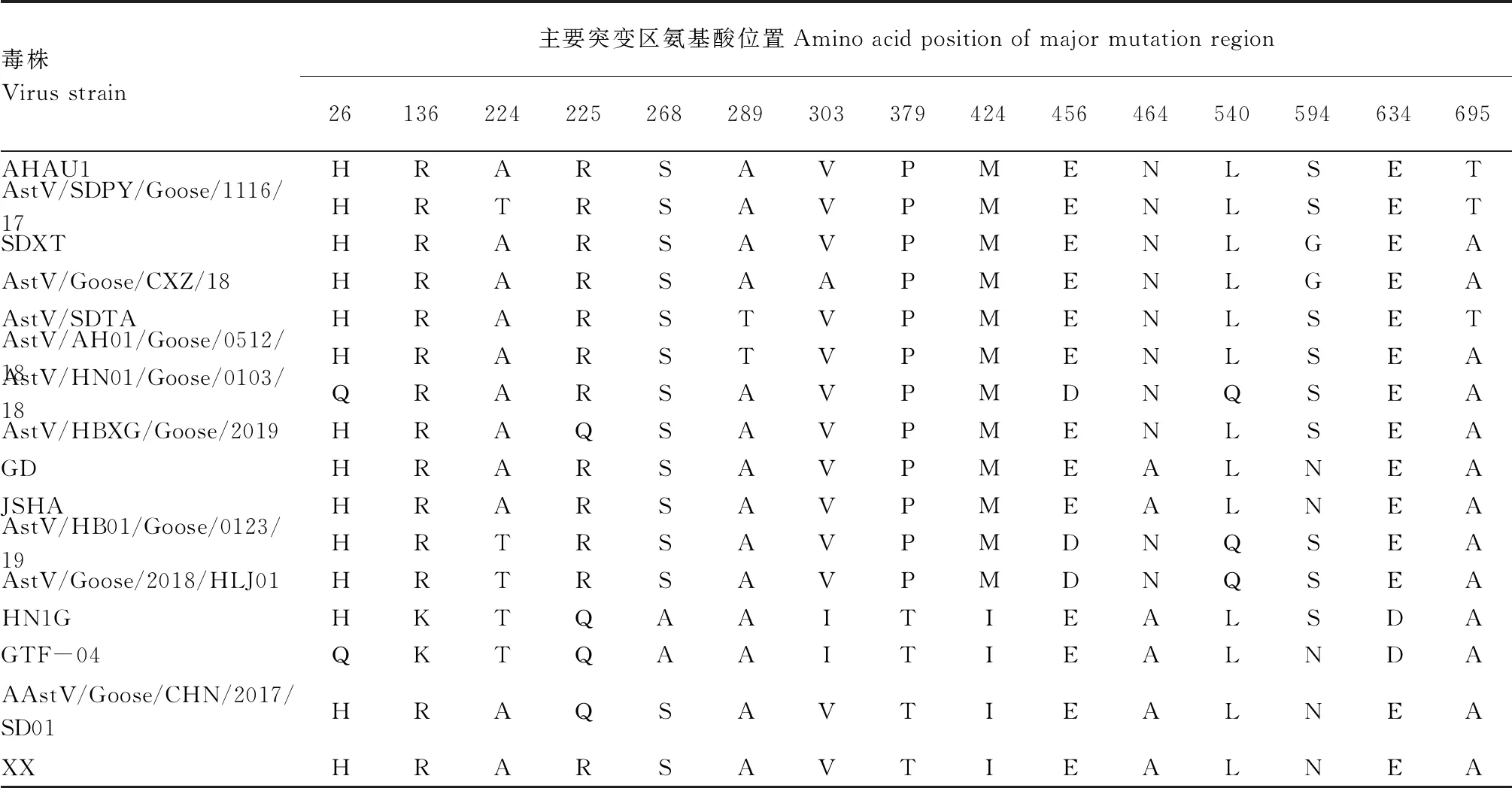
表3 ORF2编码蛋白氨基酸序列比对
3 结论与讨论
禽星状病毒可感染鸭[15]、鸡[16]、火鸡[17]等多种禽类,临床常表现为肝脏、肾脏及肠道病变,但GAstV感染报道较少。本次暴发的GAstV感染可引起雏鹅严重痛风症状,在禽星状病毒中尚属首次发现,与营养性痛风不同[18],其具有极强的传染性,即使在低蛋白质日粮情况下也可发生。本研究分离了1株GAstV,对病毒进行了全基因组测序,并对其遗传特征进行了分析。
前人研究发现,鸡星状病毒可引起LMH细胞病变[16]。本研究中,GAstV XX株能在LMH细胞上稳定传代,但病毒感染不引起细胞病变,具体原因有待进一步研究。通过全基因组序列分析可知,GAstV XX株基因组全长7 252 bp,主要编码ORF1a、ORF1b、ORF2蛋白。GAstV XX毒株与当前导致雏鹅痛风的流行毒株同源性较高,均在97%以上,与代表性毒株GD、AstV/SDPY/Goose/1116/17、AAstV/Goose/CHN/2017/SD01的基因组核苷酸同源性分别为98.1%、98.7%、98.7%。
系统进化分析结果表明,GAstV XX株与当前导致雏鹅痛风的流行毒株处于同一进化分支,属于禽星状病毒1群,与鸭、火鸡、鸡星状病毒进化关系较远,存在较大差异。不同鹅源毒株ORF2编码蛋白氨基酸序列分析表明,各流行毒株之间差异较小,仅存在部分氨基酸位点的突变。
