猪A组轮状病毒HN2019-01株的分离鉴定及VP6基因序列分析
2021-07-22黄正阳陈宇婧冷超粮刘阳坤姚伦广
黄正阳,陈宇婧,黄 克,冷超粮,2,3,刘阳坤,2,3,姚伦广,2,3,李 娜,2,3
(1.南阳师范学院 生命科学与农业工程学院,河南 南阳 473061;2.河南省畜禽保健品工程技术研究中心,河南 南阳 473061;3.河南省动物疫病诊断与综合防控工程技术研究中心,河南 南阳 473061)
轮状病毒(Rotavirus,RV)是呼肠孤病毒科(Reoviridae)轮状病毒属成员,病毒颗粒呈球形,由3层病毒蛋白组成,直径70 nm左右,无包膜,电镜下观察呈车轮状,是导致婴幼儿和多种幼龄动物病毒性腹泻的主要病原之一[1-2],可以分为10个亚型(A—J)[3-4]。仔猪中存在A组轮状病毒(Group A rotaviruses,RVA)、B组轮状病毒(Group B rotaviruses,RVB)、C组轮状病毒(Group C rotaviruses,RVC)、E组轮状病毒(Group E rotaviruses,RVE)和H组轮状病毒(Group H rotaviruses,RVH)等多个亚型感染[5],其中RVA是引起断奶前后仔猪腹泻最常见的亚型[6]。RVA感染以患病仔猪腹泻、厌食、呕吐、脱水为特征[7-8],常与其他细菌、病毒混合感染而使病情加重,导致仔猪生长缓慢,患病猪群死亡率升高[9]。该病潜伏期短、传染性强、流行范围广,在多个国家普遍存在,威胁着全球养猪业的发展[10-11]。
RV基因组由11个不连续的双链RNA(Double-stranded RNA,dsRNA)组成,依次命名为基因1—11,编码6个结构蛋白(VP1、VP2、VP3、VP4、VP6和VP7)和5个非结构蛋白(NSP1、NSP2、NSP3、NSP4、NSP5)[11]。RV结构蛋白中,VP1、VP2和VP3是病毒的核心结构蛋白,VP4、VP6和VP7则是形成病毒衣壳的主要结构蛋白。VP6位于病毒粒子的中层,含量丰富,约占病毒蛋白质总量的51%,是病毒转录酶和复制酶的必需亚基[12]。VP6蛋白免疫原性强,能够介导黏膜免疫,是最重要的群特异性抗原,决定了RV血清型的特异性[13]。同时,VP6蛋白序列保守,在不同哺乳动物群体中的氨基酸相似性大于87%,是国内外多种检测方法的首选靶标[14]。
由于RV基因组具有节段性,不同亚型毒株在感染同一宿主时,可能会造成基因片段交换而发生重配,导致新变异株的产生[15]。RV最新分类系统是基于其11个完整的基因组RNA片段(VP7-VP4-VP6-VP1-VP2-VP3-NSP1-NSP2-NSP3-NSP4-NSP5)进行分类,不同毒株根据序列被命名为Gx-Px-Ix-Rx-Cx-Mx-Ax-Nx-Tx-Ex-Hx[16]。目前,RV已发现有36种G基因型、51种P基因型[17]和26种I基因型[18]。病毒感染存在一定的种间屏障,然而有研究发现,RV能够进行适应性调整,可能发生跨种传播[18-19]。SATOSHI等[20]在患有严重腹泻的婴儿粪便中分离到人轮状病毒KKL-117毒株,其11个基因片段与猪源基因均高度相似,证实了RV从猪到人的跨种传播。
RV作为人畜共患的病原体,不仅危害养殖业的健康发展,还威胁到社会的公共卫生安全。因此,有必要对动物源RV的特征及流行情况进行实时监测。鉴于此,在河南某猪场分离获得猪源RV,并对分离毒株的VP6基因进行了序列测定及遗传进化分析,旨在为河南省猪RV的流行病学调查提供参考,为RV疫苗的研发奠定基础。
1 材料和方法
1.1 材料
1.1.1 病料及细胞 临床病料样品为河南省某猪场疑似RV感染病猪的粪便;MA-104细胞购自武汉普诺赛生命科技有限公司。
1.1.2 主要试剂 DNA聚合酶购自New England Biolabs(NEB)公司;Trans DNA Marker Ⅰ、Trans2K Plus DNA Marker和pEASY-Blunt载体购自北京全式金生物技术有限公司;RNAiso Plus和反转录试剂盒购自TAKARA公司;质粒提取试剂盒和胶回收试剂盒均购自OMEGA公司;氨苄青霉素购自北京索莱宝科技有限公司;引物由生工生物工程(上海)股份有限公司合成。
1.2 方法
1.2.1 病毒分离及鉴定 将病料用pH值7.4的PBS稀释成20%悬液,4 ℃条件下3 000 r/min离心30 min,取上清,过滤除菌后加入青霉素(100 U/mL)和链霉素(100 mg/L),同时加入与病料相同体积的胰酶(20 mg/L),混匀后置于37 ℃处理2 h,然后接种MA-104细胞。37 ℃条件下培养72 h后,收获细胞及培养液,冻融3次,过滤离心,再将上清接种生长状态良好的MA-104细胞,盲传5代,提取每一代细胞的总RNA,按照反转录试剂盒说明书步骤合成cDNA。利用检测引物(RV-F:5′-CCCCGGTATTGAATATACCACAGT-3′;RV-R:5′-TTTCTGTTGGCCACCCTTTAGT-3′)进行PCR扩增(目的片段长341 bp),并以ddH2O为模板作阴性对照,PCR产物进行琼脂糖凝胶电泳检测。
1.2.2VP6基因扩增及鉴定 根据NCBI中所报道的RVVP6基因序列,利用Primer Premier 5.0软件设计引物VP6-F:5′-GGCTTTWAAACGAAGTCTTC-3′;VP6-R:5′-GGTCACATCCTCTCACT-3′。以1.2.1中得到的cDNA为模板,PCR扩增包含完整VP6基因的片段,并将其克隆至pEASY-Blunt载体,菌液PCR鉴定得到阳性重组质粒,由生工生物工程(上海)股份有限公司测序。
1.2.3VP6基因及其编码蛋白质的生物信息学分析 应用DNAStar v7.0软件对VP6基因测序结果进行分析,将测序结果与NCBI中的参考毒株进行核苷酸及氨基酸相似性分析,参考毒株序列信息见表1。利用MEGA 7.0软件对VP6基因序列采用最大似然法(Maximum likelihood)构建核苷酸系统发育进化树,并以Bootstrap值(1 000)来评估进化树的可靠性。利用软件ProtParam分析VP6蛋白分子质量、氨基酸组成、等电点等理化性质;利用软件NetNGlyc 1.0和NetPhos 2.0分析预测蛋白质潜在N糖基化位点和潜在磷酸化位点;采用软件SOPMA分析VP6蛋白二级结构;应用在线软件(https://swiss-model.expasy.org)及Pymol软件分析VP6蛋白三级结构。

表1 参考毒株信息
2 结果与分析
2.1 临床样品中RV的检测
利用RV特异性检测引物,对于疑似RV感染的病猪腹泻样品进行反转录PCR扩增,并进行凝胶电泳检测,可见大小约341 bp的目的条带(图1),与预期结果相符,说明该病猪腹泻样品中存在RV病毒核酸。

M:Trans DNA Marker Ⅰ;1:阴性对照;2:临床样品
2.2 RV分离毒株鉴定
为进一步鉴定病料中的病原,将腹泻样品病料处理后接种MA-104细胞,盲传5代,并提取细胞总RNA进行反转录PCR鉴定,所传代次均可检测到RV的特异性条带(图2),但感染细胞未观察到明显细胞病变效应(Cytopathic effect,CPE)(图3)。将分离毒株命名为RVA/Pig-wt/HN2019-01。
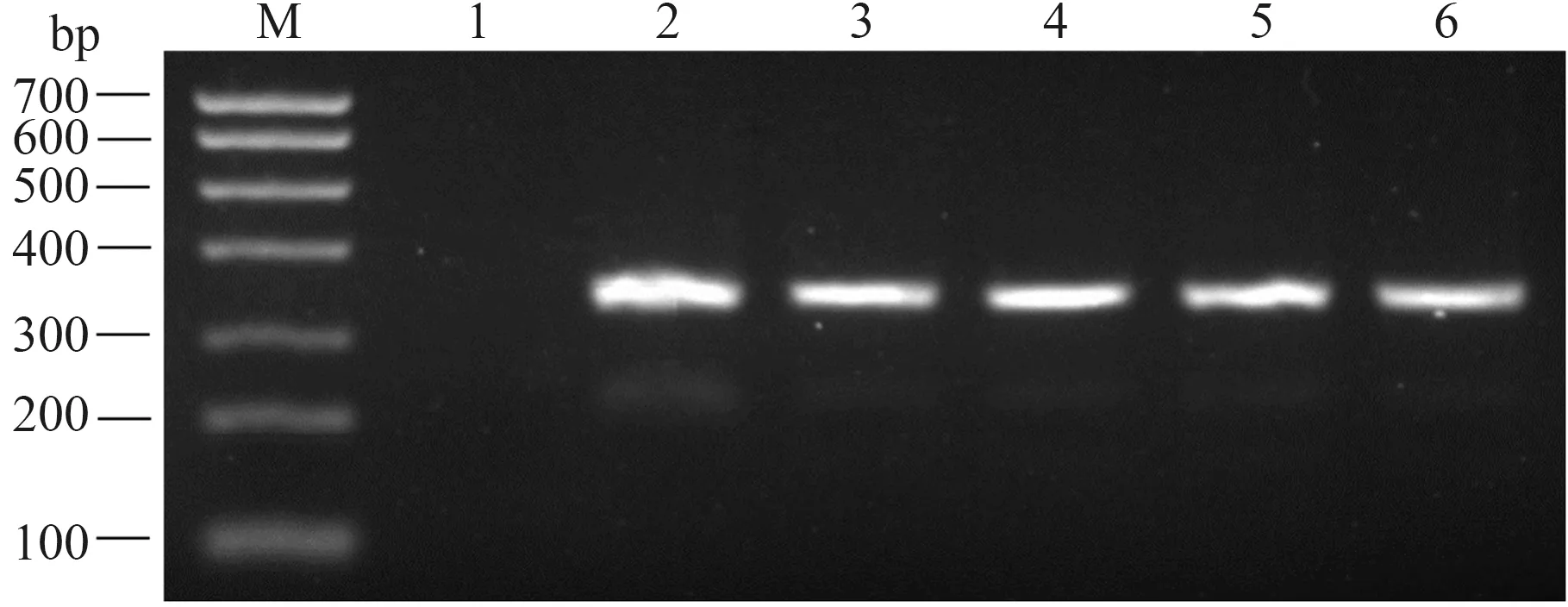
M:Trans DNA Marker Ⅰ;1:阴性对照;2—6:培养1—5代RV的MA-104检测
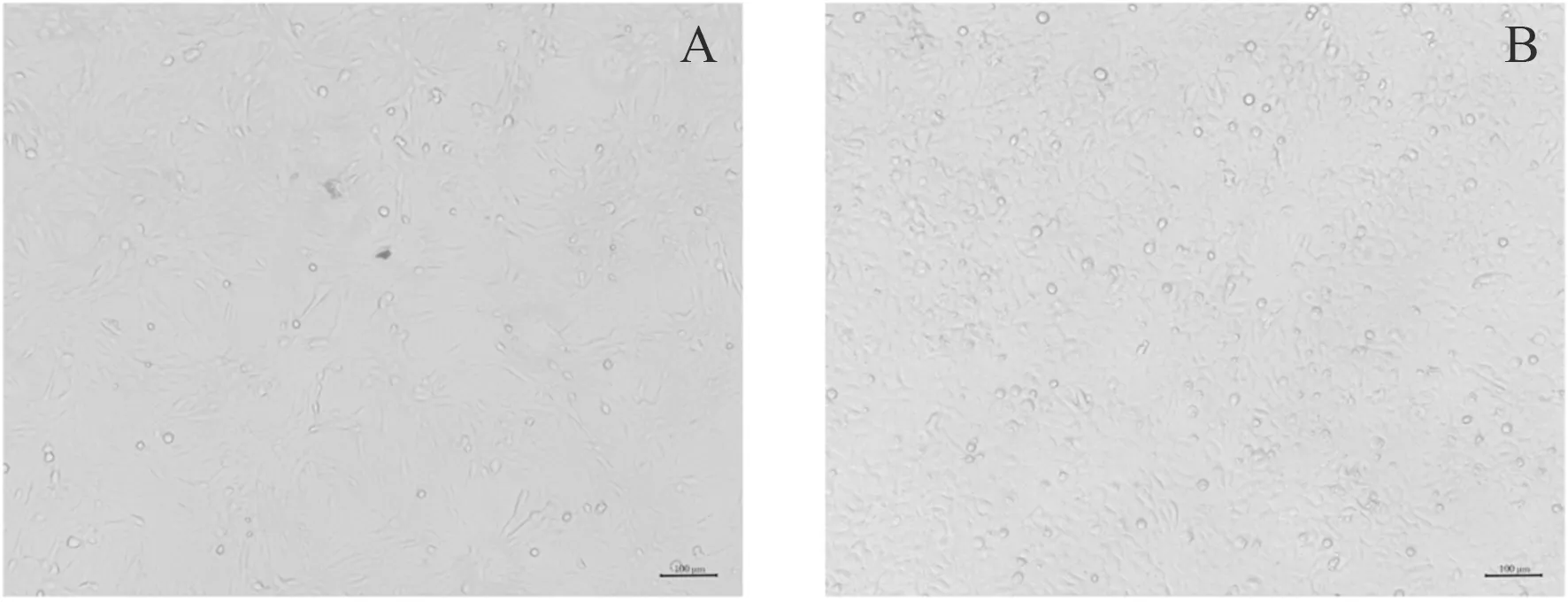
A:正常MA-104;B:感染RV分离毒株的MA-104
2.3 分离毒株VP6基因扩增
从图4可以看出,利用引物VP6-F/R,扩增获得1 356 bp的VP6基因全长片段,与预期结果相符。
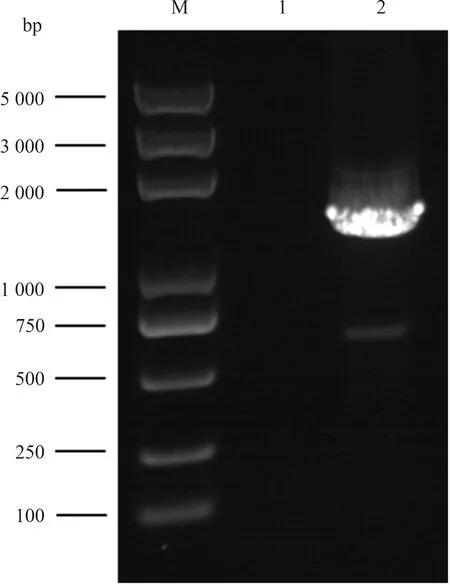
M:Trans2K Plus DNA Marker;1:阴性对照;2:VP6基因的扩增片段
2.4 基于VP6基因的遗传特征分析
测序结果表明,分离毒株RVA/Pig-wt/HN2019-01株VP6基因编码区全长为1 194 bp,核苷酸序列与参考毒株序列的相似性为76.7%~97.9%(图5),其中与SWU-1C(猪源)序列相似性最高(97.9%),与人源毒株相似性为81.6%~93.1%。分离株VP6蛋白由397个氨基酸组成,氨基酸序列与参考毒株序列的相似性为88.2%~99.7%(图6)。遗传进化分析结果表明,RVA/Pig-wt/HN2019-01株VP6基因与猪源中国株SWU-1C处于同一进化分支,亲缘关系最近,同属I5亚型(图7)。

图5 VP6基因核苷酸序列相似性分析

图6 VP6蛋白氨基酸序列相似性分析

图7 基于RV分离毒株VP6基因序列的系统进化分析
2.5 分离毒株VP6蛋白理化性质及修饰位点的预测分析
蛋白质理化性质及氨基酸组成分析结果显示,分离毒株VP6蛋白的397个氨基酸中含有39个碱性氨基酸(R、K、H)、36个酸性氨基酸(D、E)、142个亲水性氨基酸(G、Y、N、Q、S、T、C)、180个疏水性氨基酸(A、V、L、I、F、W、M、P)。VP6蛋白分子质量为44 717.91 u,理论等电点pI =6.11。该蛋白质在哺乳动物网状细胞、酵母和埃希氏大肠杆菌中表达的半衰期分别为30 h、大于20 h和大于10 h,在溶液中的不稳定指数为43.00(高于阈值40),属于不稳定蛋白。VP6蛋白存在4个N糖基化位点,分别位于26、58、167、345氨基酸处(图8),存在18个潜在磷酸化位点(包括9个丝氨酸、6个苏氨酸和3个酪氨酸)。
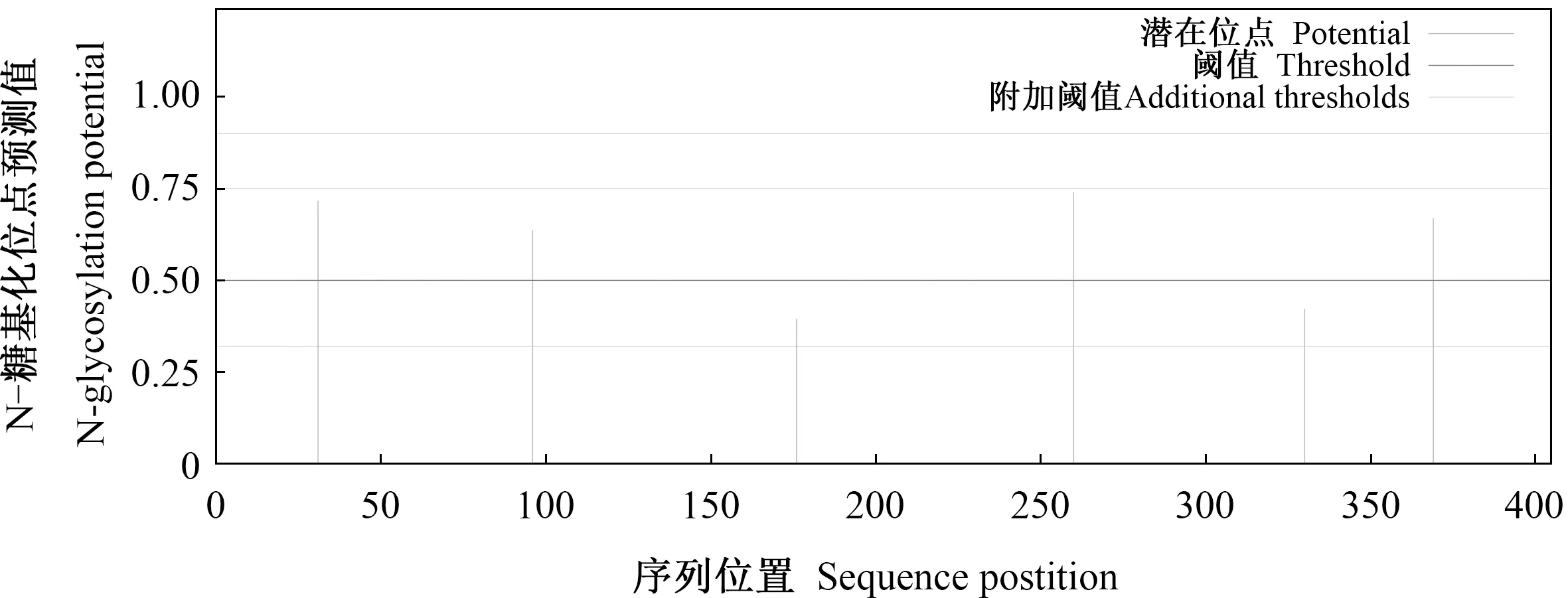
图8 RV分离毒株VP6蛋白N糖基化位点分析
2.6 分离毒株VP6蛋白二级结构预测
二级结构预测结果表明,RVA/Pig-wt/HN2019-01毒株VP6蛋白含有α-螺旋(Hh)(蓝色)、延伸链(Ee)(红色)、无规卷曲(Cc)(黄色)和β-转角(Tt)(绿色)等多种结构(图9)。其中,α-螺旋包含175个氨基酸,占44.08%;延伸链包含78个氨基酸,占19.65%;无规卷曲包含120个氨基酸,占30.23%;β-转角包含24个氨基酸,占6.05%。前3种结构贯穿于整个氨基酸链,β-转角主要分布在第250个氨基酸之后。
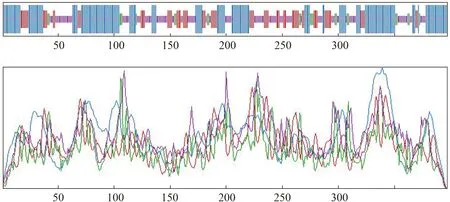
图9 RV分离毒株VP6蛋白二级结构预测
2.7 分离毒株VP6蛋白三级结构预测
从图10可以看出,分离毒株的VP6蛋白三级结构与已发表的牛轮状病毒RF毒株的VP6蛋白三级结构(PDB:1qhd)相似度较高。蛋白质结构叠加联配比对结果表明,分离毒株与RF毒株VP6蛋白结构的距离函数(Root-mean-square deviation,RMSD)值为0.076 Å,说明分离毒株RVA/Pig-wt/HN2019-01与RF毒株的VP6蛋白立体结构极为相似(RMSD值越小,结构间相似度越高)。

图10 RV分离毒株VP6蛋白三级结构预测
将RVA/Pig-wt/HN2019-01株的VP6氨基酸序列与已报道毒株(猪源OSU株、人源Wa株、鼠源EDIM株)的细胞毒性T淋巴细胞(CTL)抗原表位区域进行比对分析(表2),发现除个别位点(P295、P349)外,RVA/Pig-wt/HN2019-01的VP6在2个CTL抗原表位区域氨基酸序列保守。
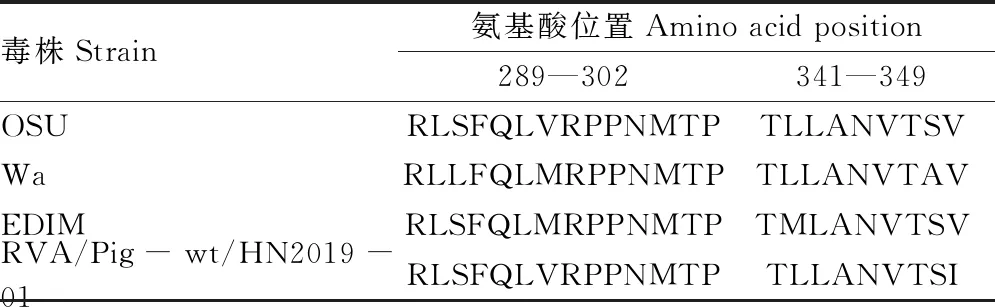
表2 VP6蛋白CTL抗原表位序列
3 结论与讨论
本研究分离获得猪RV毒株RVA/Pig-wt/HN2019-01,其VP6基因与GenBank数据库中已发表的RVA参考毒株的VP6基因核苷酸及其编码氨基酸序列的相似性分别为76.7%~97.9%和88.2%~99.7%,氨基酸的序列相似性比核苷酸的序列相似性整体要高,说明VP6核苷酸序列中存在一定数量的无义突变。研究发现,猪源RVA在检测到的G基因型和P基因型中通常有所不同,但大多具有I5-R1-C1-M1-A8-N1-T7-E1-H1遗传主链[21]。本研究中,RVA/Pig-wt/HN2019-01毒株VP6基因与已报道的猪源毒株SWU-1C核苷酸序列相似性最高,处于较近的进化分支,同属于I5亚群,而在此亚群中的BE2001毒株和Ryukyu-1120毒株均为能够感染人的轮状病毒,也提示了此毒株跨种传播的潜在风险。
VP6蛋白是轮状病毒的群特异性抗原,同群中高度保守,可以诱导针对不同轮状病毒毒株的交叉保护性免疫应答,具有良好的免疫原性和抗原性[22-23]。鼠轮状病毒EDIM株的P289—302区域被鉴定为CD4+T细胞抗原表位[24]。人轮状病毒Wa株的P340—348区域被鉴定为CD8+T细胞抗原表位[25]。本研究中,RVA/Pig-wt/HN2019-01的VP6蛋白三级结构与牛RV(RF毒株)的VP6蛋白结构高度一致,且氨基酸序列在已报道的2个CTL抗原表位区域相对保守。
综上,本研究分离的猪源RV河南株RVA/Pig-wt/HN2019-01为I5亚群的RV毒株,其VP6蛋白与牛源RV的VP6蛋白结构相似,且与鼠源及人源RV的CTL抗原表位区域序列相近。本研究结果为猪RV新型疫苗的设计、诊断试剂的研发及单克隆抗体的筛选等奠定了基础。
