国产头孢克肟胶囊在健康受试者体内的生物等效性研究
2021-07-21李晓斌王华伟王文萍
隋 鑫,李晓斌,王华伟,曹 莹,喻 明,陈 璐,王文萍
头孢克肟(cefixime)是第一个口服有效的第三代头孢菌素类抗生素[1],对革兰阳性菌及革兰阴性菌均有抗菌效果[2]。1999年已在80多个国家得到广泛的临床应用。头孢克肟的制剂剂型有胶囊剂、颗粒剂、混悬剂、片剂(普通片剂、咀嚼片、分散片)等。头孢克肟胶囊的原研公司为日本长生堂制药株式会社,商品名为Cefspan®。石药集团欧意药业有限公司生产的头孢克肟胶囊规格为0.1 g,批准文号为国药准字H20041669,属于国家基本药物目录。根据国务院规定,化学药品新注册分类实施前批准上市的仿制药,凡未按照与原研药品质量和疗效一致原则审批的,均须开展一致性评价[3]。本研究采用液相色谱串联质谱(HPLC-MS/MS)法测定给药后不同时间点头孢克肟血药浓度,以评价头孢克肟胶囊国产制剂与进口制剂在中国健康受试者的生物等效性及安全性,为临床用药提供参考。
1 材料与方法
1.1 材料和研究对象
1.1.1 药物与仪器 参比药物:头孢克肟胶囊(商品名Cefspan®),规格0.1 g/粒,批号BG011,含量102.2%,由日本长生堂制药株式会社生产,由石药集团欧意药业有限公司提供。受试制剂:头孢克肟胶囊(商品名欧健),0.1 g/粒,批号136170998,含量99.3%,由石药集团欧意药业有限公司生产和提供。
头孢克肟对照品:HPLC纯度99.0%,批号1250-023A1,TLC公司提供; [13C3,15N2]-头孢克肟(头孢克肟内标物):HPLC纯度 95.22%,核素纯度 99%13C, 98.6%15N,批号ZZS17101801,IsoReag提供。
研究用仪器如下:AB Sciex API 4000 质谱仪;岛津LC-20ADXR液相色谱系统;Thermo Fisher Heraeus Muitifuge X1R离心机;Sartorius CPA225D或MSA6.6S-OCE-DM分析天平;Merck Millipore Milli-Q纯水仪;ABSciexAnalyst 1.6.3®数据采集软件。
1.1.2 受试者的选择 本研究由辽宁中医药大学附属医院国家药物临床试验机构承担,试验方案经辽宁中医药大学附属医院药物临床试验伦理委员会批准。受试者签署知情同意书。按照受试者随机号将健康受试者按照1∶1比例随机分配到 2个给药程序(受试制剂T-参比制剂R或参比制剂R-受试制剂T)之一。
入选标准:18周岁及以上的健康受试者;体重指数在19.0~26.0 kg/m2,男性受试者体重≥50.0 kg,女性受试者体重≥45.0 kg。无心、肝、肾、消化道、内分泌、血液系统、呼吸系统、神经系统以及精神异常,代谢异常等病史。
排除标准:有烟酒嗜好者;有头孢菌素类、青霉素类抗生素过敏史、其他药物或食物过敏史、过敏体质者;生命体征、体格检查、心电图及各项实验室检查结果异常且经临床医师判断有临床意义;酒精呼气检查、尿液药物筛查呈阳性者;乙型肝炎病毒、丙型肝炎病毒抗原(抗体)阳性者,HIV阳性者;给药前28 d内服用了任何改变肝酶活性的药物;给药前14 d内服用了任何处方药、非处方药、草药等。
空腹组入组32名健康受试者:其中T-R组有男12名、女4名,平均年龄为(25.3 ± 8.0)岁(19.1~47.8岁),平 均 身 高 为(170.5 ± 8.0)cm(157.5~189.5 cm),平均体重为(62.0 ± 9.1)kg(49.3~86.2 kg),平均体重指数为(21.3 ± 2.1)kg/m2(19.0~25.0 kg/m2);R-T组有9名男性受试者、7名女性受试者,平均年龄为(25.7 ± 6.5)岁(19.6~39.6岁),平均身高为(167.0 ± 8.2)cm(157.0~182.0 cm),平均体重为(64.1 ± 9.1)kg(48.6~81.4 kg) ,平 均 体 重 指 数 为(23.0 ± 2.2)kg/m2(19.0~26.0 kg/m2)。餐 后 组 入 组26名健康受试者:其中T-R组有11名男性受试者、2名女性受试者,平均年龄为(25.3 ± 4.5)岁(21.3~35.0岁),平均身高为(172.2 ± 6.3)cm(158.5~182.0 cm),平均体重为(64.5 ± 5.8)kg(56.6~74.5 kg),平 均 体 重 指 数 为(21.7 ± 1.3)kg/m2(19.5~23.9 kg/m2);R-T组 有8名 男性受试者、5名女性受试者,平均年龄为(28.7 ± 10.6)岁(19.4~56.5岁),平均身高为(166.9 ± 10.3)cm(148.5~185.0 cm),平均体重为(62.4 ± 8.7)kg(45.1~75.0 kg),平均体重指数为(22.3 ± 1.6) kg/m2(19.8~24.8 kg/m2)。
1.2 给药方案和血样采集及处理
1.2.1 给药方案 本试验采用单中心、空腹/餐后、随机、开放、两周期、两交叉试验设计。空腹组和餐后组分别入组32名和26名受试者,随机分为2组,分别口服头孢克肟胶囊受试制剂和参比制剂0.1 g(1粒),用药间隔7 d。空腹试验组受试者每周期给药当天,在空腹10 h后以240 mL常温水送服相应药物;餐后试验组受试者每周期给药当天给药前30 min开始进食高脂餐,并在30 min内进餐完毕,在开始进餐后30 min时准时以240 mL常温水送服相应制剂。
1.2.2 血样采集及处理 每周期给药0时(给药前60 min内)和给药后0.5 h、1 h、1.5 h、2 h、2.5 h、3 h、3.5 h、4 h、4.5 h、5 h、5.5 h、6 h、6.5 h、7 h、8 h、9 h、10 h、12 h、16 h、24 h采集静脉血。每个时间点采集静脉血约4 mL,至预冷的EDTA-K2抗凝管中,将采血管上下轻柔颠倒数次至血样混匀,置于冰浴中暂放,血样采集后60 min内在预冷离心机2~8 ℃条件下,2000 ×g,离心10 min,所有离心后血浆样品在冰浴上被分为两份,其中取约 1 mL 血浆加入到待测管中,其余血浆放入到备份管中。血样采集2 h内将血浆样品放入超低温冰箱(≤-60℃)冻存。
1.2.3 色谱-质谱条件和血浆样品预处理
1.2.3.1 色谱条件 色谱柱:Ultimate XB-C18(2.1 mm×50 mm,3 μm);流动相:A为含0.05% 乙酸和5.00 mmol/L NH4Ac的水溶液,B为100%甲醇;流速:0.400 mL/min;柱温:40 °C;梯度洗脱 (0 min,15% B;0.3 min,15% B;0.5 min,50% B;1.8 min,50% B;1.9 min,95% B;3 min,95% B;3.1 min,15% B;4.5 min,15% B);进样量:10 μL。
1.2.3.2 质谱条件 离子源:Turbo Spray(ABSciex生产),ESI,正离子模式;扫描方式为MRM;头孢克肟和内标[13C3,15N2]-头孢克肟去集束电压(DP)分别为68V和70V,碰撞能量(CE)分别为22V和21V;头孢克肟用于定量分析的离子对为m/z454.0→m/z285.2,内标离子对为m/z459.0→m/z290.1。
1.2.3.3 血浆样本预处理 待测生物样品室温融化后,转移至冰浴条件下存放,向96孔板中加入50.0 μL样品(待测生物样品、标准曲线样品、质控样品);对于双空白样品和零点样品,加入50.0 μL空白人血浆。除双空白样品和不含内标的定量上限样品外,向所有样品中加入50.0 μL内标工作溶液(1 000 μg/L);对于双空白样品和不含内标的定量上限样品中,加 50.0 μL 50%甲醇水溶液。将96孔板充分振摇1 min。向所有样品中加入200 μL甲醇。将96孔板密封后,充分振摇10 min。将所有样品在4 ℃条件下以4 000 r/min转速离心10 min。将50.0 μL上清液转移到干净的96孔板中,以200 μL超纯水稀释。将96孔板密封后,充分振摇10 min,放置于自动进样器中,10.0 μL进样分析。
1.2.4 统计学处理 用Phoenix WinNonlin(8.0版)软件以非房室模型计算各受试者体内头孢克肟的药动学参数。并对AUC0-t、AUC0-∞和Cmax经自然对数转换后进行方差分析(ANOVA),然后采用双单侧t检验、计算90%CI统计分析方法来评价受试制剂与参比制剂的生物等效性。当受试制剂与参比制剂的Cmax、AUC0-t、AUC0-∞几何均值比的90%CI在80.00%~125.00%区间内,则认为两制剂生物等效。
2 结果
2.1 受试者入组及完成情况
空腹组随机33名受试者,有1名于第一周期给药前出现不良事件,退出试验;有2名受试者在第二周期给药前退出试验,未参加第二周期试验,30名受试者均按方案要求完成试验;餐后组入组26名健康受试者,均按方案要求完成试验。
2.2 方法学评价
2.2.1 专属性 头孢克肟与其内标的保留时间均约为1.24 min,色谱峰峰形良好。血浆中内源性物质不干扰样品的测定。
2.2.2 标准曲线与定量下限 以待测物(头孢克肟)与内标 [13C3,15N2] -头孢克肟的色谱峰面积的比值为纵坐标,以血浆中待测物的质量浓度(x)与峰面积比(y)进行线性回归,头孢克肟血浆标准曲线的质量浓度为20、40、150、500、1 500、2 500、3 200 μg/L,所得头孢克肟回归方程为y=0.001 313x+0.0 003 263(r2=0.998 1)。结果表明头孢克肟血药浓度在20~3 200 μg/L范围内线性关系好,其定量下限为20 μg/L。
2.2.3 精密度与准确度 制备定量下限浓度水平和低、中、高3个浓度水平的质控样品(头孢克肟的质量浓度为20、50、800、2 400 μg/L),每浓度取6样本分析,连续测定3 d,根据当日的标准曲线计算QC样品的实测质量浓度,结果表明低、中、高3个浓度水平的质控样品检测结果的批内和批间精密度均≤4.2%,定量下限浓度水平的质控样品检测结果的批内和批间精密度均小于≤6.4%。除定量下限浓度水平外的质控样品的批内检测准确度偏差为-3.3%~3.6%,定量下限浓度水平的质控样品的批内检测准确度偏差为8.5%~10.0%,除定量下限浓度水平外的质控样品的批间检测准确度偏差为-1.7%~1.0%,定量下限浓度水平的质控样品的批间检测准确度偏差为9.5%。表明各质量浓度质控样品的批内、批间精密度和准确度良好。
2.2.4 提取回收率和基质效应 低、中、高3个质量浓度的提取回收率分别为91.6%、91.1%、93.9%,内标[13C3,15N2]-头孢克肟的提取回收率为92.7%,血样中头孢克肟和内标提取回收率均较高和稳定。6个不同来源的单个基质中,头孢克肟低、中、高浓度水平下,内标归一化的基质因子均值为97.1%~101.2%,精密度≤2.5%;3个浓度水平内标归一化的基质因子总平均值为99.1%,精密度为2.1%,符合基质效应考察的要求。
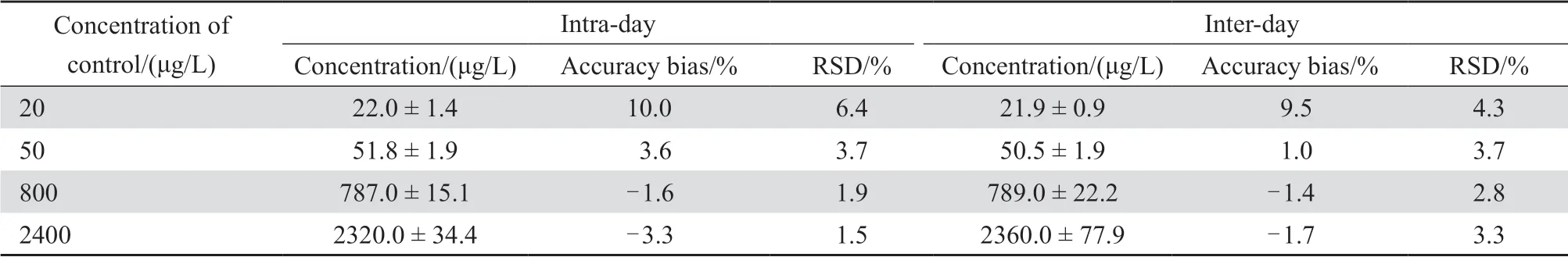
表1 头孢克肟在血浆中的精密度和准确度Table 1 Accuracy and precision of cefixime concentration in plasma
2.2.5 稳定性 头孢克肟血浆样品室温/冰浴下放置15.5 h、-20 ℃/-70 ℃条件下5次冻融循环、 -20 ℃条件下长期冰冻7 d 1 h、-70℃条件下长期冰冻26 d、69 d;血浆样品处理后的上清液在 8 ℃自动进样器中(处理后样品稳定性)放置4 d 4 h、血浆样品处理后的上清液稀释液在8 ℃自动进样器中(进样重现性)放置4 d 3 h和7 d 9 h,以上条件下稳定性均良好。
2.3 平均血药浓度-时间曲线
空腹和餐后试验中受试者服药后头孢克肟血药浓度-时间曲线见图1和图2。
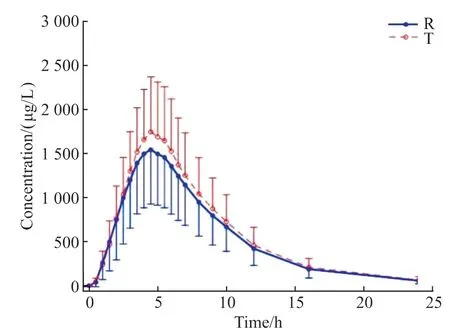
图1 空腹组受试者服用受试制剂(T)与参比制剂(R)后血浆中头孢克肟平均血药浓度-时间曲线Figure 1 Mean plasma concentration-time curve of test (T) and reference (R) cefixime after single dose of cefixime capsule under fasted condition
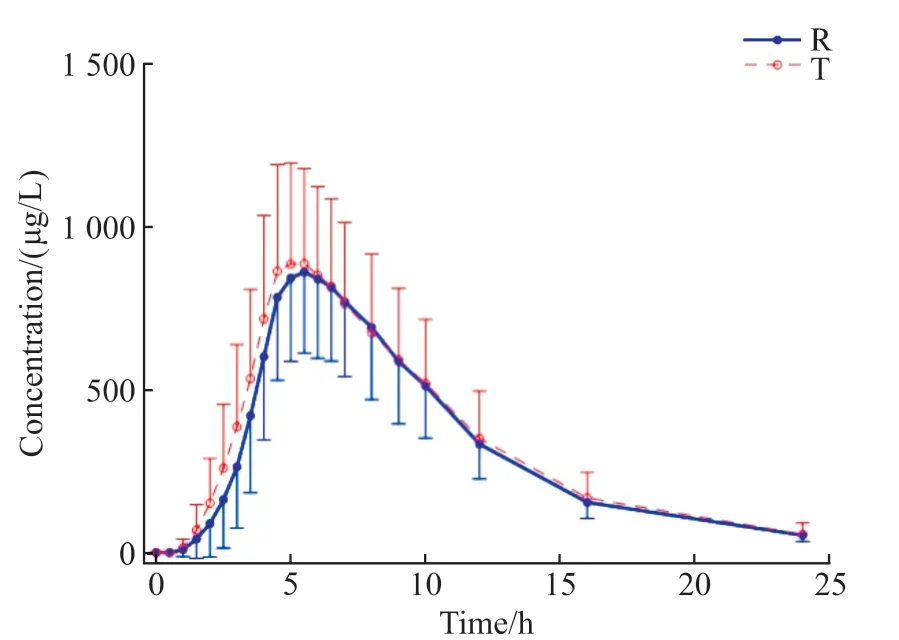
图2 餐后组受试者服用受试制剂(T)与参比制剂(R)后血浆中头孢克肟平均血药浓度-时间曲线Figure 2 Mean plasma concentration - time curve of test (T) and reference (R) cefixime after single dose of cefixime capsule under fed condition
2.4 药动学参数
空腹试验有30名健康受试者口服受试制剂和32名健康受试者口服参比制剂,有2名受试者在第二周期入住日退出试验,而未进入药动学分析集(PKS)。餐后试验组26名受试者全部纳入药动学参数集分析。受试者空腹和餐后单次口服受试制剂和参比制剂后血浆中头孢克肟的药动学参数见表2。
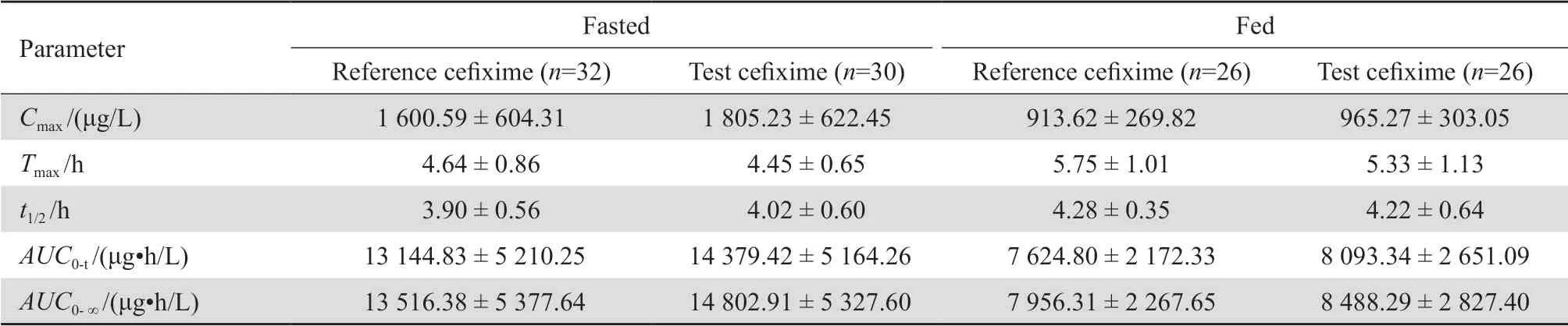
表2 空腹和餐后试验头孢克肟主要药动学参数Table 2 The main pharmacokinetic parameters of cefixime under fasted and fed conditions
2.5 生物等效性评价
表3中数据结果表明,经双单侧t检验分析后,Cmax、AUC0-t、AUC0-∞的几何均数比值(受试制剂/参比制剂)的90%CI结果均在可接受等效范围(80.00%~125.00%)内,P值均<0.05,即本试验两制剂在空腹给药条件下和餐后给药条件下均具有生物等效性。

表3 头孢克肟胶囊生物等效性结果Table 3 Bioequivalence of test cefixime capsules compared to reference cefixime capsules
2.6 安全性评价
空腹试验过程中30名受试者服用受试制剂,有4名受试者发生5例次不良事件,其中1名受试者发生2次不良反应,分别为血白细胞计数降低1次和血中性粒细胞计数降低1次,有1名受试者失访。32名受试者服用参比制剂,有7名受试者发生10例次不良事件,其中2名受试者发生4例次不良反应,分别为白细胞计数降低2例次和中性粒细胞计数降低2例次,有2名受试者失访。除1名受试者的1次不良事件严重程度为中度,其余不良事件均为轻度。2名受试者因不良事件退出。
餐后试验所有26名受试者用药后均完成安全性观察,受试制剂有6名受试者发生8例次不良事件,其中3名受试者发生5例次不良反应,分别为白细胞计数降低3次和中性粒细胞计数降低2次,有1名受试者失访。参比制剂有3名受试者发生4例次不良事件,其中2名受试者发生3例次不良反应,分别为丙氨酸转氨酶升高1次、白细胞计数降低1次和中性粒细胞计数降低1次,有2名受试者失访。受试者的不良事件的严重程度均为轻度。两组均无严重不良事件发生。试验期间发生的不良事件已按照该方案的要求及标准操作规程进行了申报和处理。表明受试制剂和参比制剂的安全性和耐受性良好。
3 讨论
本分析方法采用稳定核素标记的[13C3,15N2]-头孢克肟作为内标,[13C3,15N2]-头孢克肟与待测物头孢克肟有相同的理化性质,两者保留行为和离子化行为一致,可以避免基质效应、回收率等导致检测结果不可靠的情况出现。HPLC-MS/MS具有灵敏度高、选择性好的优势特点。本试验结果显示,空腹试验头孢克肟受试制剂与参比制剂的达峰时间分别为(4.45±0.65)h和(4.64±0.86)h,与文献报道基本一致[4-5];餐后试验头孢克肟受试制剂与参比制剂的达峰时间分别为(5.33±1.13)h和(5.75 ±1.01)h,结合本试验获得药动学参数,提示进食高脂餐可能会导致头孢克肟达峰时间延迟、吸收减少。
本研究受试制剂和参比制剂的各药动学参数均非常接近,两种制剂的药动学特点相似,Cmax、AUC0-t、AUC0-∞的 几 何 均 值 比 值 的90%CI皆 在80.00%~125.00%,表明本试验受试制剂与参比制剂生物等效。安全性数据表明,中国健康受试者单次空腹和餐后服用0.1 g头孢克肟胶囊安全性良好。综上所述,中国健康志愿者空腹和餐后状态下口服0.1 g头孢克肟胶囊受试制剂与参比制剂具有生物等效性,受试制剂与参比制剂安全性和耐受性均良好。
