氨甲苯酸注射液中20种元素杂质的含量测定及相容性考察
2021-07-20黄海张耀文宋佳璇于明徐万魁
黄海 张耀文 宋佳璇 于明 徐万魁
摘 要 目的:建立測定氨甲苯酸注射液中20种元素杂质含量的方法,并考察该注射液在低硼硅玻璃安瓿中的相容性。方法:样品以5%硝酸溶液稀释后,分别以钪、铟、铋为内标,采用电感耦合等离子体质谱法测定各元素杂质。载气(氩气)流量为0.92 L/min,碰撞气(氦气)流量为4.5 L/min,射频功率为1 895 W,等离子气流量为18 L/min,泵速为40 r/min,进样延迟时间为65 s;测量模式为碰撞模式,数据采样模式为跳峰模式,重复次数为3次。样品于70 ℃条件放置1、3个月后进行加速试验,通过比较元素杂质含量的变化趋势进行相容性考察。结果:钒、钴、铬、砷、镉、锑、汞、铊、铅检测质量浓度的线性范围均为0.01~20 μg/L,镁、铝、铁、镍、铜、锌、钡检测质量浓度的线性范围均为0.1~200 μg/L,硼、硅、钾、钙检测质量浓度的线性范围均为1~2 000 μg/L(r≥0.999 8);精密度、中间精密度、稳定性(8 h)、重复性试验的RSD均小于6%;定量限为0.000 7~2.986 3 μg/L,检测限为0.000 2~0.895 9 μg/L;平均加样回收率为88.50%~111.00%(RSD为0.52%~2.33%,n=9)。8家企业的氨甲苯酸注射液中20种元素杂质的含量最低值均小于检测限,最大值分别为3 835.9 μg/L(0个月)、10 448.4 μg/L(1个月)、17 261.2 μg/L(3个月)。20种元素杂质中,除硼、铝、镁、硅、钙、钾未有限度规定外,其余元素杂质含量均小于分析评价阈值。相容性考察结果显示,硼、铝、硅、钾、锌、砷、钡等7种元素杂质含量有增大趋势,1个月和3个月加速样品中硅浓度、硅/铝及硅/硼浓度比值较0个月样品均有较大变化。结论:所建方法灵敏度高、重复性和准确度均较好,可用于氨甲苯酸注射液中20种元素杂质的含量测定;低硼硅安瓿与氨甲苯酸注射液相互作用较为明显。
关键词 氨甲苯酸注射液;电感耦合等离子体质谱法;低硼硅玻璃;相容性;元素杂质
ABSTRACT OBJECTIVE: To establish a method to determine the contents of 20 elements impurities in Aminomethylbenzoic acid injection, and to investigate its compatibility in low-borosilicate glass ampoules. METHODS: The sample was diluted with 5% nitric acid solution, and then determined by ICP-MS using scandium, indium and bismuth as internal standards. The nebulizer flow (argon) was 0.92 L/min, collision gas flow (helium) was 4.5 L/min, RF power was 1 895 W, plasma flow was 18 L/min, pump speed was 40 r/min, injection delay time was 65 s. The collision mode was used as measurement mode, the data sampling adopted peak skipping mode, and repeated for 3 times. The accelerated test was carried out after sample was stored at 70 ℃ for 1 and 3 months, and the compatibility was investigated by comparing the change trend of element impurity content. RESULTS: The linear range of vanadium, cobalt, chromium, arsenic, cadmium, antimony, mercury, thallium and lead were 0.01-20 μg/L; those of magnesium, aluminium, ferrum, nickel, copper, zinc, barium were 0.1-200 μg/L; those of boron, silicon, potassium and calcium were 1-2 000 μg/L (r≥0.999 8). RSDs of precision, intermediate precision, stability (8 h) and repeatability test were all lower than 6%. The limits of quantitation were 0.000 7-2.986 3 μg/L; the limits of detection were 0.000 2-0.895 9 μg/L. The average recoveries were 88.50%-111.00% (RSDs were 0.52%-2.33%, n=9). The minimum content of 20 element impurities was less than detection limits, the maximum contents were 3 835.9 μg/L (0 month), 10 448.4 μg/L(1 month), 17 261.2 μg/L (3 month) in Aminomethylbenzoic acid injection from 8 manufacturers. Among the 20 elements impurities, except that boron, aluminum, magnesium, silicon, calcium and potassium were not specified, the contents of other elements were less than the threshold. The research of compatibility showed that the impurity contents of seven elements such as boron, aluminum, silicon, potassium, zinc, arsenic and barium showed an increasing trend. The silicon concentration, silicon/aluminum concentration ratio and silicon/boron concentration ratio in the accelerated samples after stored for one and three months were significantly different from those stored for 0 month. CONCLUSIONS: The established method is sensitive, reproducible and accurate, and can be used for the content determination of 20 element impurities in Aminomethylbenzoic acid injection. The interaction between low-borosilicate ampoule and Aminomethylbenzoic acid injection is obvious.
KEYWORDS Aminomethylbenzoic acid injection; ICP-MS; Low-borosilicon glass; Compatibility; Element impurities
氨甲苯酸又称止血芳酸,是一种抗纤溶止血药,主要用于原发性纤维蛋白过度溶解引起的出血,包括急性、慢性、局限性或全身性高纤溶出血的临床治疗[1-2]。目前,我国已上市的氨甲苯酸制剂有片剂和注射剂两种,其中注射剂给药后因可直接接触人体组织或进入血液系统,故被认为是风险程度最高的品种之一[3]。氨甲苯酸注射液多采用低硼硅玻璃安瓿为容器,低硼硅玻璃中通常含有硅(Si)、硼(B)、铝(Al)、镁(Mg)、铁(Fe)、钡(Ba)、锌(Zn)、钴(Co)等多种金属元素,而氨甲苯酸注射液為偏酸性药物,因此灌装后可能会出现有害元素杂质,造成药物主成分被吸附导致的含量下降、玻璃脱片等问题,从而影响药品的稳定性和安全性[4]。
人用药品注册技术要求国际协调会元素杂质指导原则(ICH Q3D)中,将34种元素杂质根据其毒性及在药品中出现的可能性分为5类(1类、2A类、2B类、3类和其他类),并明确规定了化学药品注射剂中1类、2A类、2B类、3类元素杂质的每日允许最大暴露量(PDE),要求已授权上市及新注册申请上市的化学药品必须满足元素杂质限度要求[5]。第42版《美国药典》[6]、2020版《英国药典》中规定的元素杂质种类和限度[7],基本与ICH Q3D一致。我国原国家食品药品监督管理总局于2015年颁布的《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》,明确要求在相容性研究中的相互作用研究部分应全面考虑包材成分的迁移,需对药液中Si、B、Al等可预示玻璃被侵蚀或产生脱片的元素杂质进行检查[8]。
电感耦合等离子体质谱法(ICP-MS)具有灵敏度高、线性动态范围宽、回收率高等优点,可以同时快速测定多个元素杂质,现已被广泛用于痕量元素杂质含量的分析检测[9]。近年来,ICP-MS法测定药品原料及其制剂中元素杂质含量的研究屡有报道[10-16]。根据低硼硅安瓿的成分特点以及本课题组前期对氨甲苯酸注射液的定性扫描结果,本文拟采用ICP-MS法测定8家不同企业生产的氨甲苯酸注射液中B、Mg、Al、Si、钾(K)、钙(Ca)、钒(V)、Fe、Co、铬(Cr)、镍(Ni)、铜(Cu)、Zn、砷(As)、镉(Cd)、锑(Sb)、Ba、汞(Hg)、铊(Tl)、铅(Pb)等20种元素杂质的含量,并通过加速试验考察该注射液与低硼硅玻璃的包材相容性,旨在为其质量控制和包材相容性研究提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有NexION 350X型ICP-MS仪(含Micromist雾化器、石英旋流雾室,美国PerkinElmer公司)、KBF-240型恒温恒湿培养箱(德国Binder公司)、XP205型电子分析天平(美国Mettler Toledo公司)等。
1.2 主要药品与试剂
B标准液(批号191007-1)、Mg标准液(批号185045-1)、Al标准液(批号18C002-4)、Si标准液(批号19B050)、K标准液(批号184030-4)、Ca标准液(批号20211114)、V标准液(批号18C019-2)、Fe标准液(批号185022-2)、Co标准液(批号191059-2)、Cr标准液(批号191037-2)、Ni标准液(批号18C029-3)、Cu标准液(批号189054-2)、Zn标准液(批号193005-8)、As标准液(批号191010-2)、Cd标准液(批号191037-2)、Sb标准液(批号18C025-3)、Ba标准液(批号18B034-2)、Hg标准液(批号18C033-2)、Tl标准液(批号206002)、Pb标准液(批号191001)和内标钪(45Sc)标准液(批号205009)、铟(115In)标准液(批号18B016)、铋(209Bi)标准液(批号18B020-2)均购自国家有色金属及电子材料分析测试中心,质量浓度均为1 000 μg/mL;硝酸(痕量金属级)购自赛默飞世尔科技(中国)有限公司;水为纯净水。
8批氨甲苯酸注射液分别购自常州兰陵制药有限公司(A企业,批号11811130)、湖南洞庭药业股份有限公司(B企业,批号2001112)、湖南五洲通药业有限责任公司(C企业,批号19122412)、上海浦津林州制药有限公司(D企业,批号190917211)、上海信谊金朱药业有限公司(E企业,批号2010106)、扬州制药有限公司(F企业,批号A191216)、扬州中宝药业股份有限公司(G企业,批号319082201)、郑州卓峰制药有限公司(H企业,批号1810131C3),规格均为10 mL ∶ 100 mg;氨甲苯酸原料药(扬州制药有限公司,批号AJ20190004)。
2 方法与结果
2.1 ICP-MS条件
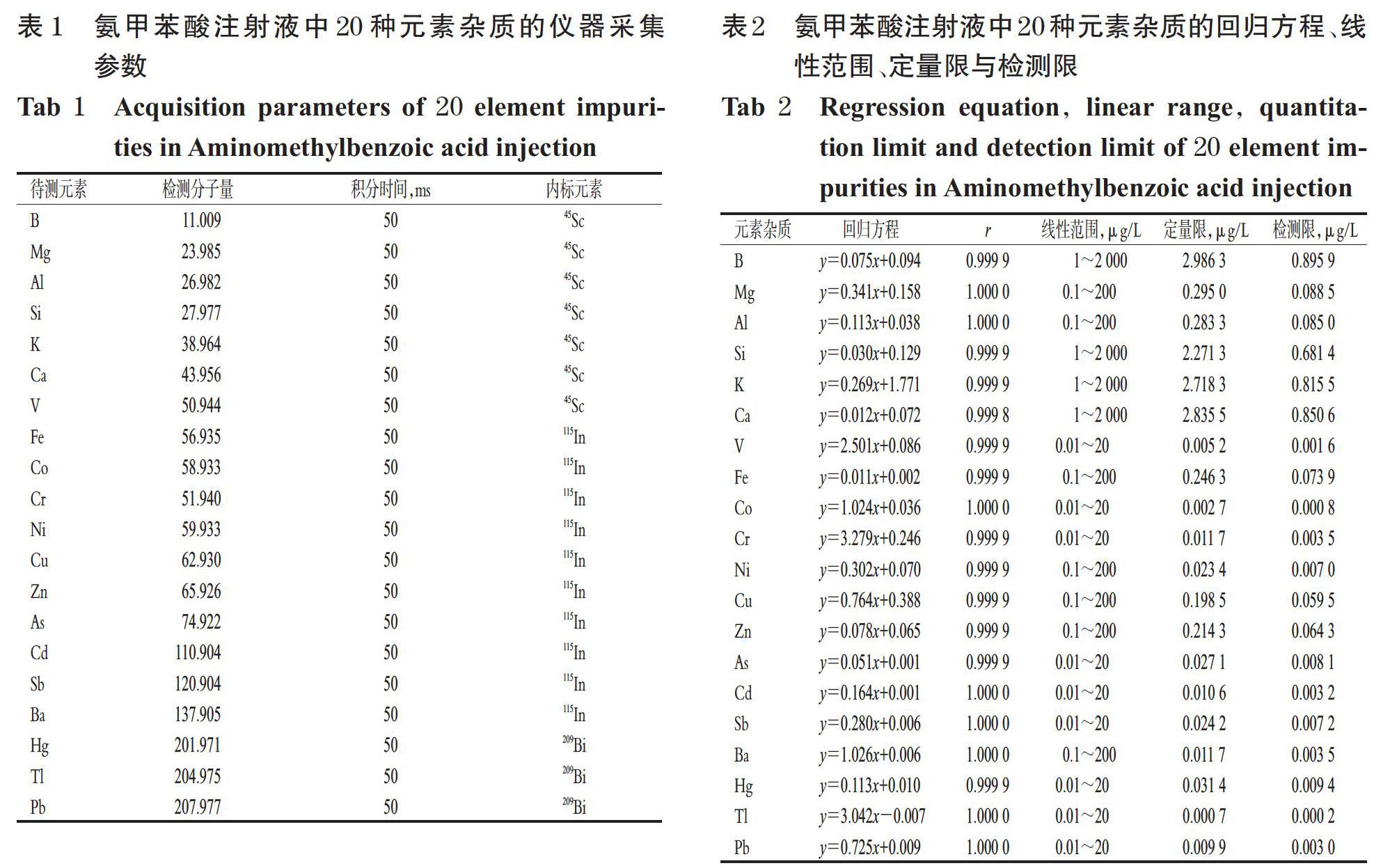
载气(氩气)流量为0.92 L/min,碰撞气(氦气)流量为4.5 L/min,射频功率为1 895 W,等离子气流量为18 L/min,泵速为40 r/min,进样延迟时间为65 s;测量模式为碰撞模式,数据采样模式为跳峰模式,重复次数为3次。20种元素杂质的仪器采集参数见表1。
2.2 溶液的制备
2.2.1 内标混合溶液 精密量取45Sc、115In、209Bi标准液适量,置于同一塑料量瓶中,加5%硝酸溶液稀释,制得质量浓度均为10 μg/L的内标混合溶液。
2.2.2 混合对照品溶液 精密量取各元素杂质标准液适量,置于同一100 mL塑料量瓶中,加5%硝酸溶液稀释,制得V、Co、Cr、As、Cd、Sb、Hg、Tl、Pb质量浓度为1 mg/L,Mg、Al、Fe、Ni、Cu、Zn、Ba质量浓度为10 mg/L,B、Si、Ca、K质量浓度为100 mg/L的混合对照品溶液。
2.2.3 标准曲线溶液 精密量取“2.2.2”项下混合对照品溶液适量,加5%硝酸溶液稀释,制得V、Co、Cr、As、Cd、Sb、Hg、Tl、Pb质量浓度为0.01、0.1、0.5、5、10、20 μg/L,Mg、Al、Fe、Ni、Cu、Zn、Ba质量浓度为0.1、1、5、50、100、200 μg/L,B、Si、Ca、K质量浓度为1、10、50、500、1 000、2 000 μg/L的系列标准曲线溶液。
2.2.4 供试品溶液 精密量取样品1 mL,置于10 mL塑料量瓶中,加5%硝酸溶液稀释至刻度,摇匀,即得。
2.2.5 加样回收率溶液 取氨甲苯酸原料药适量,按处方制备氨甲苯酸注射液;精密量取上述注射液5 mL,置于50 mL塑料量瓶中,分别精密加入“2.2.2”項下混合对照品溶液0.1、0.2、0.4 mL,加入5%硝酸溶液稀释至刻度,摇匀,制得低、中、高3个质量浓度的加样回收率溶液,并同法制备加样回收率空白溶液(即不加“2.2.2”项下混合对照品溶液)。
2.2.6 空白溶液 以5%硝酸溶液为空白溶液。
2.3 线性关系考察
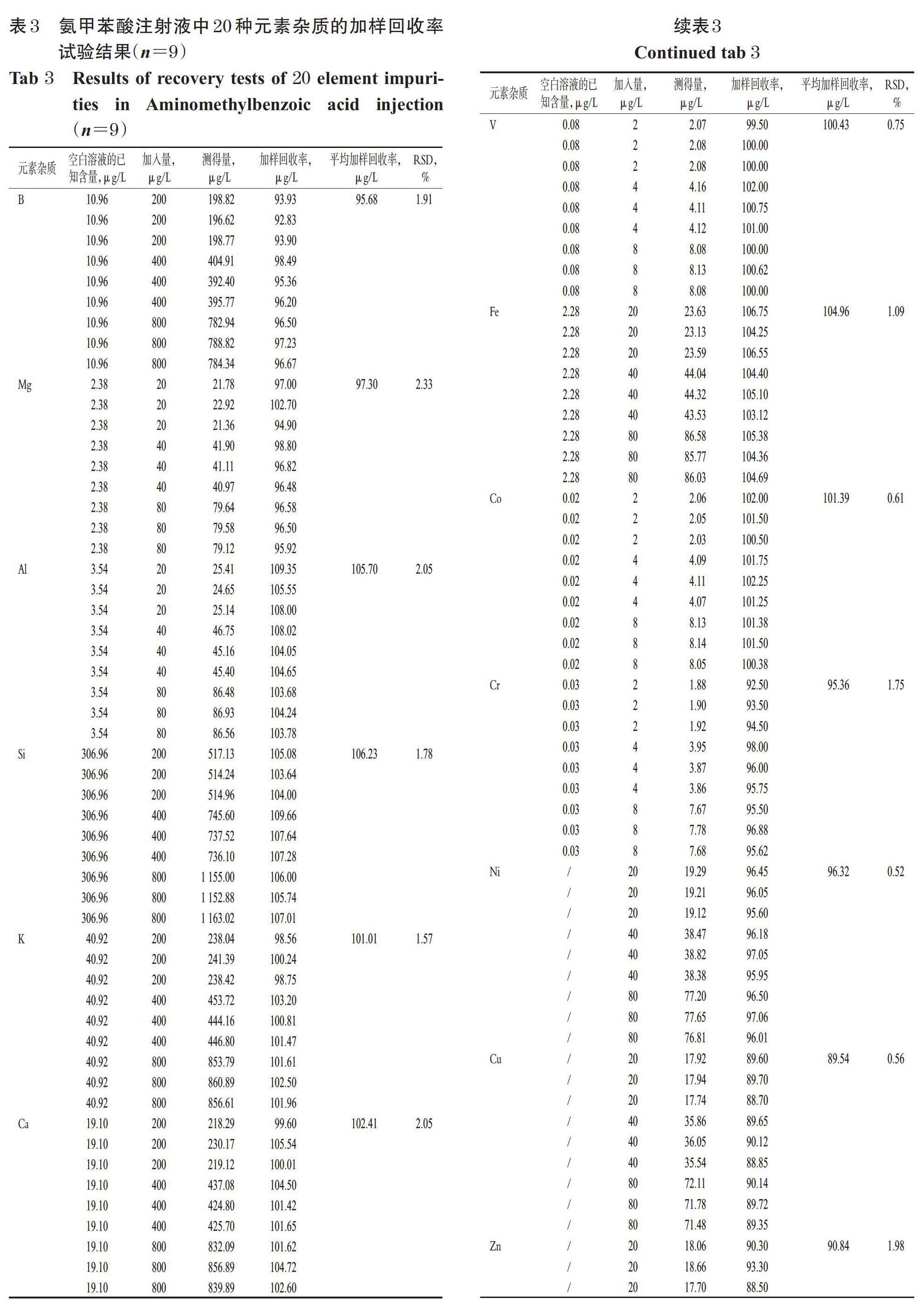
取“2.2.3”项下系列标准曲线溶液,加入“2.2.1”项下内标混合溶液,摇匀,按“2.1”项下ICP-MS条件进样测定,记录响应值。以各待测元素的质量浓度(x,μg/L)为横坐标、各元素响应值与对应的内标响应值的比值(y)为纵坐标进行线性回归,结果见表2。
2.4 定量限与检测限考察
取“2.2.6”项下空白溶液,按“2.1”项下ICP-MS条件进样测定11次,记录响应值并计算11次检测结果的标准偏差,以10倍标准偏差与标准曲线斜率的比值测定定量限,3倍标准偏差与标准曲线斜率的比值测定检测限。结果,20种元素杂质的定量限为0.000 7~2.986 3 μg/L,检测限为0.000 2~0.895 9 μg/L,详见表2。
2.5 精密度试验
精密量取“2.2.2”项下混合对照品溶液0.1 mL,置于50 mL塑料量瓶中,加入5%硝酸溶液稀释至刻度,摇匀,按“2.1”项下ICP-MS条件连续进样测定6次,记录响应值。结果,20种元素杂质响应值的RSD≤3.4%(n=6),表明仪器精密度良好。
2.6 中间精密度试验
由另一实验者按“2.7”项下方法制备供试品溶液,共6份,再按“2.1”项下ICP-MS条件进样测定,记录响应值。结果,20种元素杂质响应值的RSD≤5.3%(n=12),表明方法中间精密度良好。
2.7 重复性试验
按“2.2.5”项下低质量浓度溶液方法制备供试品溶液,共6份,再按“2.1”项下ICP-MS条件进样测定,记录响应值并按标准曲线法计算元素杂质的含量。结果,20种元素杂质含量的RSD≤2.1%(n=6),表明方法重复性良好。
2.8 稳定性试验
取“2.7”项下供试品溶液,分别于室温下放置0、2、4、6、8 h时按“2.1”项下ICP-MS条件进样测定,记录响应值。结果,20种元素杂质响应值的RSD≤3.5%(n=5),表明供试品溶液在室温下放置8 h 内稳定性良好。
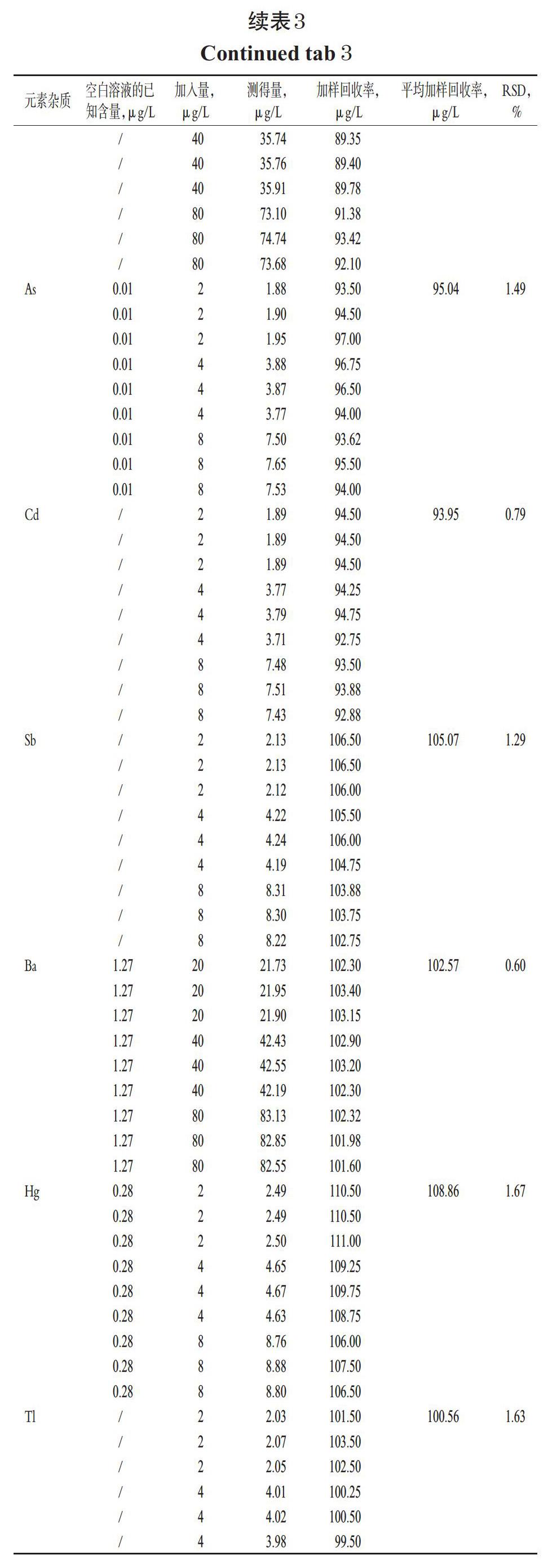
2.9 加样回收率试验
取“2.2.5”项下加样回收率溶液、加样回收率空白溶液,按“2.1”项下ICP-MS条件进样测定,记录响应值并计算加样回收率,结果见表3。结果,20种元素杂质的准确度良好(表中,“/”表示低于检测限,计算时以0计)。
2.10 样品中元素杂质的含量测定
取氨甲苯酸注射液,置于恒温恒湿培养箱中,于70 ℃条件下放置,分别于放置1个月和3个月时取样,作为加速试验样品。取放置0个月和1、3个月加速样品,分别按“2.2.4”项下方法制备供试品溶液,再按“2.1”项下ICP-MS条件进样测定,记录响应值并按标准曲线法计算样品中20种元素杂质的含量,平行操作3次,结果见表4(表中,“/”表示含量低于检测限)。由表4可知,除B、Cu、As、Sb、Hg在部分样品中的含量低于检测限外,其余元素杂质在放置0个月和1、3个月加速样品中均有检出,且B、Al、Si、K、Zn、As、Ba等元素的含量有增加趋势,其中Si、Al、Ba含量增加较为明显。
氨甲苯酸注射液药品说明书规定的最大用量为每日6支,即每日最大用量为60 mL,根据元素杂质的PDE限度计算分析评价阈值(AET),AET=PDE/每日最大用量[5,8],结果见表5(表中,“/”表示相关标准中未规定PDE,故无AET结果)。由表4和表5可知,8家企业生产的氨甲苯酸注射液放置0个月样品及1、3个月加速样品中的20种元素杂质中,除B、Al、Mg、Si、Ca、K等6种元素杂质在各国药典和ICH Q3D中未见相关规定外,其余元素杂质的含量均小于AET。
2.11 相容性考察
注射剂会对玻璃内表面的耐受性产生影响,降低玻璃容器的保护作用和功能性,甚至导致玻璃网状结构破坏,致使其中的成分大量溶出并产生玻璃屑或脱片,从而引发安全性问题[8]。试验液中Si浓度、Si/Al浓度比值或Si/B浓度比值、微粒数以及pH值等发生显著变化,则预示玻璃容器发生脱片的可能性较大[8]。基于此,本研究分别比较了放置0个月样品和1、3个月加速样品中Si/B浓度比值和Si/Al浓度比值,结果见表6。由表6可知,1个月和3个月加速样品中Si/B浓度比值或Si/Al浓度比值变化均较为明显,除B企业样品外,其余企业样品均呈增加趋势。另由表4可知,1个月和3个月加速样品中Si含量也显著增加,表明低硼硅玻璃安瓿在氨甲苯酸注射液作用下存在发生脱片的可能性。
2.12 Al元素杂质的含量测定
Al在人体内可以通过累积达到具有毒性的水平[6],但各国药典以及ICH Q3D中元素杂质部分均未对Al的限度进行规定。第42版《美国药典》要求用于全肠外营养的大容量注射液,以及需要进行稀释或溶解等操作的小容量注射液、冻干粉针剂等,其根据药品说明书进行配制后的溶液中Al含量不得超过25 μg/L,且应在药品说明书和标签中予以警示[6]。由表4可知,8家企业生产的氨甲苯酸注射液放置0个月和1、3个月加速样品中Al的含量为82.9~1 466.9 μg/L,均超过第42版《美国药典》规定的限度(25 μg/L),具有一定风险。
3 讨论
本研究建立了同时测定氨甲苯酸注射液中20种元素杂质含量的ICP-MS法,以45Sc、115In、209Bi为内标,可有效避免基体效应、电离效应和仪器漂移等因素对测定结果的影响。以氨甲苯酸原料药按处方制备氨甲苯酸注射液作为加样回收率溶液,避免了部分迁移量较高的元素杂质对测定可能产生的影响,有助于区别生产过程引入的元素杂质和贮存过程迁移的元素杂质。方法学考察结果显示,各元素杂质线性关系良好,重复性、中间精密度、加样回收率均符合第42版《美国药典》要求[6]。
通过对8家企业生产的氨甲苯酸注射液放置0个月的样品和1、3个月加速样品进行分析,结果除B、Mg、Al、Si、K、Ca等6种元素杂质在各国药典和ICH Q3D中未见相关规定外,其余14种元素杂质含量均小于AET,表明杂质含量符合规定。根据加速试验各元素杂质含量测定结果,发现除B、Cu、As、Sb、Hg在部分样品中的含量低于检测限外,其余元素杂质在放置0个月样品和1、3个月加速样品中均有检出,且B、Al、Si、K、Zn、As、Ba等元素的含量有增加趋势。笔者推测B、Al、Si、K、Zn、As、Ba等元素杂质的来源可能为贮存过程中从低硼硅安瓿迁移至药液中,其余元素杂质则可能为由原辅料以及在生产过程中引入。
第42版《美国药典》指出,注射摄入的Al大于4~5 μg/(kg·d)时,会对中枢神经系统和骨骼系统产生不良影响,有引起骨软化病、阿尔茨海默病、低色素性贫血、慢性肾功能损害等潜在风险[6,17]。本研究中8家企业放置0个月样品和1、3个月加速样品中Al的含量为82.9~1 466.9 μg/L,高于第42版《美国药典》的规定,这提示如果患者长期使用氨甲苯酸注射液,具有一定风险。
放置1个月和3个月的加速样品中Si浓度、Si/Al和Si/B浓度比值较放置0个月样品均有较大变化,由相关文献可知,低硼硅玻璃安瓿内表面可能被侵蚀,有发生脱片的可能[8],提示低硼硅玻璃可能不能满足氨甲苯酸注射液包材相容性要求。国家药品监督管理局发布的《已上市化学仿制药(注射剂)一致性评价技术要求(征求意见稿)》规定,注射剂玻璃包装不建议使用低硼硅玻璃和钠钙玻璃[18],因此建议生产企业选择合适的材料进行相容性考察,以降低药品使用风险。
综上所述,本研究所建方法灵敏度高、重复性和准确度均较好,可用于氨甲苯酸注射液中20种元素杂质的含量测定;低硼硅安瓿与氨甲苯酸注射液相互作用较为明显,需要进一步对其相容性进行研究或者更换合适材料并重新评估相容性。
参考文献
[ 1 ] 张莉,刘光辉,高永丽,等.氨甲苯酸的配伍禁忌文献概述[J].中国药物滥用防治杂志,2016,22(3):168-169.
[ 2 ] 任晓彤.最安全的抗纤维蛋白溶解药:氨甲苯酸[J].首都食品与医药,2017,24(23):67.
[ 3 ] 国家食品药品监督管理总局.化学药品注射剂与塑料包装材料相容性研究技术指导原则:试行[S]. 2012-09-27.
[ 4 ] 叶永斌,徐慧,谢新艺,等.化学药品注射剂与药用玻璃相容性研究进展[J].广州化工,2016,44(12):50-52.
[ 5 ] ICH. ICH Q3D R1 version guideline for elemental impurities[EB/OL].(2019-03-22)[2020-12-11]. https://database.ich.org/sites/default/files/Q3D-R1EWG_Document_Step4_ Guideline_2019_0322.pdf.
[ 6 ] The United States Pharmacopoeia Convention. The United States pharmacopoeia:volume 42[S]. Baltimore:United Book Press,2019:6371,6568-6575.
[ 7 ] British Pharmacopoeia Commission Office. British pharmacopoeia 2020[S]. Norwich:The Stationery Office Ltd,2020:847.
[ 8 ] 国家食品药品监督管理总局.化学药品注射剂与玻璃包装材料相容性研究技术指导原则:试行[S]. 2015-07-28.
[ 9 ] 陈宇堃,薛巧如,梁蔚阳. ICP-MS法测定维生素B1注射液中硼、铝、砷、钡、铅的含量[J].药物分析杂志,2016,36(3):536-540.
[10] 高凡钦,胡忍乐. ICP-MS测定丁酸氯维地平脂肪乳注射液中12种元素的迁移量研究[J].中国生化药物杂志,2015,35(3):176-178.
[11] 代秀梅,于风平,张启明,等.微波消解-ICP-MS法测定替曲朵辛中的13种微量金属元素[J].药物分析杂志,2013,33(8):1382-1384
[12] 聂蕾,白桦芳,张欢,等.复方氯化钠注射液生产管道中15种元素迁移量测定[J].中国现代应用药学,2020,37(17):2109-2113.
[13] 邵天舒,周长明,余立,等. ICP-MS法同时测定小牛血去蛋白提取物注射液中14种元素的含量[J].中国药房,2019,30(14):1902-1908.
[14] 黄勇,张欢,聂蕾,等.血塞通注射液与中硼硅安瓿的相容性试验中12 种元素迁移量研究[J].现代仪器与医疗,2019,25(6):72-75.
[15] 潘叙恩,张译方,张春华,等.丙泊酚注射液与中性硼硅玻璃安瓿包材相容性研究[J].中国测试,2017,43(5):45- 48.
[16] 徐文峰,金鹏飞,徐硕,等.电感耦合等离子质谱在药物分析中的应用[J]. 药物分析杂志,2017,37(12):2123-2132.
[17] 王敏力,肖林,梁蔚阳,等.人血白蛋白批签发留样铝离子含量检验结果讨论与监管思考[J].中国药学杂志,2018,53(2):145-153.
[18] 国家食品药品监督管理总局.已上市化学仿制药(注射剂)一致性评价技术要求:征求意见稿[S]. 2017-12-22.
(收稿日期:2021-01-11 修回日期:2021-04-08)
(編辑:陈 宏)
