帕博利珠单抗一线治疗PD-L1高表达的晚期非小细胞肺癌的药物经济学评价
2021-07-20刘国强康朔王欣晨
刘国强 康朔 王欣晨


摘 要 目的:从我国卫生体系角度评价帕博利珠单抗对比一线化疗方案治疗程序性细胞死亡蛋白配体1(PD-L1)高表达的晚期非小细胞肺癌的经济性。方法:利用已发表的KEYNOTE-042临床试验数据和相关文献数据建立马尔可夫模型,评价帕博利珠单抗对比一线化疗方案的经济性;模拟时限为20年,周期为3周,对成本和效用采用5%的贴现率进行贴现。采用单因素敏感性分析和概率敏感性分析法评价模型结果的稳定性。结果:基础分析结果显示,帕博利珠单抗对比一线化療方案可多获得1.62个质量调整生命年(QALY),增量成本为54 648元,增量成本-效用比为33 686元/QALY,低于我国的意愿支付阈值(WTP)。单因素敏感性分析结果显示,纳武利尤单抗价格、帕博利珠单抗价格、一线化疗方案组中接受二线免疫治疗的患者比例这3个变量对结果的影响较大。概率敏感性分析结果显示,在0~140 000元/QALY的WTP范围内,帕博利珠单抗具有经济性的概率逐渐增加;当WTP为70 892元/QALY时(2019年我国1倍人均国内生产总值),帕博利珠单抗具有经济性的概率为95%;当WTP超过100 000元/QALY时,帕博利珠单抗具有经济性的概率为100%。结论:在我国,帕博利珠单抗一线治疗PD-L1高表达的晚期非小细胞肺癌较一线化疗方案更具有经济学优势。
关键词 帕博利珠单抗;化疗;程序性细胞死亡蛋白配体1;非小细胞肺癌;药物经济学;成本-效用分析
ABSTRACT OBJECTIVE: To evaluate the economics of pembrolizumab versus first-line chemotherapy in the treatment of advanced non-small cell lung cancer with high programmed cell death protein ligand 1 (PD-L1) expression from the perspective of Chinese healthcare system. METHODS: Published KEYNOTE-042 clinical trial data and relevant literature data were used to establish a Markov model to evaluate the economics of pembrolizumab versus first-line chemotherapy with a 20-years horizon and a 3-week cycle length, discounting costs and utilities using a discount rate of 5%. One-way sensitivity analysis and probabilistic sensitivity analysis were used to evaluate the stability of the model results. RESULTS: The base-case results showed that pembrolizumab yield additional 1.62 QALYs more than first-line chemotherapy, with an incremental cost of 54 648 yuan; the incremental cost-utility ratio was 33 686 yuan/QALY, which was lower than the willingness-to-pay threshold (WTP) in China. The results of one-way sensitivity analysis showed that the price of nivolumab, the price of pembrolizumab and the proportion of patients who received second-line immunotherapy in first-line chemotherapy group had the greatest impact on the results. The results of probabilistic sensitivity analysis showed that the probability of pembrolizumab to be cost-effective gradually increased within the WTP of 0-140 000/QALY. When WTP was 70 892 yuan/QALY (one time of the per capita GDP of China in 2019), the probability of pembrolizumab to be cost-effective was 95%. When WTP beyond 100 000 yuan/QALY, the probability of pembrolizumab to be cost-effective was 100%. CONCLUSIONS: Pembrolizumab has economic advantages than first-line chemotherapy in the first-line treatment of non-small cell lung cancer with high PD-L1 expression in China.
KEYWORDS Pembrolizumab; Chemotherapy; Programmed cell death protein ligand 1; Non-small cell lung cancer; Pharmacoeconomics; Cost-utility analysis
肺癌是我国及全世界范围内发病率和病死率较高的恶性肿瘤之一[1]。据国家癌症中心统计,2014年肺癌的发病率和病死率均居我国恶性肿瘤首位[2]。另据统计,2015年我国新发肺癌病例达73.3万例,肺癌死亡病例达61.0万例[3]。非小细胞肺癌是肺癌最常见的亚型,约占肺癌的80%[4],由于其发病早期多无明显症状体征,多数患者就诊时已到中晚期,导致5年生存率较低[5-6]。
近年来,免疫疗法和免疫检查点抑制剂的出现为非小细胞肺癌提供了新的治疗选择。帕博利珠单抗是一种抗程序性细胞死亡蛋白1(PD-1)的人源化IgG4單克隆抗体。KEYNOTE-042是一项多中心、随机、对照的Ⅲ期临床试验,其评估了帕博利珠单抗单药对比一线化疗方案治疗程序性细胞死亡蛋白配体1(PD-L1)表达阳性的局部晚期或转移性的非小细胞肺癌的疗效和安全性[7]。该试验结果显示,帕博利珠单抗与一线化疗方案相比,可显著延长患者的总生存(OS)时间,且不良反应较少;同时,对于PD-L1高表达[肿瘤细胞阳性比例分数(TPS)≥50%)]的患者,其OS时间的延长及临床获益更为显著,其中帕博利珠单抗组患者的中位OS时间为20.0个月[95%置信区间(95%CI)为15.4~24.9],一线化疗方案组患者的中位OS时间为12.2个月(95%CI为10.4~14.2)。目前,帕博利珠单抗已被国家药品监督管理局(NMPA)批准单药一线用于治疗PD-L1 TPS≥1%的表皮生长因子受体(EGFR)突变阴性和间变性淋巴瘤激酶(ALK)重排阴性的局部晚期或转移性非小细胞肺癌[8]。帕博利珠单抗虽展现出较好的疗效及安全性,但目前其价格相对较高,患者疾病经济负担较重,故针对帕博利珠单抗开展药物经济学研究尤为重要。本研究利用KEYNOTE-042临床试验数据及已发表的文献数据[7,9-15],从我国卫生体系角度评价帕博利珠单抗对比一线化疗方案治疗PD-L1高表达的晚期非小细胞肺癌的经济性,以期促进临床合理用药,为医保决策提供依据。
1 资料与方法
1.1 目标人群
本研究的目标人群为年龄≥18岁、不携带EGFR基因突变和ALK基因易位、TPS≥50%、美国东部肿瘤协作组(ECOG)评分为0或1,且既往未接受过相关治疗的局部晚期或转移性非小细胞肺癌的患者[7]。按照KEYNOTE-042临床试验及已发表的文献数据[7,9-15],将患者分为帕博利珠单抗组和一线化疗方案组。
1.2 模型结构
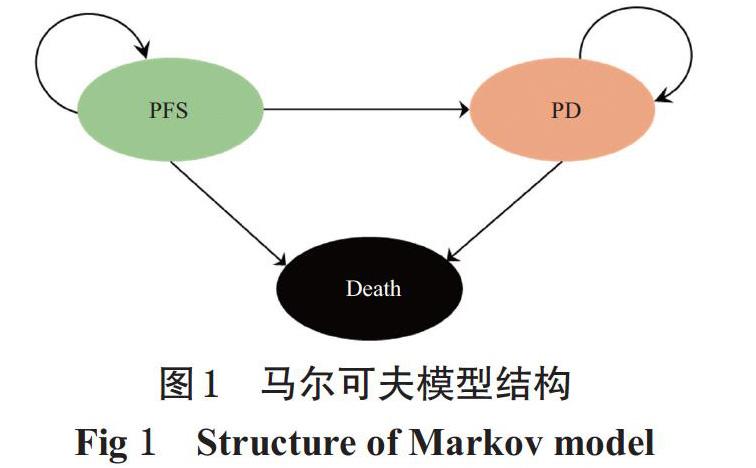
应用Microsoft Excel 2019软件,根据KEYNOTE- 042临床试验数据和相关文献数据建立马尔可夫模型,共包括3种互斥的健康状态:疾病无进展生存(PFS)、疾病进展(PD)和死亡(Death)。依据临床治疗方案,将模型的循环周期设定为3周。模型显示,20年后两组患者几乎全部处于死亡状态,故本研究将模型模拟时限设为20年。设定两组患者进入模型时均处于PFS状态,患者在每个周期内只能处于一种健康状态并接受相应的药物治疗,每个周期末依据转移概率发生状态转移。模型结构如图1所示。
该模型的产出指标包括两种治疗方案的成本和质量调整生命年(QALY),采用《中国药物经济学评价指南2020》推荐的5%的贴现率对成本和健康产出进行贴现[16]。通过计算增量成本-效用比(ICER)并与预先设定的意愿支付阈值(WTP)进行比较,以判断方案的经济性。根据世界卫生组织(WHO)和《中国药物经济学评价指南2020》的建议,本研究采用我国2019年1~3倍人均国内生产总值(GDP)作为WTP,即70 892~212 676元/QALY[16-18]。
1.3 治疗方案
帕博利珠单抗方案:静脉输注帕博利珠单抗,每次200 mg,每3周为1个周期,直至出现PD或不可接受的毒性。最多给药35个周期。
一线化疗方案:静脉输注卡铂5~6 mg/(mL·min)联合紫杉醇200 mg/m2或培美曲塞500 mg/m2,每3周为1个周期,直至出现PD或不可接受的毒性。最多给药4~6个周期。
药物经济学考虑的是以某药物为特征的整个治疗方案的经济性,包括其他相关治疗成本及后线治疗成本。本研究中,治疗过程中出现PD后即停用当前治疗方案转入二线治疗。根据KEYNOTE-042临床试验中披露的相关信息,患者可接受3种不同的二线治疗方案,分别是化疗、靶向治疗和免疫治疗[7]。根据《中华医学会肺癌临床诊疗指南(2019版)》,本研究假设化疗应用多西他赛单药治疗、靶向治疗应用安罗替尼治疗、免疫治疗应用纳武利尤单抗治疗[6-7]。
1.4 临床数据
本研究的临床数据来源于KEYNOTE-042研究,通过对该临床试验的PFS曲线和OS曲线进行参数分布拟合并外推得到患者的长期生存数据。利用Getdata Graph Digitizer V2.26软件从原始生存曲线中取点,利用R语言3.6.3软件重构患者个体水平数据并进行生存曲线的参数分布拟合,包括指数分布、Weibull分布、Gamma分布、Log-normal分布、Log-logistic分布和Gompertz分布[19-20];根据赤池信息准则(AIC)进行拟合优度检验,AIC越小表示拟合优度越好[21]。本研究分别采用Log- logistic分布和Log-normal分布对PFS曲线和OS曲线进行参数分布拟合,结果如表1所示。利用R语言3.6.3软件求算曲线的分布参数,包括尺度参数(λ)和形状参数(γ),依据各曲线的分布参数(表2)计算两种治疗方案下随时间变化的转移概率[22]。
1.5 成本和效用
本研究的研究角度为医疗卫生体系角度,故仅纳入了直接医疗成本,包括帕博利珠单抗和一线化疗方案的药品费用、支持治疗费用、常规随访费用、二线治疗费用、疾病终末期姑息治疗费用、严重药品不良反应(按美国国家癌症研究所通用不良事件术语标准4.0版药品不良反应等级≥3的不良反应)处理费用[23]。为简化模型,本研究仅纳入两组间发生率差异≥5%的严重药品不良反应。严重药品不良反应发生率来源于KETNOTE-042临床试验,药品成本数据来源于药品中标价,其他相关成本数据来源于已发表的文献[9-14]。为了提高药物的可负担性,一项“生命之钥-肿瘤免疫治疗患者援助项目”向患者提供了帕博利珠单抗援助计划,故笔者在模型中考虑了该援助计划。该项目2021年1月1日起正式启用的最新援助方案为:患者自费使用2个疗程的帕博利珠单抗后,即可获得2个疗程的赠药;后续患者继续自费使用2个疗程的帕博利珠单抗后,即可接受持续的赠药直至出现PD,但患者累计使用帕博利珠单抗最多不超过24个月[24]。本研究假设患者体表面积为1.72 m2(体质量65 kg、身高1.64 m)用以计算药品使用剂量并估算药品费用;健康状态的效用值来源于已发表的文献(PFS状态下的效用值为0.77,PD状态下的效用值为0.687[14-15]);同时,本研究还考虑了严重药品不良反应的负效用,具体参数及分布如表3所示。
1.6 敏感性分析
本研究进行了单因素敏感性分析和概率敏感性分析以验证模型结果的稳定性。在单因素敏感性分析中,根据变量的上下限范围(若范围未知,则采用均值±25%作为上下限范围)逐个计算单一变量改变对ICER值的影响,根据计算结果绘制龙卷风图;在概率敏感性分析中,根据变量范围及分布形式重复抽样,进行1 000次蒙特卡洛模拟(其中成本数据采用Gamma分布,效用值及其他事件发生率采用Beta分布[25]),根据蒙特卡洛模拟结果绘制成本-效果散点图及成本-效果可接受曲线。同时,本研究探讨了帕博利珠单抗价格下降对于模型结果的影响。
2 结果
2.1 模型验证结果
在本研究中,笔者采用Log-logistic分布和Log-normal分布对PFS曲线和OS曲线进行参数分布拟合,以获得临床试验观察期之外的患者长期生存数据。笔者将拟合后的曲线与KEYNOTE-042临床试验中所报道的生存曲线进行了对比,结果显示,KEYNOTE-042临床试验报道的OS曲线中,帕博利珠单抗组和一线化疗方案组患者的中位OS时间分别为20.2个月和12.2个月,重新拟合后的中位OS时间分别为19.8个月和12.7个月;KEYNOTE-042临床试验报道的PFS曲线中,帕博利珠单抗组和一线化疗方案组患者的中位PFS时间分别为7.1个月和6.4个月,重新拟合后的中位PFS时间分别为7.4个月和6.7个月。经验证,模型拟合后的患者中位OS时间和中位PFS时间与KEYNOTE-042临床试验中所报道的数据吻合度高、再现性较好。
2.2 基础分析结果
在20年的研究时限内,帕博利珠单抗组同一线化疗方案组相比,增量效用为1.62 QALYs,增量成本为54 648元,ICER为33 686元/QALY,低于我国的WTP。基础分析结果如表4所示。
2.3 单因素敏感性分析结果
单因素敏感性分析龙卷风图如图2所示。由图2可知,纳武利尤单抗价格、帕博利珠单抗价格、一线化疗组中接受二线免疫治疗的患者比例是对ICER影响最大的变量,其他变量(如帕博利珠单抗组中接受二线免疫治疗的患者比例、支持治疗费用、多西他赛价格和贴现率等)对ICER具有中度或轻度的影响。单因素敏感性分析结果提示,无论各变量如何变化,帕博利珠单抗的ICER始终低于我国的WTP。
2.4 概率敏感性分析结果
经过1 000次蒙特卡洛模拟,可得概率敏感性分析的成本-效果散点图(图3)和成本-效果可接受曲线(图4)。由图3可知,绝大部分散点均处于第一象限,提示帕博利珠单抗组的QALYs更长,但同时总成本更高;有8%的散点处于第四象限,表明帕博利珠单抗是绝对优势方案,即成本更低、效用更高。几乎所有散点均处于我国WTP(70 892元/QALY)之下。Excel 2019軟件运算结果显示,帕博利珠单抗在WTP为70 892元/QALY时具有经济性的概率为95%。由图4可知,当WTP在0~140 000元/QALY范围内变动时,随着WTP的增大,帕博利珠单抗具有经济性的概率不断增大;尤其当WTP超过100 000元/QALY时,帕博利珠单抗具有经济性的概率达到100%。
3 讨论
肿瘤免疫治疗药物如PD-1单抗、PD-L1单抗作为一种新兴的抗肿瘤疗法,为恶性肿瘤患者的长期生存带来了新的希望,但其价格较为昂贵,患者疾病经济负担较重。本研究从我国卫生体系角度,通过KEYNOTE-042临床试验数据和已发表的文献数据建立马尔可夫模型,评价帕博利珠单抗对比一线化疗方案治疗PD-L1高表达的晚期非小细胞肺癌的经济性。基础分析结果显示,帕博利珠单抗可带来更多的健康获益,但同时总成本更高;其ICER为33 686元/QALY,低于我国的WTP。概率敏感性分析结果显示,当WTP为70 892元/QALY时,帕博利珠单抗具有经济性的概率为95%,帕博利珠单抗对比一线化疗方案更具有经济性。单因素敏感性分析结果提示,纳武利尤单抗价格、帕博利珠单抗价格、一线化疗组中接受二线免疫治疗的患者比例这3个变量对ICER影响最大,但不论各变量在其范围内如何变化,帕博利珠单抗的ICER始终低于我国的WTP。
Zhou等[26]在帕博利珠单抗援助计划尚未更新时,利用KEYNOTE-042临床试验公布的数据从我国支付方角度评价了帕博利珠单抗对比一线化疗方案治疗PD-L1表达阳性的晚期非小细胞肺癌的经济性,结果显示,对于PD-L1高表达(TPS≥50%)的患者,帕博利珠单抗同一线化疗方案相比的ICER为36 493美元/QALY。该结果虽高于其预设的WTP(26 508美元/QALY),提示帕博利珠单抗不具有经济性,但该ICER值与WTP已很接近。本研究中,笔者根据最新公布的帕博利珠单抗患者援助计划更新了药物经济学证据,结果发生了反转——帕博利珠单抗成为具有经济学优势的方案。这提示我们应根据最新的政策及价格信息及时更新药物经济学证据,助力我国卫生部门循证决策。
目前,我国实施以药物经济学证据为基础的国家药品谈判政策,助力动态管理医保药品目录,降低患者疾病经济负担,提高药品的可负担性。虽然根据最新的2020年国家医保谈判结果,帕博利珠单抗未能成功进入新版医保药品目录,但其通过更新患者援助计划显著降低了患者疾病经济负担。按照最新的援助方案,患者使用帕博利珠单抗治疗2年仅需花费14万元,较该药上市之初年费用60万元相比[27],药物治疗成本显著降低,这使得帕博利珠单抗在一线治疗PD-L1高表达的晚期非小细胞肺癌时,成为比一线化疗方案更具有经济学优势的方案,这为我国如何提高高值创新药物的可负担性提供了新的思路。
但是,本研究仍存在一定的局限性,主要体现在:(1)研究中的一些关键临床数据并非来源于真实世界而是提取自临床试验,这可能会导致一些偏倚。(2)健康状态的效用值会因患者所处地区、种族、文化等不同而产生差异。本研究中的效用值来源于一项西方的相关研究[15],可能与我国的效用数据有一定的差异;但通过单因素敏感性分析可知,效用值在预设范围内的变化对结果的影响较小。(3)本研究未纳入全部的药品不良反应,由此得到的结果可能与真实世界数据存在差异;但单因素敏感性分析提示,不良反应发生率及相关处理费用对结果影响较小。(4)由于缺少相关的“头对头”临床研究,故本研究中未纳入全部的潜在对照方案。
尽管存在上述局限,但本研究结论依然具有较高的可信度,即在我国药物经济学评价的WTP下,帕博利珠单抗一线治疗PD-L1高表达的晚期非小细胞肺癌较一线化疗方案更具有经济优势。期待我国后续尽快开展基于真实世界的帕博利珠单抗相关药物经济学评价,促进临床合理用药,为医保部门循证决策提供更多参考依据。
参考文献
[ 1 ] BRAY F,FERLAY J,SOERJOMATARAM I,et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin,2018,68(6):394-424.
[ 2 ] 陈万青,李贺,孙可欣,等. 2014年中国恶性肿瘤发病和死亡分析[J].中华肿瘤杂志,2018,40(1):5-13.
[ 3 ] CHEN W,ZHENG R,BAADE P D,et al. Cancer statistics in China,2015[J]. CA Cancer J Clin,2016,66(2):115-132.
[ 4 ] 戴冰,占美,吴斌,等.奈达铂与顺铂治疗晚期或复发性鳞状细胞非小细胞肺癌的成本-效果分析[J].中国药房,2020,31(4):473-477.
[ 5 ] 张晋,任立红,刘冬,等.安罗替尼治疗晚期非小细胞肺癌的成本效果分析[J].中国新药与临床杂志,2020,39(6):380-384.
[ 6 ] 中华医学会,中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肺癌临床诊疗指南:2019版[J].中华肿瘤杂志,2020,42(4):257-287.
[ 7 ] MOK T,WU Y,KUDABA I,et al. Pembrolizumab versus chemotherapy for previously untreated,PD-L1-expres- sing,locally advanced or metastatic non-small-cell lung cancer(KEYNOTE-042):a randomised,open-label,controlled,phase 3 trial[J]. Lancet,2019,393(10183):1819-1830.
[ 8 ] 周彩存,王洁,王宝成,等.中國非小细胞肺癌免疫检查点抑制剂治疗专家共识:2020年版[J].中国肺癌杂志,2021,24(4):217-235.
[ 9 ] 曾小慧.基于决策模型的晚期非小细胞肺癌药物经济学研究[D].长沙:中南大学,2013.
[10] ZHU J,HE W,YE M,et al. Cost-effectiveness of afatinib and erlotinib as second-line treatments for advanced squamous cell carcinoma of the lung[J]. Future Oncol,2018,14(27):2833-2840.
[11] 欧阳丽辉.厄洛替尼和吉西他滨维持治疗晚期NSCLC临床药物经济学研究[D].长沙:中南大学,2013.
[12] LU S,ZHANG J,YE M,et al. Economic analysis of ALK testing and crizotinib therapy for advanced non-small-cell lung cancer[J]. Pharmacogenomics,2016,17(9):985-994.
[13] ZHANG P,XIE D,LI Q. Cost-effectiveness analysis of nivolumab in the second-line treatment for advanced esophageal squamous cell carcinoma[J]. Future Oncol,2020,16(17):1189-1198.
[14] HUANG M,LOU Y,PELLISSIER J,et al. Cost-effectiveness of pembrolizumab versus docetaxel for the treatment of previously treated PD-L1 positive advanced NSCLC patients in the United States[J]. J Med Econ,2017,20(2):140-150.
[15] NAFEES B,STAFFORD M,GAVRIEL S,et al. Health state utilities for non small cell lung cancer[J]. Health Qual Life Outcomes,2008,6:84.
[16] 刘国恩.中国药物经济学评价指南:2020[M].北京:中国市场出版社,2020:27-46.
[17] EICHLER H G,KONG S X,GERTH W C,et al. Use of cost-effectiveness analysis in health-care resource allocation decision-making:how are cost-effectiveness thre- sholds expected to emerge?[J]. Value Health,2004,7(5):518-528.
[18] 国家统计局.国家数据[EB/OL].[2020-12-10].https://data.stats.gov.cn/easyquery.htm?cn=C01&zb=A0201&sj=2019.
[19] GUYOT P,ADES A E,OUWENS M J,et al. Enhanced secondary analysis of survival data:reconstructing the data from published Kaplan-Meier survival curves[J]. BMC Med Res Methodol,2012,12:9.
[20] DJALALOV S,BECA J,EWARA E M,et al. A comparison of different analysis methods for reconstructed survi- val data to inform cost?effectiveness analysis[J]. Pharmacoeconomics,2019,37(12):1525-1536.
[21] GAO F,LANGUILLE C,KARZAZI K,et al. Efficiency of fine scale and spatial regression in modelling associations between healthcare service spatial accessibility and their utilization[J]. Int J Health Geogr,2021,20(1):22.
[22] DIABY V,ADUNLIN G,MONTERO A J,et al. Survival modeling for the estimation of transition probabilities in model-based economic evaluations in the absence of individual patient data:a tutorial[J]. Pharmacoeconomics,2014,32(2):101-108.
[23] Wilson C A. NCI Common Terminology Criteria for Adverse Events (CTCAE) v3.0 and v4.0[EB/OL].[2020-09- 01].medlive.cn/appeal/upload/newtranslate/12774721508- 43_166166.pdf.
[24] 中國初级卫生保健基金会.生命之匙:肿瘤免疫治疗患者援助项目[EB/OL]. [2021-05-10].http://smzy.ilvzhou.com/.
[25] BRIGGS A H,WEINSTEIN M C,FENWICK E A L,et al.Model parameter estimation and uncertainty analysis:a report of the ISPOR-SMDM Modeling Good Research Practices Task Force Working Group-6[J]. Med Decis Making,2012,32(5):722-732.
[26] ZHOU K X,JIANG C L,LI Q. Cost-effectiveness analysis of pembrolizumab monotherapy and chemotherapy in the non-small-cell lung cancer with different PD-L1 tumor proportion scores[J]. Lung Cancer,2019,136:98-101.
[27] 肿瘤资讯.以人为本!帕博利珠单抗(K药)全新“疗效渐进式”援助方案开启长生存之旅[EB/OL].[2021-01-27].http://liangyihui.net/doc/69783.
(收稿日期:2020-12-23 修回日期:2021-05-19)
(编辑:胡晓霖)
