基于网络药理学探讨伸膝汤治疗膝关节骨性关节炎的作用机制
2021-07-20贺丰付玲玲曾杰
贺丰 付玲玲 曾杰

摘要 目的:利用網络药理学方法从整体观念探讨中药复方伸膝汤治疗膝关节骨性关节炎(Knee Osteoarthritis,KOA)的作用机制。方法:通过BATMAN-TCM数据库,对伸膝汤所含活性成分进行筛选并预测作用靶点,利用GeneCards、OMIM和CTD数据库检索KOA相关基因,利用韦恩图筛选伸膝汤中活性成分治疗KOA的作用靶点。利用Cytoscape软件构建活性成分-作用靶点网络图。利用String数据库绘制伸膝汤蛋白互作网络,分析计算出最重要的5个蛋白。利用Metascape数据库对靶点进行基因本体(Gene Ontology,GO)及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析。结果:伸膝汤所含8味中药共筛选出184种活性成分,涉及1 491个靶点基因,其中有710个基因与KOA相关。网络分析结果表明,伸膝汤治疗KOA涉及的生物学过程主要包括毒性反应、细胞外刺激反应、激素水平调节等;涉及的分子功能主要包括辅因子结合、羧酸结合、维生素结合等。其作用机制可能与HIF-1信号通路、PI3K-AKT信号通路、cAMP信号通路、钙离子信号通路、TNF信号通路、碳代谢、凋亡、流体剪切应力与动脉粥样硬化、非酒精性脂肪肝等信号通路有关。结论:本研究初步揭示了伸膝汤多靶点整体调节KOA的作用特点,为进一步开展此方治疗KOA作用机制的研究提供了新的思路和方法。
关键词 膝关节骨性关节炎;网络药理学;伸膝汤;中药
Abstract Objective:To explore the mechanism of traditional Chinese medicine compound Shenxi Decoction on knee osteoarthritis(KOA)with network pharmacology method from the overall concept.Methods:Through the BTAMAN-TCM database,the active ingredients in Shenxi Decoction were screened and the target of action was predicted.GeneCards,OMIM and CTD database were used to retrieve KOA-related genes.The Venn diagram was used to screen the target points of the active ingredients in the Shenxi Decoction for the treatment of KOA.Cytoscape software was used to construct the network diagram of active component-acting target.Protein interaction network was drawn up with String database,and the 5 most important proteins were analyzed and calculated.The GO(Gene Ontology)and KEGG(Kyoto Encyclopedia of Genes and Genomes)were for enrichment analysis by Metascape database.Results:A total of 184 active ingredients were screened out from 8 Chinese medicinals,involving 1 491 target genes,710 of which were KOA-related.The results of network analysis showed that the biological processes involved in Shenxi Decoction in the treatment of KOA mainly included toxic substance,response to extracellular stimulus and regulation of hormone levels etc.The molecular functions involved mainly included cofactor binding,carboxylic acid binding and vitamin binding etc.Its mechanism may be related to HIF-1 signaling pathway,PI3K-AKT signaling pathway,cAMP signaling pathway,calcium ion signaling pathway,TNF signaling pathway,carbon metabolism,apoptosis,fluid shear stress and atherosclerosis,non-alcoholic fat and other related signal pathway.Conclusion:This study initially reveals the characteristics of the multi-target overall regulation of KOA by Shenxi Decoction,providing new ideas and methods for further research on the mechanism of action of this prescription in the treatment of KOA.
Keywords Knee osteoarthritis; Network pharmacology; Shenxi Decoction; Chinese medicinal
中图分类号:R285;R274文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.07.009
骨关节炎(Osteoarthritis,OA),是最常见的关节疾病,影响多达15%的成年人,这种疾病的特点是关节软骨退化,滑膜炎和软骨下骨的破骨细胞活化[1]。OA不仅是关节的局部疾病,而且还与全身性疾病有关,如炎症、代谢失调和肥胖,且慢性、轻度炎症会加重症状和疾病进展[2-3]。膝关节是最常发生骨关节炎的部位,膝关节软骨体积与血液炎症介质的浓度呈负相关,如白细胞介素6(IL-6)、肿瘤坏死因子-α(TNF-α)和C反应蛋白(CRP)。此外,一些炎症介质(趋化因子和细胞因子,如IL-1β和危险信号分子)影响软骨细胞的活性并使软骨细胞发生表型变化,如细胞肥大等。CRP和一些炎症介质(前列腺素E2、IL-1、IL-6)的增加可能在OA患者并发症的发生中起到关键作用,如心血管损伤[4]。事实上,与一般人群相比,OA患者的总死亡率更高,主要是由于心血管损伤的增加[5]。基于上述原因,OA不僅应被视为局部关节疾病,而且应被视为全身性疾病。
中医认为关节炎属于“痹症”“骨痹”范畴。《素问·痹论》有“风寒湿三气杂至,合而为痹也”的记载。外感风邪,遇寒或受热,加之湿邪偏胜,是本病的外因。而素体骨髓亏虚,肌腠不能抵御邪气,是导致本病发生的内在因素。伸膝汤方是东直门医院院内制剂,由经典方剂独活寄生汤化裁而来,由独活、秦艽、桑寄生、牛膝、鸡血藤、川芎、白芍、陈皮8味药组成,具有祛风湿、止痹痛、强筋骨之效。其中独活、秦艽祛风胜湿,通络止痛,共为君药;桑寄生、牛膝祛风湿,活血通经,且助君药补肝肾,强筋骨为臣药。鸡血藤、川芎行血补血,舒筋活络为佐药。白芍、陈皮养血止痛,理气燥湿共为使药。诸药合用祛风胜湿,通络止痛,强筋健骨临床治疗KOA效果明显,且经济适用。
网络药理学是一种新兴的研究方法,该方法在网络分析计算的基础上,建立“药物-靶点-疾病-基因”之间的相互作用关系,并以线性关系呈现出来,可更加清晰的显示多种因素间的相互作用[6]。因其整体、高效的特点,网络药理学在探寻中药复方的配伍规律方面正发挥越来越重要的作用[7-8]。本研究基于网络药理学方法,对伸膝汤治疗KOA的机制进行探讨,为深入研究中药复方从整体观念治疗KOA提供参考。
1 材料与方法
1.1 伸膝汤所含成分与对应靶点的收集与筛选 伸膝汤由8味中药组成,分别是独活、秦艽、桑寄生、牛膝、鸡血藤、川芎、白芍、陈皮。通过文献调研和BATMAN-TCM(http://bionet.ncpsb.org/batman-tcm/)数据库,收集以上8味中药的活性成分及对应靶点。参数设置:Score cut-off=20,P<0.05[9]。
1.2 KOA相关基因靶点的筛选 通过GeneCards数据库(http://www.genecards.org,Version 4.11.0)、人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM)(https://omim.org/)和CTD数据库(http://ctdbase.org/)检索与KOA相关基因,汇总后去除重复基因。
1.3 伸膝汤活性成分靶点与KOA相关靶点相互作用网络构建与分析 利用韦恩图将伸膝汤活性成分作用的靶点基因与KOA相关基因进行合并,交集的部分很有可能是伸膝汤活性成分治疗KOA的靶点基因。将交集基因及与之对应化合物导入Cytoscape3.8.0软件构建伸膝汤活性成分-作用靶点网络,并对网络进行分析,保存网络分析结果。在网络中,节点(Node)表示成分和靶点,边(Edge)表示成分与靶点之间的相互作用。
1.4 蛋白质-蛋白质相互作用(PPI)网络构建与分析 将伸膝汤作用于KOA的靶点基因导入String数据库(https://string-db.org,Version 11.0)[10],限定物种为人类,获取被调控蛋白间的相互作用关系,保存结果并导入Cytoscape3.8.0软件,绘制PPI网路图。然后使用Cytohubba插件,根据最大团中心性(Maximal Clique Centrality,MCC)值,筛选最重要的10个蛋白[11]。
1.5 GO分析与KEGG通路分析 将伸膝汤作用于KOA的靶点导入Metascape数据库进行分析,Input as species和Analysis as species均设置为H.sapiens,选择自定义分析(Custom Analysis)中的富集(Enrichment),分别进行GO生物过程,GO分子功能,GO细胞组分和KEGG通路富集分析,筛选统计学显著的条目[12]。使用GraphPad Prism 7.0软件,分别对GO和KEGG通路分析结果进行条形图或气泡图绘制。
2 结果
2.1 伸膝汤方所含成分及靶点的收集与筛选 通过BATMAN-TCM数据库,以Score cutoff=20,P<0.05为参数收集伸膝汤中符合条件的活性成分及对应靶点,结果独活所含活性成分54个,对应靶点1 272个;秦艽所含活性成分4个,对应靶点66个;桑寄生所含活性成分6个,对应靶点117个;川芎所含活性成分69个,对应靶点940个;牛膝所含活性成分8个,对应靶点79个;鸡血藤所含活性成分9个,对应靶点188个;白芍所含活性成分18个,对应靶点144个;陈皮所含活性成分33个,对应靶点603个。去重后共得到184个活性成分及1 491个对应靶点。
2.2 KOA相关基因靶点筛选 分别在GeneCards数据库、OMIM数据库和CTD数据库中,以关键词“knee osteoarthritis”进行检索,获得1 543、315、4 518个相关基因靶点,删除重复后共得到5 583个KOA相关基因。
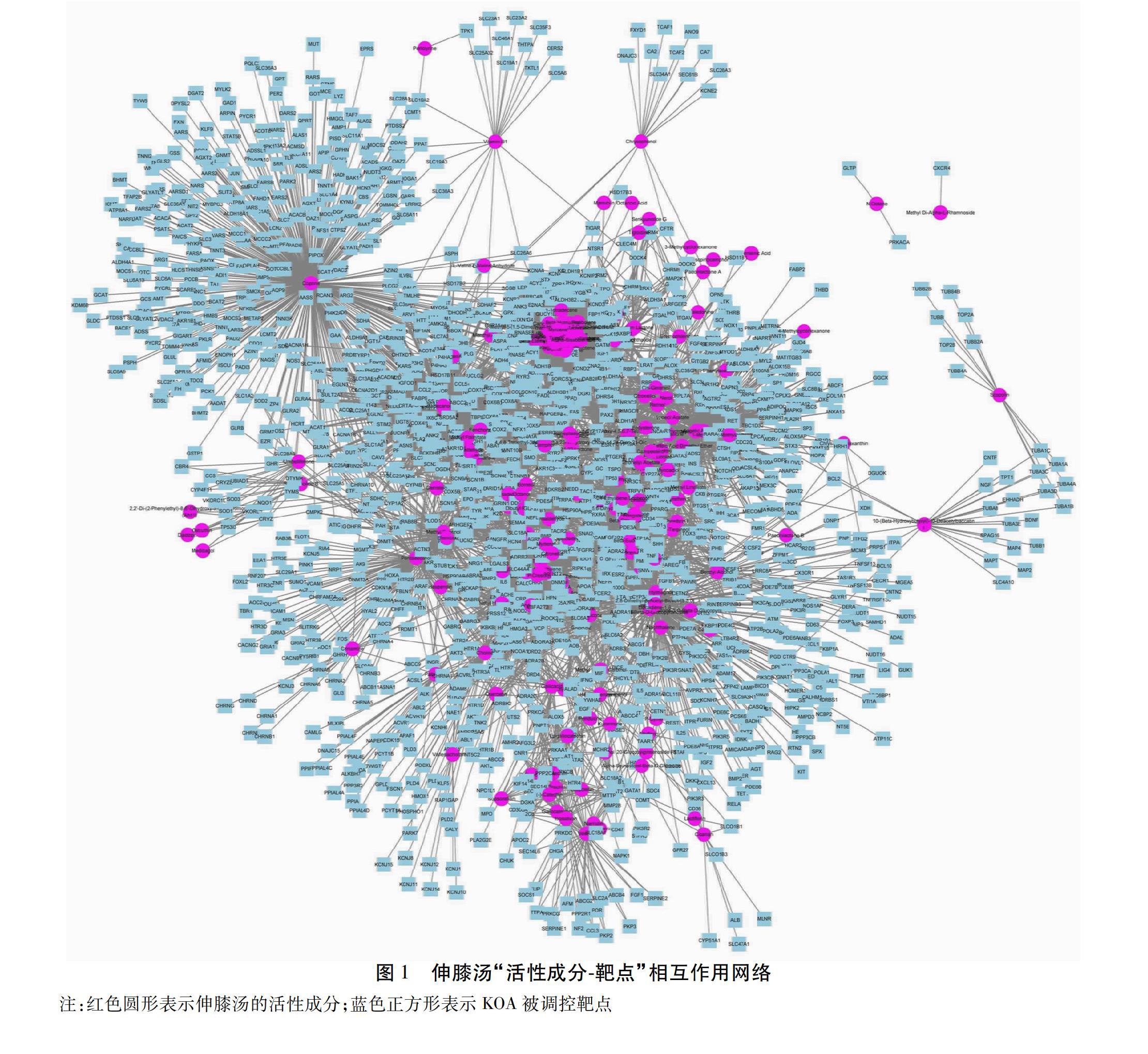
2.3 伸膝汤活性成分-作用靶点网络互作 将伸膝汤作用靶点基因与KOA相关靶点基因进行映射比较,发现710个共同基因,推测这些可能为伸膝汤治疗KOA的基因靶点。将交集基因靶点与对应活性成分输入Cytoscape3.8.0软件构建伸膝汤活性成分-作用靶点网络。见图1。图中共涉及1 675个节点,9 152条边,其中红色圆形节点代表伸膝汤活性成分,蓝色正方形节点代表KOA被调控靶点,边代表活性成分和被调控靶点间具有作用关系。从图中可看出伸膝汤多成分靶点间相互作用关系。其中独活独有成分墨盖蘑菇氨酸(Coprine/386个靶点),壬酸(Nonanoic Acid/263个靶点),川芎独有成分十五酸甲酯(Methyl Pentadecanoate/226个靶点),棕榈酸(Hexadecanoic Acid/226个靶点),陈皮独有成分月桂酸(Lauric Acid/226个靶点)是拥有靶点最多5种化合物。
2.4 蛋白质-蛋白质相互作用(PPI)网络构建与分析 PPI网络中,共涉及707个节点,13 024条边(其中SEC14L3、AP3D、GLYATL2与其他蛋白没有相互作用)。使用Cytohubba插件中MCC方法计算后,确定最重要的10个蛋白靶点,分别为白细胞介素-6(IL-6)、白细胞介素-10(IL-10)、白蛋白(ALB)、苏氨酸激酶1(AKT1)、前列腺素内过氧化物合酶2(PTGS2)、胰岛素(INS)、Toll样受体4(TLR4)、Jun原癌基因(JUN)、CC趋化因子配体2(CCL2)、肿瘤坏死因子(TNF)结果见图2。
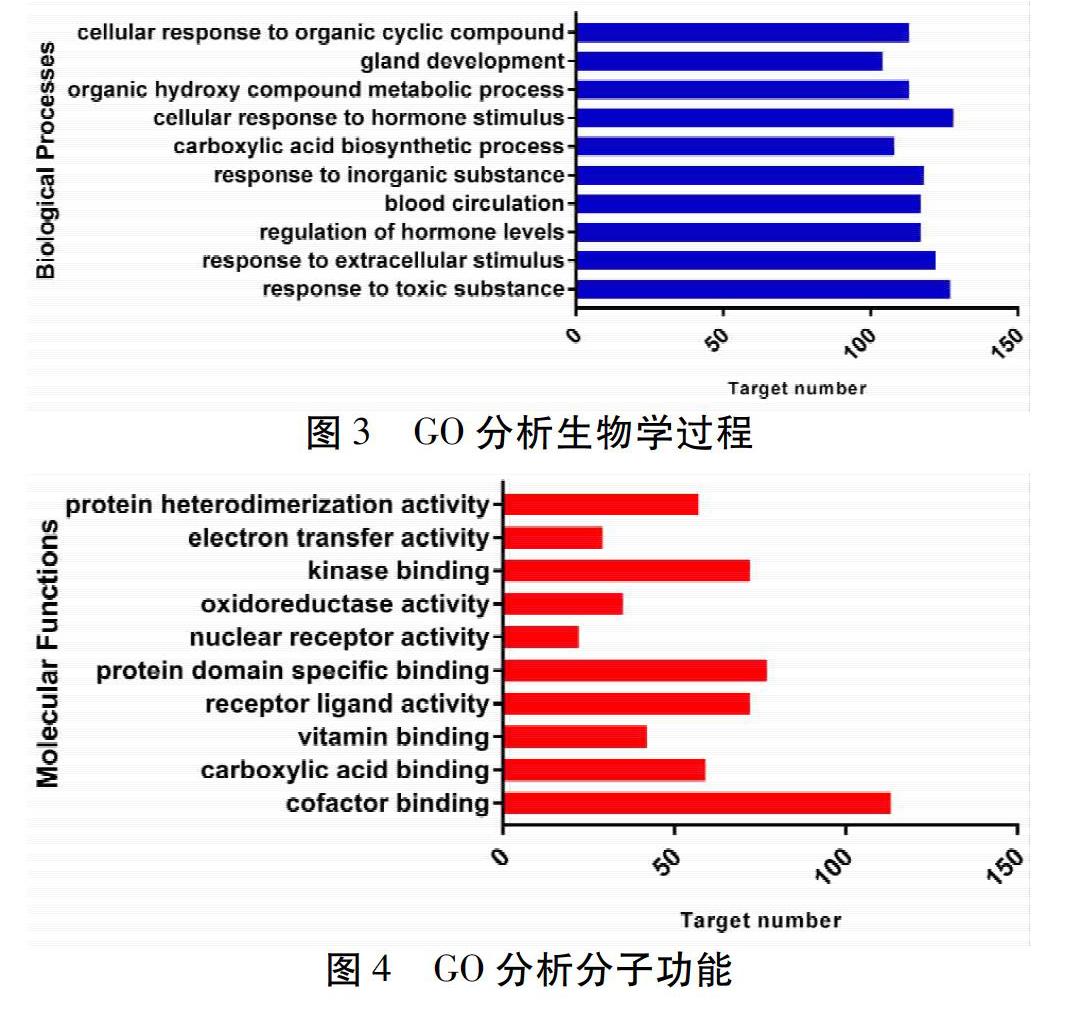
2.5 基因功能分析 使用Metascape数据库对伸膝汤活性成分所调控的靶点进行基因本体(GO)分析,并筛选统计学显著的生物学过程(Biological Process,BP)、分子功能(Molecular Function,MF)和细胞组分(Cellular Component,CC),用GraphPad Prism7.0软件绘图。见图3~5。其中生物学过程(图3)主要富集在对有毒物质的反应(Response to Toxic Substance)、对细胞外刺激的反应(Response to Extracellular Stimulus)、激素水平的调节(Regulation of Hormone Levels)、血液循环(Blood Circulation)、对无机物的反应(Response to Inorganic Substance)等条目。分子功能(图4)主要富集在辅因子结合(Cofactor Binding)、羧酸结合(Carboxylic Acid Binding)、维生素结合(Vitamin Binding)、受体配体活性(Receptor Ligand Activity)、蛋白质结构域特异性结合(Protein Domain Specific Binding)等条目。细胞组分(图5)主要富集在线粒体基质(Mitochondrial Matrix)、膜筏(Membrane Raft)、神经细胞体(Neuronal Cell Body)、轴突(Axon)、线粒体被膜(Mitochondrial Envelope)等條目。
2.6 KEGG通路分析 使用Metascape数据库对KOA被调控的710个靶点进行KEGG分析,根据LogP值筛选靠前的10个代表性通路见图6。图中节点的颜色反映了LopP值的大小,节点大小与基因数量成正比。结果显示,伸膝汤调控KOA的机制主要涉及癌症相关通路(Pathways in Cancer)、流体剪切应力和动脉粥样硬化(Fluid Shear Stress and Atherosclerosis)、非酒精性脂肪性肝病(Non-alcoholic Fatty Liver Disease)、HIF-1信号通路、cAMP信号通路、钙信号通路(Calcium Signaling Pathway)、PI3K-AKT信号通路、TNF信号通路、碳代谢(Carbon Metabolism)、细胞凋亡(Apoptosis)等通路。因此推测,伸膝汤治疗KOA的作用机制可能与上述信号通路密切相关。
3 讨论
目前,虽然骨关节炎的病因及病理生理学机制仍存在争议,但相关致病危险因素,特别是多种因素结合导致疾病进展已得到广泛的记录,如年龄、性别、基因和骨密度增加等[13-16]。此外,局部生物力学危险因素,如损伤、肥胖、解剖畸形和肌肉无力,决定了疾病的部位和严重程度[17]。Cicuttini等[2]研究表明KOA早期以全身代谢因素为主,晚期以机械因素为主。软骨损伤和软骨下骨重建的起始和进展与肥胖相关代谢物,尤其是脂肪因子,炎症细胞启动因子有关[18]。
中医认为膝痹属于痹症的一种,可受身体多种脏腑影响,并由身体生理功能异常,局部再次受到病理刺激导致。如肝肾不足,躯体经脉不通瘀血痹阻,膝关节局部感受风寒湿等邪气。中药治疗KOA一般采取辨证论治,主要使用祛风散寒除湿、活血行气通络、补肝肾强筋骨等治疗方法及药物。伸膝汤是北京中医药大学东直门医院院内协定方,临床治疗KOA效果明显,但其药理学机制尚不明确。
本研究利用网络药理学方法从伸膝汤所含8味中药中,说明了伸膝汤多成分、多靶点共同作用治疗KOA的特点。靶点最多的前2种化合物分别为墨盖蘑菇氨酸(Coprine)和壬酸(Nonanoic Acid),它们是独活的独有成分,说明独活作为君药,在此方中的重要作用。川芎独有成分十五酸甲酯(Methyl Pentadecanoate),棕榈酸(Hexadecanoic Acid),陈皮独有成分月桂酸(Lauric Acid)拥有靶点的数量分别处于第3~5位。
PPI结果显示伸膝汤通过复杂网络关系调控KOA,经计算后发现IL6、IL10、ALB、AKT1、PTGS2、INS、TLR4、JUN、CCL2、TNF等可能是伸膝汤影响KOA的10个最主要靶蛋白。IL6与多种炎症相关的疾病状态有关[19]。IL10基因编码的蛋白质是一种细胞因子,主要由单核细胞产生,这种细胞因子在免疫调节和炎症反应中具有多效性,可作用于免疫系统的许多细胞,限制了由炎症引起的过度组织破坏[20]。TLR4可介导核因子κB活化、细胞因子分泌和炎症反应[21]。CCL2趋化因子是参与免疫调节和炎症反应的分泌蛋白的超家族,它与多种疾病的发病机制密切相关[22]。TNF主要由巨噬细胞分泌,可诱导某些肿瘤细胞系的细胞凋亡。它是一种通过直接作用或刺激白细胞介素-1分泌而引起发热的强致热原,与诱导恶病质有关,在一定条件下可刺激细胞增殖,诱导细胞分化[23]。ALB基因编码人类血液中最丰富的蛋白质,该蛋白质具有调节血浆胶体渗透压的功能,并作为多种内源性分子(包括激素、脂肪酸、代谢物以及外源性药物)的载体蛋白[24]。INS基因编码胰岛素,一种肽激素,在调节碳水化合物和脂质代谢中起着至关重要的作用。AKT1在发育中的神经系统中,AKT是生长因子诱导的神经元成活的关键介质。生长因子可以通过激活丝氨酸/苏氨酸激酶AKT1以一种独立于转录的方式抑制凋亡,然后AKT1磷酸化并使凋亡机制的组分失活[25]。PTGS2负责产生炎性前列腺素。PTGS2的上调还与细胞黏附增加、表型改变、抗凋亡和肿瘤血管生成有关[26]。JUN编码一种与病毒蛋白高度相似的蛋白质,并与特定的靶DNA序列直接相互作用,以调节基因表达。由此可见伸膝汤影响的蛋白质涉及免疫、炎症和细胞成活,代谢等多种功能。
GO及KEGG分析发现,伸膝汤对体内多种信号通路都具有调控作用。对于流体剪应力与动脉粥样硬化通路而言,剪切应力是血流在血管壁内皮表面施加的摩擦力,在血管生物学中起着重要作用,是动脉粥样硬化进展的重要因素。Ekim等[27]研究表明,颈动脉内膜-中膜厚度、动脉粥样硬化与超声下的膝关节骨性关节炎分级有相关性。对于非酒精性脂肪肝(Non-alcoholic Fatty Liver Disease,NAFLD)通路而言,NAFLD是一种范围广泛的疾病,从简单的脂肪变性到伴有肝炎症和纤维化的更严重的脂肪性肝炎,在NAFLD的第一阶段,已经证实有过多的脂肪堆积。其主要原因是诱导胰岛素抵抗,导致游离脂肪酸(FAAs)处理的胰岛素抑制缺陷。研究发现,肥胖人群不仅会增加患膝盖骨关节炎的风险,还会增加患手部骨关节炎的风险。这支持了脂肪组织可能不仅通过超载与骨关节炎相关的概念。事实上,肥胖会诱发一种低等级的全身炎症状态,其特征是产生和分泌多种脂肪细胞因子,而这些脂肪细胞因子可能在骨关节炎的发生过程中发挥作用。此外,高血压、受损的葡萄糖和脂质代谢,这些与肥胖相关的共病,已经被证明可以改变关节组织的稳态[28]。对于HIF-1通路,HIF-1在低氧条件下的主动调控其他因子,以适应缺氧环境。HIF-1的靶基因编码蛋白质,增加O2的传递,介导对O2剥夺的适应性反应。OA的特点是软骨破坏,分解代谢酶和软骨细胞死亡[包括凋亡和(或)自噬]等因素被认为是其发病机制。关节软骨一生都在低氧环境中维持,因此软骨细胞适应这些低氧条件。HIF-1α通过调节SOX9基因水平表达调节软骨形成,HIF-1也可以调节自噬和凋亡。因此,HIF-1α可能通过促进软骨细胞形成,维持软骨细胞的生存能力,支持代謝、适应缺氧环境等作用对关节软骨产生保护作用[29]。钙离子信号通路属于信号转导通路,在软骨形成过程中,复杂的细胞内信号通路调控一系列复杂的事件,包括软骨祖细胞凝聚和结节形成,然后是软骨分化,钙信号是分化软骨祖细胞的中心调控因子[30]。cAMP是最常见、最普遍的第二信使之一,其形成是通过G蛋白偶联受体(GPCRs)与包括激素、神经递质等信号分子的配体连接后,腺苷酸环化酶(AC)激活而促进的。Qadri等[31]研究表明,滑膜细胞内cAMP水平的增加通过增加透明质酸和蛋白聚糖4的产生来减轻滑膜纤维化,这可能提示了一种治疗OA滑膜纤维化的新方法。磷脂酰肌醇3激酶(PI3K)-AKT信号通路被多种细胞刺激或毒性损伤激活,调控转录、翻译、增殖、生长和成活等细胞基本功能。Xue等[32]研究表明炎症可抑制大鼠软骨细胞的增殖和细胞周期,降低自噬率,抑制PI3K/AKT/mTOR信号通路可促进OA大鼠关节软骨细胞自噬,减轻炎症反应[32]。肿瘤坏死因子(TNF)是一个关键的炎症介质,在炎症过程中起着主要的作用[33],最近的数据表明TNF参与OA软骨变性发展[34],皮质抑素可竞争性地结合到TNFR1和TNFR2,抑制促炎TNF-α的功能,从而对软骨变性和OA产生延缓作用[35]。Song等[36]分别从人OA软骨和正常软骨组织中分离关节软骨细胞,通过safranin O染色检测软骨降解程度,发现OA软骨细胞中SHMT-2和MECP-2表达水平升高,3′URT报告基因检测显示SHMT-2和MECP-2分别是miR-370和miR-373在人类关节软骨细胞中的直接靶点。将miR-370或miR-373引入内侧半月板(DMM)失稳的小鼠软骨中,显著降低了本模型中软骨的破坏,而引入SHMT-2或MECP-2则增加了软骨破坏的严重程度。因此miR-370和miR-373分别通过SHMT-2和MECP-2调控单碳代谢,调控骨关节炎的发病机制。
综上所述,本研究利用网络药理学方法对伸膝汤治疗KOA的机制进行探讨,发现此方包含多种活性成分,涉及多种信号通路和生物过程,与中医整体论治的观点相吻合。还为研究伸膝汤治疗作用的分子机制及药理学机制奠定了基础,同时也为其他复方中药的研究提供了思路和方法。本研究的不足之处在于数据库中信息可能不完全,伸膝汤所含中药的化合物及其对应靶点可能会被遗漏;伸膝汤中化学成分复杂,在关键化合物挑选的过程中应当结合更多的文献数据。以后的研究目标是对伸膝汤的作用靶点进行更加精确的筛选和验证,对其机制进行更加深入的研究。
參考文献
[1]Bijlsma JW,Berenbaum F,Lafeber FP.Osteoarthritis:an update with relevance for clinical practice[J].Lancet,2011,377(9783):2115-2126.
[2]Cicuttini FM,Wluka AE.Osteoarthritis:Is OA a mechanical or systemic disease?[J].Nat Rev Rheumatol,2014,10(9):515-516.
[3]Pers YM,Ruiz M,Nol D,et al.Mesenchymal stem cells for the management of inflammation in osteoarthritis:state of the art and perspectives[J].Osteoarthritis Cartilage,2015,23(11):2027-2035.
[4]Danesh J,Wheeler JG,Hirschfield GM,et al.C-reactive protein and other circulating markers of inflammation in the prediction of coronary heart disease[J].N Engl J Med,2004,350(14):1387-1397.
[5]Gkretsi V,Simopoulou T,Tsezou A.Lipid metabolism and osteoarthritis:lessons from atherosclerosis[J].Prog Lipid Res,2011,50(2):133-140.
[6]Ye H,Wei J,Tang K,et al.Drug Repositioning Through Network Pharmacology[J].Curr Top Med Chem,2016,16(30):3646-3656.
[7]Harrold JM,Ramanathan M,Mager DE.Network-based approaches in drug discovery and early development[J].Clin Pharmacol Ther,2013,94(6):651-658.
[8]Chen L,Cao Y,Zhang H,et al.Network pharmacology-based strategy for predicting active ingredients and potential targets of Yangxinshi tablet for treating heart failure[J].J Ethnopharmacol,2018,219:359-368.
[9]Liu Z,Guo F,Wang Y,et al.BATMAN-TCM:a Bioinformatics Analysis Tool for Molecular mechANism of Traditional Chinese Medicine[J].Sci Rep,2016,6:21146.
[10]von Mering C,Jensen LJ,Snel B,et al.STRING:known and predicted protein-protein associations,integrated and transferred across organisms[J].Nucleic Acids Res,2005,33(Database issue):D433-7.
[11]Meghanathan N.Maximal clique size versus centrality:a correlation analysis for complex real-world network graphs[C].New Delhi:Proceedings of 3rd International Conference on Advanced Computing,Networking and Informatics.Springer,2016:95-101.
[12]Tripathi S,Pohl MO,Zhou Y,et al.Meta-and Orthogonal Integration of Influenza “OMICs” Data Defines a Role for UBR4 in Virus Budding[J].Cell Host Microbe,2015,18(6):723-735.
[13]Mueller AJ,Peffers MJ,Proctor CJ,et al.Systems approaches in osteoarthritis:Identifying routes to novel diagnostic and therapeutic strategies[J].J Orthop Res,2017,35(8):1573-1588.
[14]Neame RL,Muir K,Doherty S,et al.Genetic risk of knee osteoarthritis:a sibling study[J].Ann Rheum Dis,2004,63(9):1022-1027.
[15]Valdes AM,Spector TD.The genetic epidemiology of osteoarthritis[J].Curr Opin Rheumatol,2010,22(2):139-143.
[16]Teichtahl AJ,Wang Y,Wluka AE,et al.Associations between systemic bone mineral density and early knee cartilage changes in middle-aged adults without clinical knee disease:a prospective cohort study[J].Arthritis Res Ther,2017,19(1):98.
[17]Pereira D,Ramos E,Branco J.Osteoarthritis[J].Acta Med Port.2015 Jan-Feb;28(1):99-106.
[18]Wang X,Hunter D,Xu J,et al.Metabolic triggered inflammation in osteoarthritis[J].Osteoarthritis Cartilage,2015,23(1):22-30.
[19]Gómez MI,Sokol SH,Muir AB,et al.Bacterial induction of TNF-alpha converting enzyme expression and IL-6 receptor alpha shedding regulates airway inflammatory signaling[J].J Immunol,2005,175(3):1930-1936.
[20]Hashimoto SI,Komuro I,Yamada M,et al.IL-10 inhibits granulocyte-macrophage colony-stimulating factor-dependent human monocyte survival at the early stage of the culture and inhibits the generation of macrophages[J].J Immunol,2001,167(7):3619-3625.
[21]Stewart CR,Stuart LM,Wilkinson K,et al.CD36 ligands promote sterile inflammation through assembly of a Toll-like receptor 4 and 6 heterodimer[J].Nat Immunol,2010,11(2):155-161.
[22]Jarnagin K,Grunberger D,Mulkins M,et al.Identification of surface residues of the monocyte chemotactic protein 1 that affect signaling through the receptor CCR2[J].Biochemistry,1999,38(49):16167-1677.
[23]Nie H,Zheng Y,Li R,et al.Phosphorylation of FOXP3 controls regulatory T cell function and is inhibited by TNF-α in rheumatoid arthritis[J].Nat Med,2013,19(3):322-328.
[24]Lu J,Stewart AJ,Sadler PJ,et al.Albumin as a zinc carrier:properties of its high-affinity zinc-binding site[J].Biochem Soc Trans,2008,36(Pt 6):1317-1321.
[25]Lee SB,Kwon IS,Park J,et al.Ribosomal protein S3,a new substrate of Akt,serves as a signal mediator between neuronal apoptosis and DNA repair[J].J Biol Chem,2010,285(38):29457-2968.
[26]Lucido MJ,Orlando BJ,Vecchio AJ,et al.Crystal Structure of Aspirin-Acetylated Human Cyclooxygenase-2:Insight into the Formation of Products with Reversed Stereochemistry[J].Biochemistry,2016,55(8):1226-1238.
[27]Ekim AA,nal EE,Kaya DS,et al.Relationship between atherosclerosis and knee osteoarthritis as graded by radiography and ultrasonography in females[J].J Phys Ther Sci,2016,28(11):2991-2998.
[28]Belluzzi E,El Hadi H,Granzotto M,et al.Systemic and Local Adipose Tissue in Knee Osteoarthritis[J].J Cell Physiol,2017,232(8):1971-1978.
[29]Zhang FJ,Luo W,Lei GH.Role of HIF-1α and HIF-2α in osteoarthritis[J].Joint Bone Spine,2015,82(3):144-147.
[30]Matta C,Mobasheri A.Regulation of chondrogenesis by protein kinase C:Emerging new roles in calcium signalling[J].Cell Signal,2014,26(5):979-1000.
[31]Qadri MM,Jay GD,Ostrom RS,et al.cAMP attenuates TGF-β′s profibrotic responses in osteoarthritic synoviocytes:involvement of hyaluronan and PRG4[J].Am J Physiol Cell Physiol,2018,315(3):C432-C443.
[32]Xue JF,Shi ZM,Zou J,et al.Inhibition of PI3K/AKT/mTOR signaling pathway promotes autophagy of articular chondrocytes and attenuates inflammatory response in rats with osteoarthritis[J].Biomed Pharmacother,2017,89:1252-1261.
[33]Croft M,Benedict CA,Ware CF.Clinical targeting of the TNF and TNFR superfamilies[J].Nat Rev Drug Discov,2013,12(2):147-168.
[34]Qu R,Chen X,Wang W,et al.Ghrelin protects against osteoarthritis through interplay with Akt and NF-κB signaling pathways[J].FASEB J,2018,32(2):1044-1058.
[35]Zhao Y,Li Y,Qu R,et al.Cortistatin binds to TNF-α receptors and protects against osteoarthritis[J].EBioMedicine,2019,41:556-570.
[36]Song J,Kim D,Chun CH,et al.miR-370 and miR-373 regulate the pathogenesis of osteoarthritis by modulating one-carbon metabolism via SHMT-2 and MECP-2,respectively[J].Aging Cell,2015,14(5):826-837.
(2020-04-17收稿 責任编辑:徐颖)
