藁本内酯对脂多糖诱导的肺上皮细胞损伤的保护作用及其机制
2021-07-20张小芳唐凤鸣
张小芳,唐凤鸣
成都市温江区人民医院,四川成都611130
藁本内酯(ligustilide,LIG,3-丁烯基-4,5-二氢异苯并呋喃酮)是一种在当归、川芎等中药材中广泛存在的苯酞类化合物。已有的药理学研究表明,LIG具有非常多样的治疗作用,如保肝、利尿、抗炎、神经保护和抗肿瘤等药理活性[1]。在多种肿瘤细胞中,LIG已被证明具有抗凋亡活性、细胞周期阻滞能力和抗肿瘤细胞增殖活性。此外,有文献报道,LIG对高糖导致的血管内皮细胞损伤具有明显的保护作用,通过下调细胞内Caspase-3表达并提升Bcl-2蛋白水平来抑制细胞凋亡[2]。低浓度的LIG可显著保护PC12细胞免受氧糖剥夺导致的细胞凋亡。LIG在低浓度长时间孵育或高浓度短时间孵育情况下,可通过控制激素通路的激活和压力蛋白的诱导来保护PC12细胞,促进氧糖剥夺模型中PC12细胞的生存。另一方面,高浓度长时间的LIG处理会导致大量活性氧自由基(reactive oxygen species,ROS)的产生,压倒性的氧化应激将导致PC12细胞大量死亡。总之,LIG既可以在特定情况下促进细胞存活,也可能反过来导致细胞死亡,具体药理作用与剂量、浓度和时间有关[3]。
脂多糖(lipopolysaccharide,LPS)是一种革兰阴性细菌细胞壁中的毒性成分,也是细菌内毒素的主要成分之一,通常在革兰阴性细菌死亡溶解时释放出来,导致系统性的炎症反应、免疫激活和组织损伤[4]。LPS在体外培养时可诱导肺上皮细胞凋亡,加入凋亡抑制剂可提高细胞存活率[5]。有研究认为,在LPS导致的小鼠急性肺损伤模型中,减少肺血管内皮和肺泡上皮细胞的凋亡率可有效缓解肺组织损伤和提高小鼠存活率[6]。因此,研究LIG在缓解LPS诱导的肺上皮细胞损伤中的治疗作用和机制对研发新的脓毒症致急性肺损伤药物具有重要的研究价值。在LPS导致的急性肺损伤早期阶段,肺上皮细胞和肺泡毛细血管内皮细胞受损,进而导致微循环功能障碍和肺水肿是疾病早期的主要生理标志[7]。此外,在LPS导致的急性肺损伤中,肺上皮细胞功能受损将会导致肺泡表面活性物质合成受阻、肺水清除障碍,进而诱发脓毒症,甚至不可逆的肺纤维化[8]。当前对LIG的血管内皮细胞保护作用研究较多[1-3],对于LIG保护肺泡上皮细胞免受LPS损伤的作用和机制尚不明确。本研究旨在探讨LIG对LPS诱导的肺上皮细胞损伤的保护作用及其机制,现将结果报道如下。
1 材料与方法
1.1 细胞及质粒 BEAS-2B肺上皮细胞购自中国科学院细胞库;GFP-LC3质粒购自碧云天生物技术有限公司。
1.2 主要试剂 LIG购自上海源叶生物科技有限公司;羟氯喹(hydroxychloroquine,HCQ)和3-甲基嘌呤(3-methylpurine,3-MA)购自上海毕得医药科技股份有限公司;CCK-8试剂盒、Hoechst33258、Lipofectamine 2000和AnnexinV-FITC/PI双染试剂盒均购自南京凯基生物技术有限公司;兔抗人微管相关蛋白1轻链3(microtubule associated protein light chain 3,LC3)、p62和Caspase-3单克隆抗体购自英国Abcam公司;兔抗人细胞色素C(cytochrome c)和Bcl-2多克隆抗体购自武汉三鹰生物技术有限公司;HRP标记的羊抗兔IgG和ECL发光液购自碧云天生物技术有限公司;胎牛血清购自美国GIBCO公司。
1.3 细胞培养 常规复苏BEAS-2B细胞,于37℃,5%CO2条件下培养。
1.4 L I G对L PS诱导的B EA S-2B细胞增殖影响的检测 将细胞浓度调整为(2~5)×103个/孔,向96孔板中加入约100μL细胞悬液,常规培养使细胞贴壁。将细胞分为对照组、不同浓度LPS组(0.062 5、0.125、0.25、0.5、1.0、2.0 ng/mL)和各浓度LPS+LIG(2.0μmol/L)组,分别加入空白溶剂或对应药物,继续培养24 h。向每孔中加入10μL CCK-8,在37℃培养箱中培养4 h,在酶标仪上测定吸光度值,检测波长450 nm,参比波长600 nm。
1.5 L I G对L PS诱导的B EA S-2B细胞凋亡影响的检测
将BEAS-2B细胞接种至6孔板或24孔板中,细胞分为对照组、LPS(0.5 ng/mL)组和LPS(0.5 ng/mL)+LIG(2.0μmol/L)组,分别加入空白溶剂或对应药物,继续培养24 h。
1.5.1 流式细胞术 向各孔中加入AnnexinV-FITC/PI双染试剂,室温避光孵育10 min;PBS洗涤2次,收集细胞于流式管中,流式细胞仪上机检测。
1.5.2 Hoechst33258染色法 使用Hoechst33258检测细胞核形态变化。
1.6 L I G对L PS诱导的B EA S-2B细胞形态影响的检测 细胞分组及处理同1.5项。取各组细胞,用胰酶消化制成细胞悬液,经预冷PBS洗涤后离心,弃上清液,滴加2.5%戊二醛固定悬浮细胞2 h;在磷酸缓冲液中漂洗2 h,洗净戊二醛,用1%锇酸固定液固定2 h;乙醇脱水后在浸渍液中浸渍4 h,再放入纯包埋剂中过夜。切片后进行醋酸铀-枸橼酸铅双染色。在透射电子显微镜下观察细胞形态、细胞质等的变化,照相并记录结果。
1.7 GF P-L C3转染和激光共聚焦显微镜成像 用50μL无血清培养基分别稀释GFP-LC3质粒和转染试剂Lipofectamine 2000,孵育5 min后,将GFP-LC3质粒与转染试剂混匀并静置15 min,加入对照组、LPS(0.5 ng/mL)组和LPS(0.5 ng/mL)+LIG(2.μmol/L)组96孔板细胞中,置37℃,5%CO2条件下培养4~6 h。各组细胞分别用胰酶消化,制成细胞悬液,移去培养液,PBS洗涤3次,滴加4%多聚甲醛,固定细胞20 min;吸弃多聚甲醛,PBS洗涤3次,滴加0.2%Triton X-100,室温透膜20 min;吸弃Triton X-100,PBS洗涤3次,使用血清封闭液,置湿盒中37℃封闭30 min;去除封闭液,滴加一抗(1∶25稀释),4℃湿盒中过夜孵育;PBS洗涤3次,滴加荧光二抗(1∶100稀释),室温下避光孵育1 h;PBS洗涤3次,用抗荧光淬灭剂的封片液封片,荧光显微镜下观察。
1.8 L I G对L PS诱导的B EA S-2B细胞凋亡和自噬相关蛋白表达水平影响的检测 采用Western blot法。将BEAS-2B细胞分为对照组、LPS(0.5 ng/mL)组和LPS(0.5 ng/mL)+不同浓度LIG(0.5、2.0μmol/L)组,分别加入空白溶剂或对应药物,继续培养24 h。各组细胞弃去培养液,冷PBS洗涤2次,收集细胞,9 600×g冷冻离心5 min,弃去上清液,加入细胞裂解液,冰上裂解1 h,9 600×g冷冻离心10 min,取上清液,BCA法测定蛋白总浓度。取适量蛋白样本,经15%SDS-PAGE分离后,转移至PVDF膜上,以2.5%脱脂奶粉室温振摇封闭2 h;加入一抗(1∶100稀释),4℃振摇过夜;洗涤后加入二抗(1∶500稀释),室温振摇2 h;洗涤后滴加ECL发光液,化学凝胶成像仪曝光成像。
1.9 自噬抑制剂对L I G缓解L PS诱导的B EA S-2B细胞影响的检测 将BEAS-2B细胞分为对照组、LPS(0.5 ng/mL)+不同浓度LIG(0、0.25、0.5、1.0、2.0μmol/L)组、LPS(0.5 ng/mL)+HCQ(50μmol/L)+不同浓度LIG(0、0.25、0.5、1.0、2.0μmol/L)组和LPS(0.5 ng/mL)+3-MA(250μmol/L)+不同浓度LIG(0、0.25、0.5、1.0、2.0μmol/L)组,分别加入空白溶剂或对应药物,继续培养24 h。CCK-8法检测各组细胞增殖情况,流式细胞术检测各组细胞凋亡情况。
1.10 统计学分析 应用Graphpad Prism 6.0软件进行统计学分析,实验数据以平均值 ±标准偏差(mean±standard derivation,SD)表示。组间比较采用单因素方差分析和t检验,试验均重复3次或以上,以P<0.05为差异有统计学意义。
2 结果
2.1 L I G对L PS诱导的B EA S-2B细胞增殖的影响LPS会显著抑制BEAS-2B细胞的增殖能力,且随着LPS浓度的升高细胞增殖能力逐渐下降,LPS浓度在0.125~0.5 ng/mL时,可显著抑制细胞增殖。各浓度LPS组加入LIG均可不同程度地增强细胞增殖活性,LPS浓度为0.5 ng/mL时,LPS组细胞存活率为(56.4±6.24)%,LPS+LIG组细胞存活率为(69.2±9.8)%。LPS浓度不高于0.5 ng/mL时,LPS+LIG组细胞增殖能力与空白对照差异无统计学意义(t=0.67~2.65,P>0.05),治疗效果较好。见图1。

图1 LIG对LPS诱导的BEAS-2B细胞增殖的影响Fig.1 Effect of LIG on proliferation of BEAS-2B cells induced by LPS
2.2 L I G对L PS诱导的B EA S-2B细胞凋亡的影响
2.2.1 流式细胞术 0.5 ng/mL LPS处理24 h后,BEAS-2B细胞凋亡率从(1.90±0.18)%上升至(15.96±0.21)%,而0.5 ng/mL LPS+2.0μmol/L LIG处理24 h后,细胞凋亡率下降至(3.69±0.38)%,LPS组显著高于对照组和LPS+LIG组(t分别为4.65和3.26,P分别为0.016和0.0276)。见图2和图3。

图2 流式细胞术检测各组BEAS-2B细胞的凋亡Fig.2 Flow cytometry of apoptosis of BEAS-2B cells in various groups

图3 各组BEAS-2B细胞的凋亡率Fig.3 Apoptosis rates of BEAS-2B cells in various groups
2.2.2 Hoechst33258法 LPS组部分细胞核出现了固缩、碎裂和荧光亮度增强等典型的细胞凋亡现象,而LPS+LIG组和对照组细胞核形态无显著区别,见图4。

图4 Hoechst33258染色检测各组BEAS-2B细胞的凋亡(标尺:50μm)Fig.4 Test for apoptosis of BEAS-2B cells in various groups by Hoechst33258 staining(bar=50μm)
2.3 L I G对L PS诱导的B EA S-2B细胞形态的影响透射电镜观察显示,对照组BEAS-2B细胞未发现明显异常;LPS组细胞中部分线粒体结构不完整,线粒体膜破坏;LPS+LIG组细胞中可观察到较多自噬空泡,并可见部分自噬空泡与受损的线粒体融合。见图5。表明LIG可能通过增强自噬从而发挥对BEAS-2B细胞的保护作用。

图5 透射电镜观察各组BEAS-2B细胞的线粒体等细胞器形态(标尺:1μm)Fig.5 TEM of morphology of main organelle including mitochondrion in BEAS-2Bcells in various groups(bar=1μm)
2.4 激光共聚焦显微镜下观察GF P-L C3荧光 荧光显微镜观察显示,对照组BEAS-2B细胞存在一定的绿色GFP-LC3荧光点;而LPS组荧光点较对照组显著减少,绿色荧光弥散性分布于整个细胞中;与对照组和LPS组比较,LPS+LIG组荧光点数量显著增加,且绿色荧光区域显著聚集于荧光亮点中。见图6。

图6 激光共聚焦显微镜观察各组BEAS-2B细胞的自噬小体(标尺:10μm)Fig.6 Laser confocal microscopy of autophagosomes in BEAS-2B cells of various groups(bar=10μm)
2.5 L I G对L PS诱导的B EA S-2B细胞凋亡和自噬相关蛋白表达水平的影响 Western blot分析显示,LPS组BEAS-2B细胞的细胞色素C和cleaved Caspase-3蛋白表达水平高于对照组,而LPS+LIG组较LPS组有所下降;同时与对照组比较,LPS组BEAS-2B细胞Bcl-2蛋白表达下调,LPS+LIG组有所提升。表明LIG可部分缓解LPS导致的BEAS-2B细胞凋亡。对照组中LC3-Ⅱ蛋白表达水平高于LPS组,而LPS+LIG组可部分恢复LC3-Ⅱ的表达水平。LPS组p62蛋白表达水平高于对照组,而LPS+LIG组p62表达水平下调。见图7。结合透射电镜和激光共聚焦显微镜结果,LPS可导致BEAS-2B细胞线粒体损伤和诱导凋亡,并抑制细胞自噬,而加入LIG可有效提高BEAS-2B细胞的自噬水平。
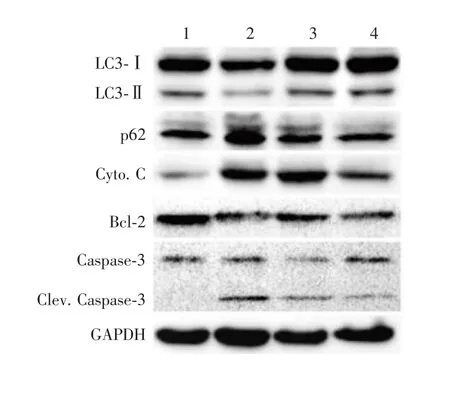
图7 Western blot分析LIG处理前后各组BEAS-2B细胞凋亡和自噬相关蛋白的变化Fig.7 Western blotting of expressions of apoptosis-and autophagy-associated proteinsin BEAS-2Bcellsof variousgroups
2.6 自噬抑制剂对L I G缓解L PS诱导的B EA S-2B细胞增殖和凋亡的影响 与对照组比较,LPS组BEAS-2B细胞存活率显著下降,随着LIG浓度的上升,细胞存活率逐渐提高;分别加入自噬抑制剂3-MA或HCQ后,LIG的保护作用几乎完全消失。见图8。流式细胞术检测结果显示,LIG+LPS组细胞凋亡率(约8.0%)显著低于LPS组(约25.2%),与对照组(约6.5%)相当;进一步加入自噬抑制剂3-MA或HCQ后,部分逆转了LIG缓解LPS诱导的BEAS-2B细胞凋亡作用(细胞凋亡率分别约为23.4%和17.8%)。见图9和图10。上述结果提示,LIG对LPS诱导的BEAS-2B细胞损伤的治疗作用可能是通过诱导细胞保护性自噬实现的。

图8 各组BEAS-2B细胞的增殖情况Fig.8 Proliferation of BEAS-2B cells in various groups
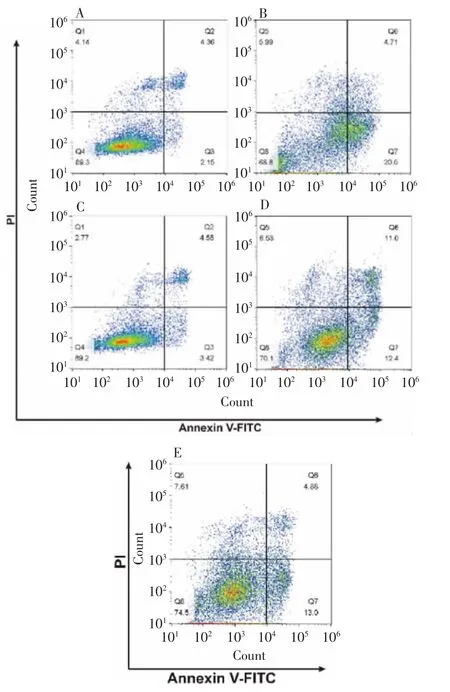
图9 流式细胞术检测各组BEAS-2B细胞的凋亡情况Fig.9 Flow cytometry of apoptosis of BEAS-2B cells in various groups
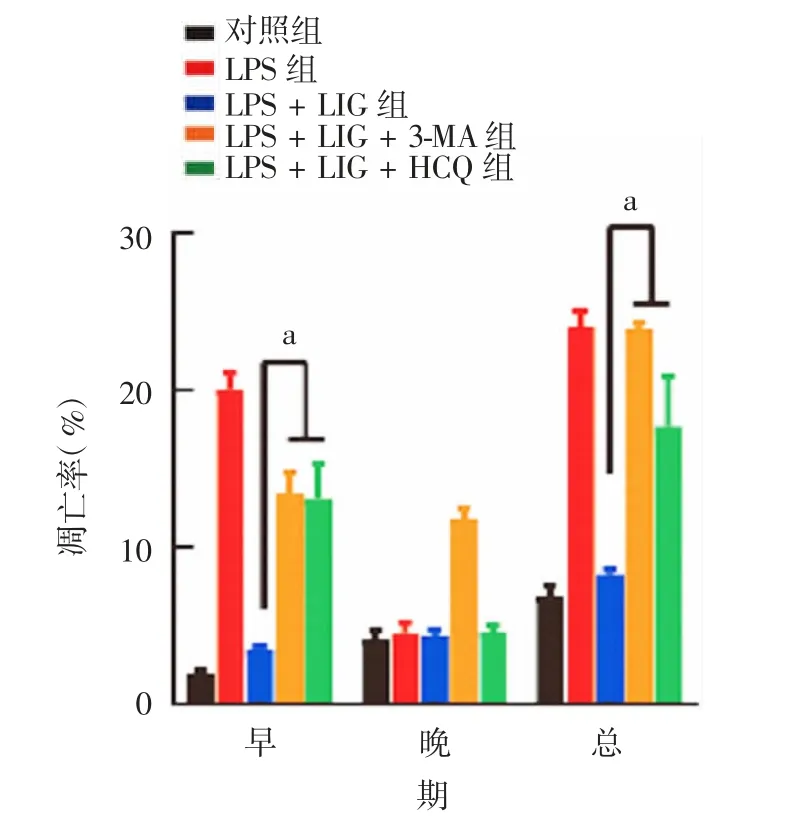
图10 各组BEAS-2B细胞的凋亡率Fig.10 Apoptosis rates of BEAS-2B cells in various groups
3 讨 论
本研究通过体外试验进一步验证LPS对BEAS-2B细胞的损伤作用,同时也首次报道了LIG对于LPS诱导的肺上皮细胞的保护作用。研究表明,大多数肺部感染导致急性肺损伤的起因是多方面的,可能存在多个并发机制[9],同时,许多肺组织损害均会直接影响肺泡和支气管上皮细胞。前期研究也发现,LPS会显著抑制鼠肾小管上皮细胞TCMK-1的活性,且随着浓度的增加,细胞活性显著降低。加入UA后,细胞活性有所增加,表明UA可改善LPS对TCMK-1的损伤[10]。ZHENG等[11]观察到LPS处理HK-2细胞后,HK-2细胞呈圆形或梭形,轮廓不清,细胞-细胞连接较弱,黏附减少,HK-2细胞数量减少,提示LPS抑制HK-2细胞的生长。CCK-8试验显示,LPS同样会抑制HK-2的活性。除了细胞坏死,研究还发现,LPS导致的肺上皮细胞死亡还包括凋亡和可能的自噬性死亡[12]。本研究通过透射电镜观察发现,LPS处理的BEAS-2B细胞线粒体结构被破坏,经LIG处理后的细胞中自噬空泡增加,并观察到受损的线粒体与自噬空泡融合,表明LIG可能通过诱导保护性自噬发挥作用。自噬是一种通过自噬小体和溶酶体融合后,靶向降解胞内细胞器、蛋白质等大分子的多步骤过程,降解的细胞内容物被重新用于合成新的大分子和细胞器[13]。自噬在生理过程和许多疾病发病机制中发挥重要作用。在正常生理条件下,自噬通过控制受损蛋白质和细胞器的周转来维持细胞稳态。在病理条件下,广泛的细胞应激,包括细胞饥饿、缺氧和氧化损伤等均会诱导自噬的发生[14]。已有研究发现,BEAS-2B细胞存在基础水平的自噬,且抑制自噬会加重LPS诱导的BEAS-2B细胞损伤,而增强自噬会减轻损伤,表明自噬对于BEAS-2B细胞损伤同样可能存在保护作用[15],这与本文的观察一致。因此,本研究通过转染GFP-LC3融合蛋白质粒后观察细胞自噬情况,并检测相关分子的蛋白水平。转染GFP-LC3后,观察到对照组BEAS-2B细胞中存在绿色荧光点,表明BEAS-2B细胞存在一定基础水平的自噬。加入LPS后,荧光点显著减少,且Western blot分析显示,LC3-Ⅱ蛋白水平下降。同时,LPS+LIG组较对照组和LPS组荧光点显著增加,呈显著聚集趋势。且LC3-Ⅱ蛋白水平明显升高,表明LIG可有效诱导自噬。LC3家族是哺乳动物细胞中自噬相关基因(autophagy related gene 8,ATG8)的同源物,目前被认为是一种自噬相关蛋白,LC3定位于自噬膜表面,参与自噬体的形成,其表达强度与自噬活性密切相关。LC3分为Ⅰ型和Ⅱ型,自噬启动前LC3主要形式为LC3-Ⅰ,自噬启动后LC3-Ⅰ通过泛素化作用与自噬膜上的磷脂酰醇结合形成LC3-Ⅱ,因此,LC3-Ⅱ的水平与自噬水平相关,常用于监测自噬活性。p62又称SQSTM1,是一种重要的选择性自噬接头蛋白,其可与LC3-Ⅱ结合,并靶向介导自噬溶酶体降解[16]。p62在自噬过程中会与结合的蛋白一起被降解,因此,自噬活性的增强会导致p62水平的下降。本研究发现,LPS组BEAS-2B细胞p62表达水平显著升高,而加入LIG后,p62表达水平显著下降,与LC3-Ⅱ表达水平显著升高相符合,表明LIG可诱导自噬以减少BEAS-2B细胞损伤。自噬水平的差异可能与LPS处理时间、浓度以及研究对象有关。上述结果均提示,细胞自噬可能与LPS导致的急性肺损伤相关,且增强保护性自噬对肺损伤可能发挥保护作用。
线粒体是复杂的细胞器,存在于每个有核的真核细胞内,提供关键的功能,使复杂的有机体生存。线粒体是三磷酸腺苷(adenosine triphosphate,ATP)合成的主要部位,在细胞凋亡、坏死、自噬、应激调节、脂质和碳水化合物的产生、钙储存及先天免疫中也起着关键作用[17]。因此,线粒体功能障碍与凋亡、衰老、基因组不稳定、炎症和代谢紊乱密切相关。线粒体功能损伤和功能障碍与急性肺损伤的发展也密切相关。博来霉素诱导的肺损伤模型中同样观察到线粒体减少、嵴破裂和晚期线粒体广泛肿胀[18]。在重症监护病房中获得的组织活检的生化和结构研究证明,在脓毒血症患者中,肺组织线粒体损伤也明显存在[19]。本研究未进一步探讨自噬清除受损线粒体的上下游调控机制,同时由于技术条件的限制,未进行动物实验进一步验证LIG介导的自噬对LPS诱导的急性肺损伤的保护作用。后续希望能够进一步深入开展相关研究,并最终实现临床转化。
