Sabin株脊髓灰质炎灭活疫苗与不同包材的相容性
2021-07-20平玲牛杰张铭润何陆涛唐靖月卢振攀赵冠华蔡玮
平玲,牛杰,张铭润,何陆涛,唐靖月,卢振攀,赵冠华,蔡玮
中国医学科学院医学生物学研究所,云南昆明650032
近年,我国制药行业发展迅速,药品包材对药品质量的影响备受关注,特别是直接接触药品的包材,对确保药品的安全性、有效性、稳定性具有重要作用。因此,直接接触药品的包材必须符合药用要求,以保障用药安全及人体健康。
药用玻璃是疫苗注射剂产品最主要的包材,按化学组成和产品性能分为高硼硅玻璃、中性硼硅玻璃、低硼硅玻璃和钠钙玻璃[1-2]。中国医学科学院医学生物学研究所生产的Sabin株脊髓灰质炎灭活疫苗(sabin inactivated poliovirusvaccines,sIPV)于2015年在国内上市。从注册申报至今,sIPV所使用的包材均为中性硼硅玻璃管制注射剂瓶,包装规格为0.5 mL/剂的单剂量包装。随着时代发展和市场需求的变化,需要变更和新增包材,以适应不同的需求。以中性硼硅玻璃制备的预灌封注射器,由于其能最大限度地降低从生产到使用过程中耗费的人工和经济成本,便于临床应用,已成为非免疫规划疫苗包装材料的最佳选择[3]。另外,随着消灭脊髓灰质炎最后阶段战略计划的推进,国际市场对sIPV的需求愈发显著,特别是欠发达地区。因此,WHO希望我国尽快完成WHO PQ预认证,实现sIPV出口。根据WHO的要求,供应出口需提供单瓶多剂量(灌装量为3.0 mL,标示量为2.5 mL/瓶)包装,sIPV拟采用的包材需增加预灌封注射器和4 mL中性硼硅西林瓶。因此,本研究对sIPV与上述两种玻璃容器的相容性进行评价,并与目前使用的2 mL中硼硅西林瓶进行比较,以期为sIPV的WHO PQ预认证提供实验依据。
1 材料与方法
1.1 疫苗 按照sIPV生产分装工艺规程,用临床试验用sIPV 3个型别的单价原液配制4批试验性三价疫苗半成品(批号为:20111201、20111202、20111203、20111204),用工艺验证阶段生产的sIPV 3个型别的单价原液配制3批试验性三价疫苗半成品(批号为:验IS半201501、验IS半201502、验IS半291503),均由中国医学科学院医学生物学研究所制备及分装。
1.2 包材 中硼硅玻璃管制西林瓶(4 mL,批号为:15121606、15010607、15010608)及中硼硅玻璃管制西林瓶(2 mL,批号为:10040903、11011701、11011705、11012306)购自肖特新康药瓶包装有限公司;预灌封注射器(批号为:140622、140910、140950)购自山东威高集团医用高分子制品股份有限公司。
1.3 s I P V成品的配制及分装
1.3.1 中性硼硅玻璃管制西林瓶(2 mL) 将1批试验性三价疫苗半成品(批号为:20111201)分装至3批(批号为:10040903、11011701、11011705)中性硼硅玻璃管制西林瓶(2 mL),成品批号为:20111201-1、20111201-2、20111201-3;将另外3批(批号为:2011-1202、20111203、20111204)分装至同批(批号为:11-012306)中性硼硅玻璃管制西林瓶(2 mL),成品批号为:20111202、20111203、20111204。均0.6 mL/支,每批500支。
1.3.2 预灌封注射器及中性硼硅玻璃管制西林瓶(4 mL) 将1批试验性三价疫苗半成品(验IS半201-501)分装至3批(批号为:140622、140910、140950)预灌封注射器中,成品批号为:验IS20150501、验IS-20150502、验IS20150503;将3批(批号为:验IS半201501、验IS半201502、验IS半291503)分装至同批(批号为:140950)预灌封注射器中,成品批号为:验IS20150503(与上述验IS20150503批试验重复)、验IS20150504、验IS20150505。0.55 mL/支,每批1 000支。将1批试验性三价疫苗半成品(验IS半201501)分装至3批(批号为:15121606、15010607、15010608)中性硼硅玻璃管制西林瓶(4 mL),成品批号为:验IS20150506、验IS20150507、验IS20150508;将3批(批号为:验IS半201501、验IS半201502、验IS半291503)分装至同批(批号为:15010608)中性硼硅玻璃管制西林瓶(4 mL),成品批号为:验IS20150508(与上述IS20150508批试验重复)、验IS20150509、验IS20150510。3 mL/支,每批1 000支。
1.4 热加速稳定性试验 按照《中国药典》四部(2015版)9001《原料药与药物制剂稳定性试验指导原则》[4]和《药品包装材料与药物相容性试验指导》的要求,对分装后的疫苗进行不同温度保存不同时间相容性和稳定性考察[5-6]。将疫苗置(37±2)℃,相对湿度(75±5)%条件下保存0、7和14 d,检测疫苗的外观、装量、pH、无菌试验、细菌内毒素、D抗原含量,并按下式计算D抗原回收率;置(25±2)℃,相对湿度(60±5)%条件下保存1、2、3、6个月时,进行质量检测,内容同上。
D抗原回收率(%)=各时间点D抗原含量/初始D抗原含量×100%
1.5 长期稳定性试验 将疫苗置2~8℃保存3、6、9、12、18、24、36个月,其中0、24、36个月时进行鉴别试验、外观、装量、pH、2-苯氧乙醇、游离甲醛、蛋白质含量、DNA残留量、D抗原含量(并计算D抗原回收率,公式同1.4项)、牛血清白蛋白残留量、抗生素残留量、无菌试验、细菌内毒素、异常毒性试验、大白鼠效力试验;其他时间点检测外观、装量、pH、蛋白含量、无菌试验、细菌内毒素、异常毒性试验、D抗原含量(并计算D抗原回收率,公式同1.4项)[7-8]。
1.6 统计学分析 应用SPSS 19.0软件对试验数据进行统计分析,D抗原回收率数据采用均值±标准差(±s)表示,组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 热加速稳定性试验结果
2.1.1 中性硼硅玻璃管制西林瓶(2 mL) 6批疫苗于(37±2)、(25±2)℃贮存不同时间后,肉眼观察呈橘红色液体,无异物,装量>0.5 mL,pH、细菌内毒素和无菌检查结果均合格。于(37±2)℃保存14 d时,Ⅰ、Ⅱ、Ⅲ型D抗原回收率分别为(92±2)%、(96±2)%、(95±2)%,见图1;于(25±2)℃保存6个月时,Ⅰ、Ⅱ、Ⅲ型D抗原回收率分别为(90±5)%、(90±4)%、(90±5)%,见图2。

图1 中性硼硅玻璃管制西林瓶(2 mL)分装的sIPV于(37±2)℃下保存不同时间的D抗原含量Fig.1 Contents of D antigen of sIPV in vials prepared with neutral borosilicate glass(2 mL)after storage at(37±2) ℃for various time durations
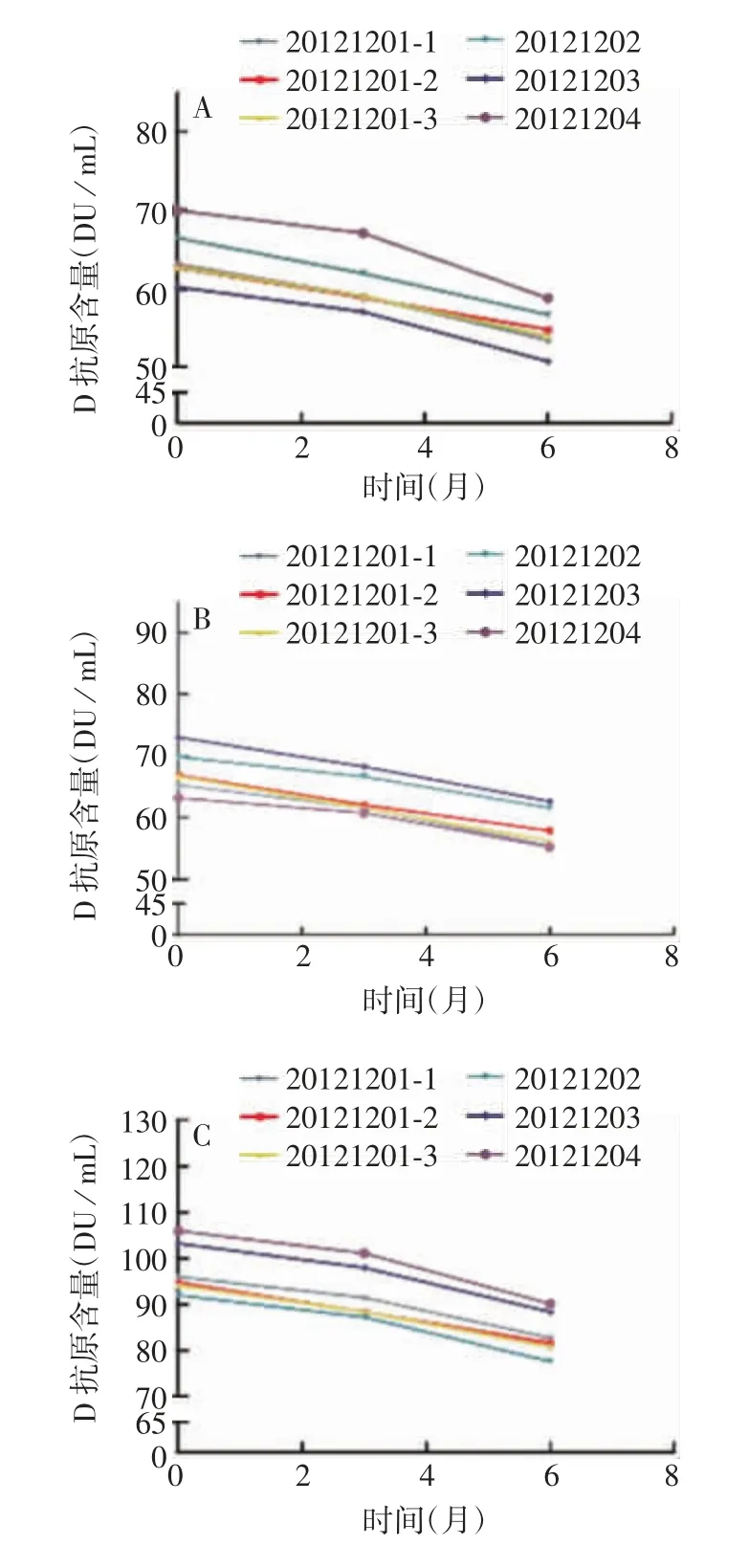
图2 中性硼硅玻璃管制西林瓶(2 mL)分装的sIPV于(25±2)℃下保存不同时间的D抗原含量Fig.2 Contents of D antigen of sIPV in vials prepared with neutral borosilicate glass(2 mL)after storage at(25±2)℃for various time durations
2.1.2 预灌封注射器及中性硼硅玻璃管制西林瓶(4 mL)5批两种包材的疫苗于(37±2)及(25±2)℃保存不同时间后,肉眼观察均呈橘红色液体,无异物,pH、细菌内毒素和无菌检查结果均合格,预灌封注射器及中性硼硅玻璃管制西林瓶(4 mL)装量分别为>0.5和>2.5 mL。预灌封注射器包装的疫苗于(37±2)℃保存14 d,Ⅰ、Ⅱ、Ⅲ型D抗原回收率分别为(82±6)%、(91±3)%、(87±4)%;于(25±2)℃保存6个月时,Ⅰ、Ⅱ、Ⅲ型D抗原回收率分别为(88±6)%、(94±5)%、(87±3)%。见图3。中性硼硅玻璃管制西林瓶(4mL)包装的疫苗于(37±2)℃保存14d,Ⅰ、Ⅱ、Ⅲ型D抗原回收率分别为(82±6)%、(91±3)%、(87±4)%;(25±2)℃保存6个月时,Ⅰ、Ⅱ、Ⅲ型D抗原回收率分别为(88±6)%、(94±5)%、(87±3)%。见图4。
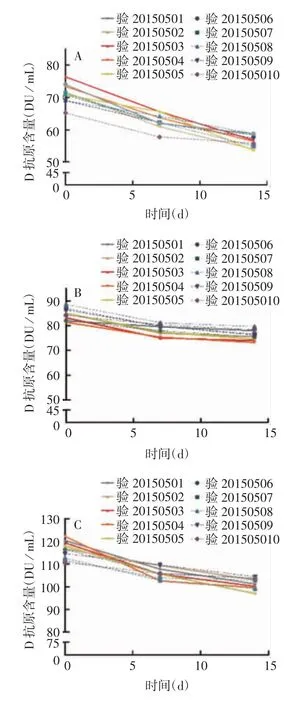
图3 预灌封注射器及中性硼硅玻璃管制西林瓶(4 mL)分装的sIPV于(37±2)℃下保存不同时间的D抗原含量Fig.3 Contents of D antigen of sIPV in prefilled syringes and vials prepared with neutral borosilicate glass(4 mL)after storage at(37±2)℃for various time durations

图4 预灌封注射器及中性硼硅玻璃管制西林瓶(4 mL)分装的sIPV于(25±2)℃下保存不同时间的D抗原含量Fig.4 Contents of D antigen of sIPV in prefilled syringes and vials prepared with neutral borosilicate glass(4 mL)after storage at(25±2)℃for various time durations
2.2 长期稳定性试验结果
2.2.1 中性硼硅玻璃管制西林瓶(2 mL) 6批疫苗于2~8℃保存36个月时,肉眼观察均呈橘红色液体,无异物;装量>0.5 mL;pH、无菌检查及异常毒性检查结果合格,残留DNA<10 pg/剂,残留BSA<2.6 ng/剂,残留抗生素<2.9 ng/剂,细胞内毒素<10 EU/剂,异常毒性正常,大白鼠效力试验ED50高于参考品ED50,2-苯氧乙醇、游离甲醛、蛋白含量均在合格范围内,见图5;Ⅰ、Ⅱ、Ⅲ型D抗原回收率分别为(92±7)%、(93±6)%、(93±6)%,均在质控范围内,见图6。

图5 中性硼硅玻璃管制西林瓶(2 mL)分装的sIPV于2~8℃贮存36个月时的2-苯氧乙醇(A)、蛋白(B)及游离甲醛含量(C)Fig.5 Contents of 2-phenoxyethanol(A),protein(B)and free formaldehyde(C)of sIPV in vials prepared with neutral borosilicate glass(2 mL)after storage at 2~8℃for 36 months
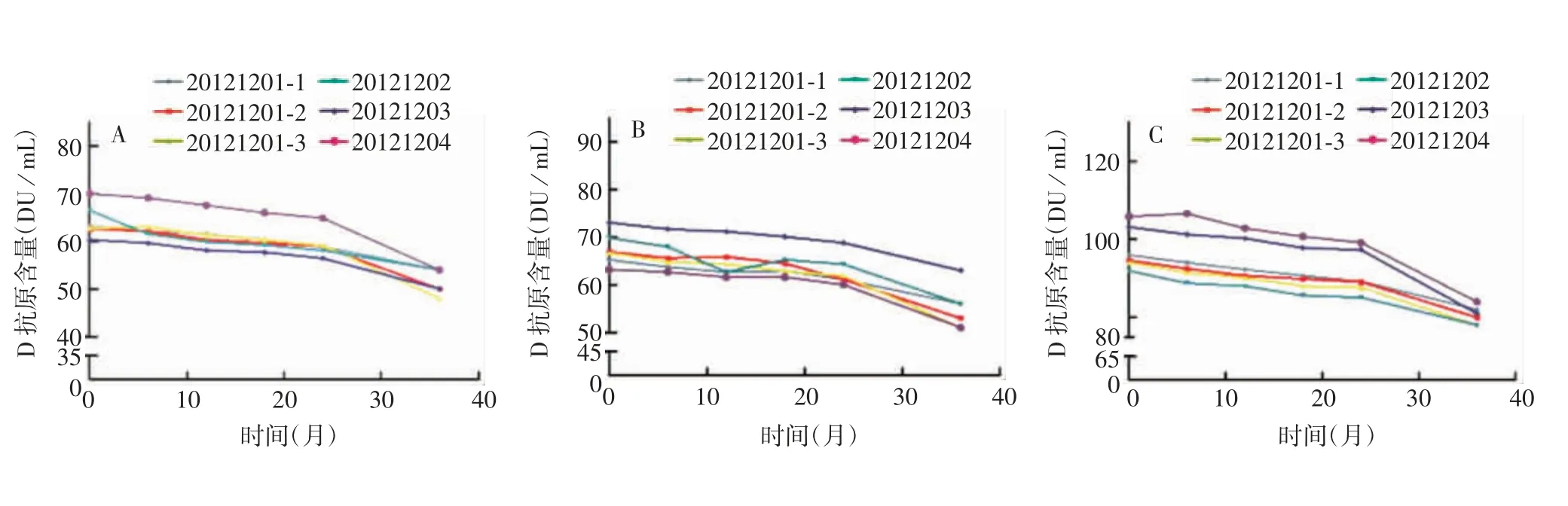
图6 中性硼硅玻璃管制西林瓶(2 mL)分装的sIPV于2~8℃贮存36个月时的D抗原含量Fig.6 D antigen content of sIPV in vials prepared with neutral borosilicate glass(2 mL)after storage at 2~8℃for 36 months
2.2.2 预充注射器及中性硼硅玻璃管制西林瓶(4 mL)5批两种包材的疫苗于2~8℃保存36个月时,肉眼观察均呈橘红色液体,无异物,pH、无菌检查及异常毒性检查结果合格,残留DNA<50 pg/剂,残留抗生素<0.25 ng/剂,细胞内毒素<10 EU/剂,大白鼠效力试验ED50高于参考品ED50,预充注射器及中性硼硅玻璃管制西林瓶(4 mL)装量分别为>0.5和>2.5 mL,残余BSA分别为<6.6和<1.25 ng/剂;2-苯氧乙醇、游离甲醛、蛋白含量均在合格范围内,见图7和图8。预灌封注射器包装的疫苗于2~8℃保存36个月时,Ⅰ、Ⅱ、Ⅲ型D抗原的回收率为(88±8)%、(96±5)%、(94±8)%;中性硼硅玻璃管制西林瓶(4 mL)包装疫苗的Ⅰ、Ⅱ、Ⅲ型D抗原回收率分别为(91±8)%、(91±6)%、(97±8)%。均在质控范围内,见图9。
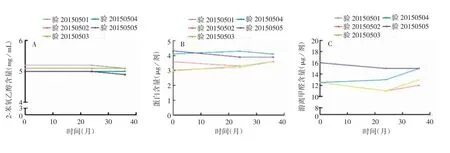
图7 预灌封注射器分装的sIPV于2~8℃保存36个月的2-苯氧乙醇(A)、蛋白(B)及游离甲醛含量(C)Fig.7 Contentsof 2-henoxyethanol(A),protein(B)and free formaldehyde(C)of sIPV in prefilled syringes after storage at 2~8℃for 36 months

图8 中性硼硅玻璃管制西林瓶(4 mL)分装的sIPV于2~8℃保存36个月时的2-苯氧乙醇(A)、蛋白(B)及游离甲醛含量(C)Fig.8 Contents of 2-henoxyethanol(A),protein(B)and free formaldehyde(C)of sIPV in vials prepared with neutral borosilicate glass(2 mL)after storage at 2~8℃for 36 months
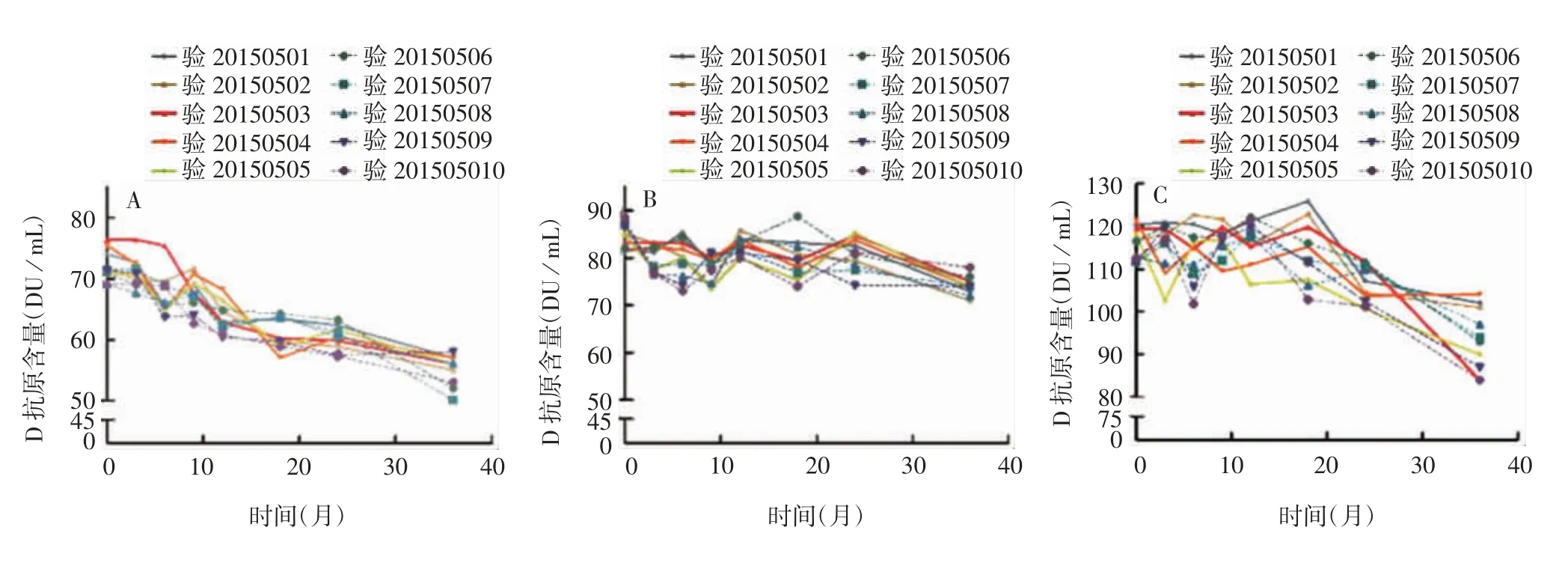
图9 预灌封注射器及中性硼硅玻璃管制西林瓶(4 mL)分装的sIPV于2~8℃保存36个月时的D抗原含量Fig.9 D antigen content of sIPV in prefilled syringes and vials prepared with neutral borosilicate glass(4 mL)after storage at 2~8℃for 36 months
2.3 D抗原回收率的比较 3种包材的疫苗于不同温度下保存不同时间的Ⅰ、Ⅱ、Ⅲ型D抗原回收率差异均无统计学意义(F分别为3.234、4.357、2.234,P分别为0.111、0.068、0。188),见图10。表明3种包材对sIPV的D抗原含量无显著影响,均具有良好的相容性。
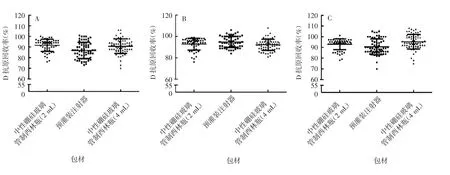
图10 3种包材的sIPV D抗原回收率的比较Fig.10 Recovery rates of D antigen of sIPV in three kinds of containers
3 讨论
中性硼硅玻璃瓶材质热膨胀系数是5.0,三氧化二硼的含量是8%~12%,其强度、抗热震、耐冷冻等方面的能力较强;同时具有良好的耐水性,抗酸碱的能力均为一级[9]。目前,sIPV使用的是2 mL规格的中性硼硅西林瓶,即0.5 mL/瓶的单剂包装。投入市场近5年的时间内,此包装形式的sIPV市场反馈良好,质量稳定。随着时代进一步发展,市场需求出现新的变化,对sIPV的包装形式提出新的需求。一方面,为满足全球消灭脊灰的需求,增加单瓶多剂量西林瓶包装供应出口[10-11],单瓶多剂量包装疫苗每人份剂量售价低于单剂量包装疫苗,且在冷链运输和冷链储藏过程中可节约大量空间,在物流和储存环节节约成本[12-13],该规格也是WHOPQ要求的sIPV包装形式;另一方面,预灌封注射器采用Ⅰ类中性玻璃和橡胶组件,与药物具有良好的相容性和稳定性,同时具有储存药物和注射两种作用,安全可靠,与传统的药瓶+注射器的方式比较,可降低从生产到使用中所耗费的人工和经济成本[14-15],是二类疫苗理想包装形式。
本实验结果表明,4 mL规格中性硼硅西林瓶和预灌封注射器包装的疫苗于(37±2)℃保存14 d、(25±2)℃保存6个月、2~8℃保存36个月(疫苗的有效期是两年)时,sIPV的相关检测指标均符合规定的质量标准。3种包材的疫苗于不同温度下保存不同时间的Ⅰ、Ⅱ、Ⅲ型D抗原回收率差异均无统计学意义(P>0.05),表明包装容器对sIPV稳定性和有效性的影响可忽略,sIPV与新增的两种包材具有良好相容性。因此,以中性硼硅西林瓶(4 mL)和预灌封注射器作为sIPV疫苗的包材,可满足各项相关指标的要求,确保疫苗质量的稳定性。
