羧甲基化沙柳木粉膜吸附四环素性能研究
2021-07-20刘萌赵白云刘泽王丽
刘萌,赵白云,刘泽,王丽
(内蒙古农业大学 材料科学与艺术设计学院 内蒙古自治区沙生灌木资源纤维化和能源化开发利用重点实验室,内蒙古 呼和浩特 010018)
近年来,水环境中抗生素污染带来的潜在风险和健康隐患引起广泛关注。吸附法被公认为是一种很有前途的抗生素残留去除方法[1]。
沙柳木粉(SPP)中含有丰富的纤维素、半纤维素和木质素。经羧甲基后的SPP物理化学性能增强,引入大量具有吸附能力的羧基和羟基[2]。由于粉状吸附剂吸附后难以回收利用,所以膜吸附剂为科研者在处理废水方面指引了方向。李志洪[3]用离子液体溶解SPP制备沙柳木粉膜并对Pb2+进行吸附,结果表明,其对Pb2+的吸附量最大为950 mg/g。 因此,本文采用离子液体溶解CMS制备CMSM,研究CMSM吸附TC的性能,此方法制备工艺简单、环保、成本低、吸附效率高和易分离回收等优点。
1 实验部分
1.1 材料与仪器
沙柳,采购于内蒙古鄂尔多斯新街治沙站,粉碎过 200 目筛;氢氧化钠、冰乙酸、一氯乙酸、无水乙醇、1-丙烯基3-甲基咪唑氯盐均为分析纯;盐酸四环素为生物制剂,96%。
RHP-400 高速多功能粉碎机;HH-4 数显恒温水浴锅;SHB-111 循环水式多用真空泵;SHA-C 数显水浴恒温振荡器;TU-1901紫外分光光度计;Tensor 27 Fourier红外变换光谱仪;Hitachi S-4800 扫描电镜。
1.2 CMSM的制备
将沙柳木粉置于烘箱烘干得到绝干沙柳木粉(SPP),过200目筛。称取4 g SPP,加入100 mL质量浓度为20%的NaOH溶液,浸泡12 h后过滤,并置于盛有40 mL无水乙醇的三口烧瓶中,将4 g氯乙酸分3批加入,60 ℃反应2 h抽滤,将产物溶于20 mL蒸馏水中,用醋酸水溶液将其pH值调至中性后倒入100 mL无水乙醇并浸泡,15 min后抽滤,于85 ℃真空干燥2 h后粉碎研磨得到羧甲基化沙柳木粉(CMS)。
称取0.6 g的CMS和10 g的1-丙烯基-3-甲基咪唑氯盐倒入三口烧瓶中并搅拌均匀,80 ℃反应2 h 后,用刮膜棒在玻璃片上刮成薄厚均匀的膜。用去离子水冲洗5 min,将膜放入装有去离子水的烧杯中并用保鲜膜封严,静置2 h。将静置后的膜在80 ℃真空干燥2 h,得羧甲基化沙柳木粉膜(CMSM)。
1.3 吸附实验
取50 mL一定浓度TC溶液加入到用锡箔纸包的锥形瓶中,加入0.01 g CMSM,放入恒温水浴振荡箱中振荡。在不同吸附条件下进行吸附。达到吸附平衡后离心,利用紫外分光光度计在波长为358 nm处测出吸附后溶液中TC的浓度,代入公式(1)计算CMSM对TC的吸附量:
(1)
式中Qe——吸附量,mg/g;
C0——初始四环素溶液浓度,mg/L;
Ce——经吸附后溶液中剩余TC溶液浓度,mg/L;
V——TC溶液的体积,L;
m——吸附剂用量,g。
2 结果与讨论
2.1 吸附条件对CMSM吸附量影响
2.1.1 吸附温度 图1表示为吸附温度对CMSM吸附TC吸附量的影响。
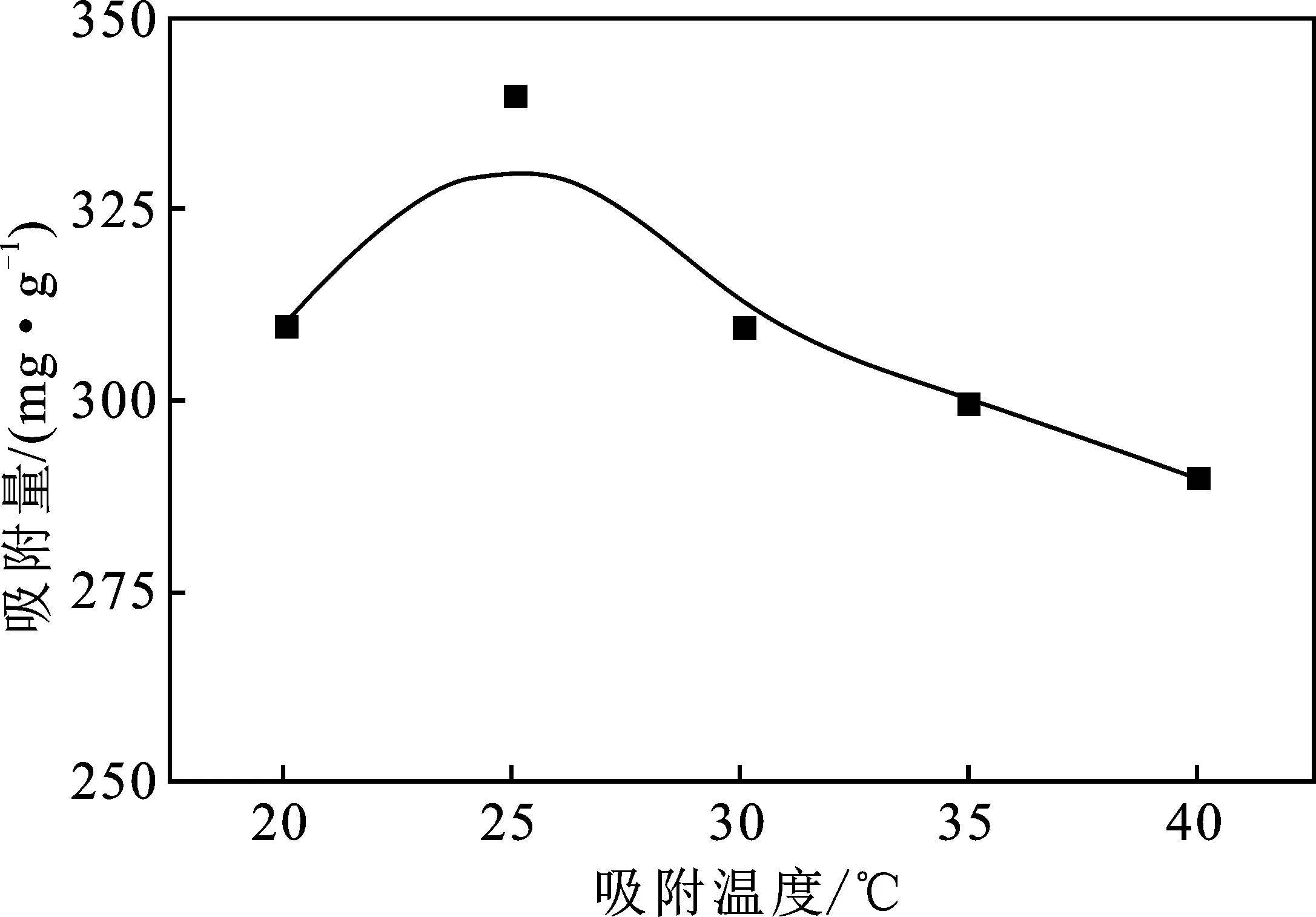
图1 吸附温度对CMSM吸附TC吸附量的影响Fig.1 Effect of the adsorbent temperature on the adsorption capacity of CMSM for TC
由图1可知,随温度的不停变化,CMSM对TC吸附量呈现先上升后下降趋势,当吸附温度为25 ℃时,吸附量达到最大,为340 mg/g。这是因为随着温度的升高,TC扩散程度增加,增大了TC与CMSM吸附位点的接触,致使吸附量增大,当温度超过25 ℃ 时,TC运动加剧,从而使一部分被吸附的TC从CMSM表面脱离,导致吸附量下降。因此,高温不利于CMSM对TC的吸附。
2.1.2 吸附时间 图2表示为吸附时间对CMSM吸附TC吸附量的影响。

图2 吸附时间对CMSM吸附TC吸附量的影响Fig.2 Influence of the adsorbent time on the adsorption capacity of CMSM for TC
由图2可知,随吸附时间的不断延长,CMSM对TC吸附量呈现先上升后平缓的趋势,当吸附时间为120 min时,吸附量达到最大,为340 mg/g,继续延长时间,吸附量趋于平衡。这是由于在吸附初期,CMSM表面的孔洞对TC进行快速吸附,使得CMSM上的吸附位点被逐渐占满[4]。随着时间的延长,吸附趋于饱和,CMSM对TC的吸附逐渐转变为狭窄空隙的慢性吸附[5],最终在120 min达到平衡状态。
2.1.3 溶液pH值 图3为pH值对CMSM吸附TC吸附量的影响。

图3 溶液pH的变化对CMSM吸附TC吸附量的影响Fig.3 Influence of the pH change on the adsorption capacity of CMSM for TC
由图3可知,在pH=6时,吸附量达到最大,为340 mg/g。这是因为溶液pH会影响CMSM的表面电荷以及TC存在形态,进而影响CMSM和TC之间的相互作用[6-7]。随着pH的升高,CMSM对TC吸附量增加,这是由于CMSM表面携带更多的正电荷,通过静电引力增强对TC的相互作用,当pH=6时,CMSM对TC的吸附量最大。当pH>6时,CMSM与TC分子之间的作用力由静电引力变为静电排斥力[8],导致CMSM对TC吸附量下降。
2.1.4 TC溶液初始浓度 图4为TC溶液初始浓度对CMSM吸附TC吸附量的影响。
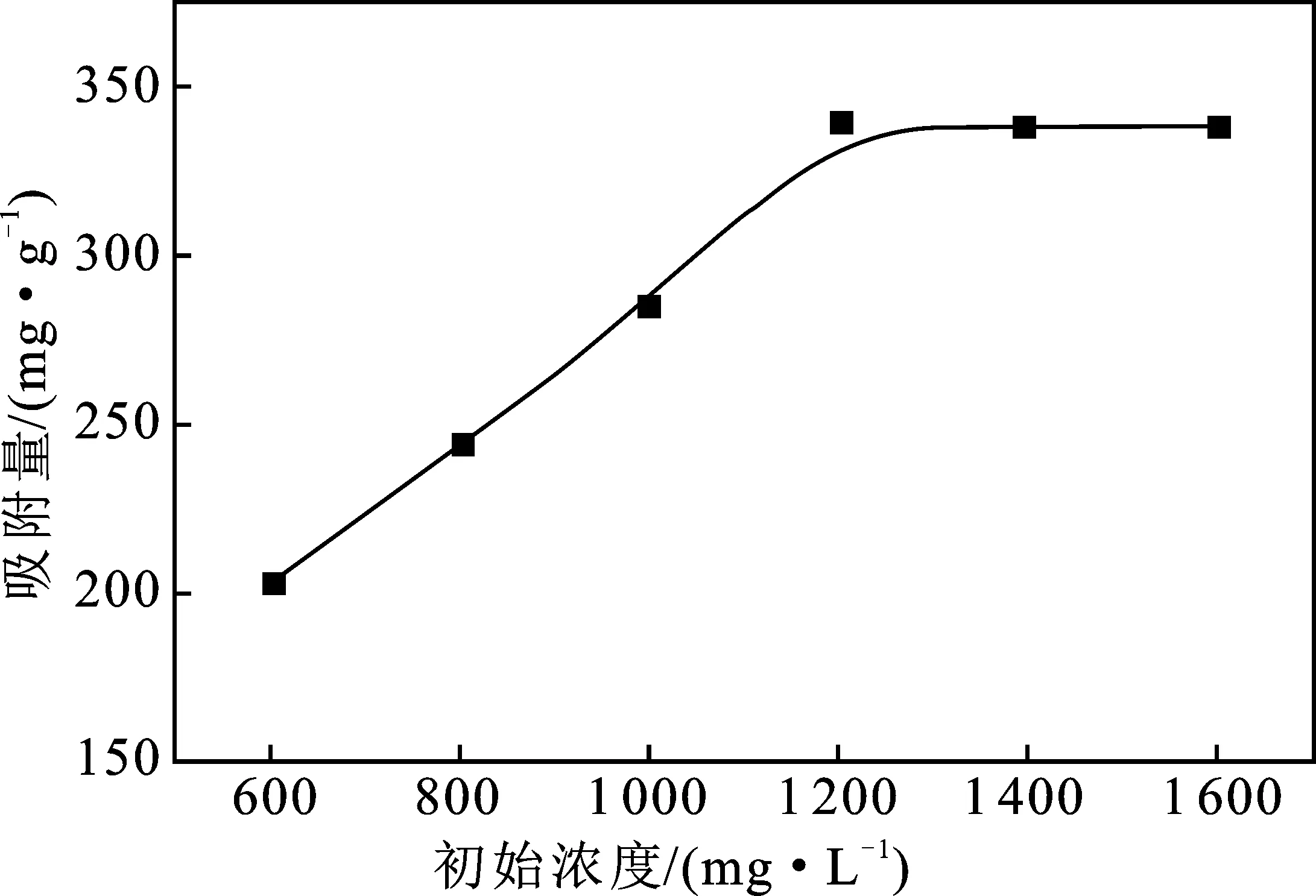
图4 TC溶液初始浓度对CMSM吸附TC吸附量的影响Fig.4 Influence of the TC initial concentration on the adsorption capacity of CMSM for TC
由图4可知,在TC初始浓度是1 200 mg/L时,CMSM吸附TC的吸附量达到最大,其值为340 mg/g。 随着TC溶液初始浓度的增大,其吸附量逐渐趋于平缓。发生该变化的主要原因是随TC初始浓度的增大,TC与CMSM之间的浓度梯度变大,TC分子的扩散程度增加[9],因此吸附量逐渐上升。当继续增大TC溶液初始浓度时,CMSM对TC的吸附量趋于平缓,这是因为CMSM的孔隙和表面吸附位点完全被TC分子占据,吸附饱和,最终达到吸附平衡。因此,当TC初始浓度为1 200 mg/L时最为合理。
2.2 SPP与CMSM红外分析

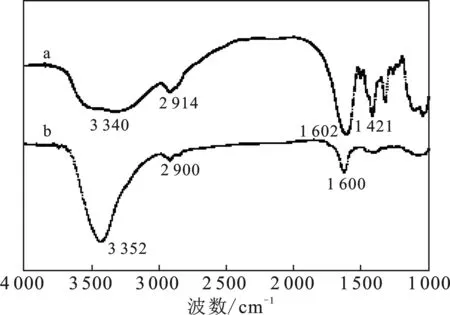
图5 SPP(a)和CMSM(b)红外谱图Fig.5 The FTIR spectra of SPP (a) and CMSM(b)
2.3 CMSM吸附TC前后SEM分析
由图6可知,CMSM表面凹凸不平,而且疏松多孔,这种结构能够增加CMSM与TC的接触面积,提高CMSM对TC的吸附能力。吸附后的CMSM表面附着了许多小颗粒,变得相对致密,这是由于TC颗粒吸附在CMSM表面造成的。

图6 CMSM吸附TC前(a)和吸附TC后(b) SEM照片Fig.6 SEM images of CMSM before adsorption (a) and CMSM after adsorption(b)
2.4 吸附动力学
使用吸附的方法来处理废水时,吸附剂的吸附速率可用吸附动力学来反映,从而对吸附剂的吸附机理进行更好地解释。为了分析CMSM对TC的吸附机理,采用准一级和准二级动力学方程对实验数据进行分析。
2.4.1 Lagergre准一级动力学模型 见式(2)。
(2)
式中qt——t时刻的吸附量,mg/g;
K1——准一级动力学模型速率常数,1/min;
qe——溶液达平衡时的吸附量,mg/g。
2.4.2 Ho准二级动力学模型 见式(3)。
(3)
式中qe——平衡吸附量,mg/g;
K2——准二级动力学模型速率常数,mg/(g·min)。
图7和图8中的曲线分别显示了CMSM吸附TC吸附过程的准一级与准二级动力学模型,表1显示为准一级与准二级动力学模型所得的相关数据。从表中数据可得,在吸附反应中,CMSM吸附TC的准一级与准二级动力学模型线性相关系数R2值分别为0.993 2和0.994 7,理论吸附量分别为281,385 mg/g。 实际测得CMSM对TC的最大吸附量为340 mg/g,由此可见,在吸附过程中,CMSM吸附TC既符合准一级动力学模型,也符合准二级动力学模型。在准一级动力学中,表现出的吸附机理为物理吸附,在准二级动力学中,吸附机理为化学吸附[11],因此说明CMSM吸附TC的过程,同时存在物理吸附和化学吸附。

图7 CMSM吸附TC的准一级动力学曲线模型Fig.7 The pseudo-first-order curve model for the adsorption of TC by CMSM

图8 CMSM吸附TC的准二级动力学模型Fig.8 The pseudo-second-order model for the adsorption of TC by CMSM

表1 CMSM吸附TC的准一级动力学和准二级动力学模型参数Table 1 The parameters of the pseudo-first-order and pseudo-second-order models for the adsorption of TC by CMSM
2.5 吸附等温线
吸附反应中,吸附质分子与吸附剂表面作用的关系可通过吸附等温线将其表示出来。采用Langmuir与Freundlich等温线模型,可对TC在CMS上的吸附行为进行更深层次的分析。
2.5.1 Langmuir模型 Langmuir吸附等温线模型的计算公式如式(4):
(4)
式中Ce——液相平衡吸附浓度,mg/L;
qe——液相平衡吸附量,mg/g;
qmax——理论最大吸附量,mg/g;
Kl——Langmuir常数,L/mg。
2.5.2 Freundlich模型 Freundlich吸附等温线模型的计算公式如式(5):
(5)
式中qe——液相平衡吸附量,mg/g;
ce——液相平衡吸附浓度,mg/L;
Kf——Freundlich常数,(mg/g)(L/mg)1/n;
n——Freundlich常数。
图9和图10分别为CMSM吸附TC的Langmuir和Freundlich等温线模型,表2显示为CMSM吸附TC的Langmuir和Freundlich等温线模型参数。从表2的数据中可得:吸附过程的Langmuir等温线模型的线性相关系数R2值为0.933 6,理论吸附量为694.1 mg/g,与实际测得的最大吸附量340 mg/g相差较大; CMSM吸附TC的Freundlich等温线模型的线性相关系数R2为0.996 4,具有良好的线性相关性,而且当0<1/n<1时,为优惠吸附[12],CMSM吸附TC的Freundlich等温线模型的1/n为0.698 7。通过对所得数据进行比较,发现CMSM吸附TC的过程更符合Freundlich等温线模型,表明在吸附过程中,吸附剂的表面存在有不同的吸附位点,CMSM吸附TC的过程属于多分子层吸附[13]。

图9 吸附过程的Langmuir模型Fig.9 The Langmuir model of the adsorption process
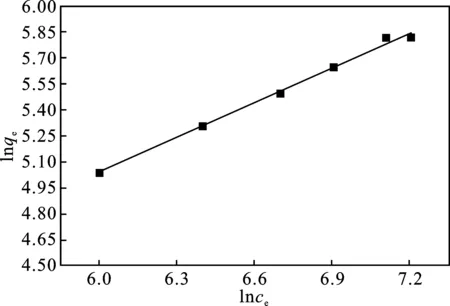
图10 吸附过程的Freundlich等温线模型Fig.10 Freundlich model for the adsorption process

表2 CMSM吸附TC的Langmuir和Freundlich模型参数Table 2 The parameters of the Langmuir and Freundlich models for the adsorption of TC on CMSM
3 结论
实验结果表明:当吸附温度为25 ℃,吸附时间为2 h,pH值为6,TC溶液初始浓度为1 200 mg/L时,CMSM对TC的吸附量达到最大,为340 mg/g。CMSM对TC的吸附动力学同时符合准一级和准二级动力学模型,吸附等温线符合Freundlich 吸附等温线模型,属于物理和化学吸附共存的多分子层吸附。
表征结果显示:相比SPP,CMSM中具有吸附能力的羟基增加,有利于提高CMSM对TC的吸附量;吸附前的CMSM表面粗糙,疏松多孔,吸附后的CMSM表面附着许多TC小颗粒。
