DC与CIK共培养对骨肉瘤细胞的杀伤作用
2021-07-20赵杰炳田浩尚付生冯建军
赵杰炳 田浩 尚付生 冯建军
骨肉瘤是常见的原发性骨恶性肿瘤,肺和骨是最常见的转移部位[1⁃2]。手术和辅助化疗能延长骨肉瘤患者的生存期,但复发、转移或不能手术切除患者的预后仍不理想[3⁃6]。因此,寻找治疗骨肉瘤的新方法对提高患者生存期具有重要的临床意义。近年来,研究者们探索了晚期肉瘤多种细胞免疫治疗方案[7]。树突状细胞(dendritic cells,DC)作为体内启动细胞免疫反应的主要抗原呈递细胞,可用于增强肿瘤特异性免疫反应[8]。而细胞因子诱导的杀伤细胞(cytokine⁃induced killer cells,CIK)是体内重要的免疫活性细胞,增殖能力和细胞毒作用强,也能特异性识别肿瘤细胞,已成为肿瘤过继细胞免疫治疗的首选方案[9]。DC⁃CIK治疗是指将上述两种细胞进行共培养,从而发挥更强的肿瘤杀伤作用,目前在包括骨肉瘤在内的多种恶性肿瘤中得到了初步验证[10],但DC⁃CIK治疗骨肉瘤确切的作用尚未明确。研究发现,抑制程序性细胞死亡蛋白⁃1(programmed death receptor⁃1,PD⁃1)及其配体(programmed death receptor ligand⁃1,PD⁃L1)能显著增强DC⁃CIK对肝癌细胞的杀伤作用,诱导更有效的免疫细胞浸润,说明PD⁃1/PD⁃L1信号通路可能是DC⁃CIK疗法的重要机制[11]。PD⁃1/PD⁃L1通路是否在DC⁃CIK治疗骨肉瘤中发挥同样作用尚未见报道。本研究通过共培养DC和CIK,探讨其对人骨肉瘤细胞的杀伤作用及其初步的作用机制。
1 材料和方法
1.1 主要材料和试剂
人骨肉瘤细胞HOS细胞株购自中国科学院上海生命科学研究院细胞资源中心;6只BALC/c雌性裸鼠购自中国科学院上海实验动物中心,许可证号为SCXK(沪)2016⁃2017,鼠龄8~10周,体重25~30 g,饲养于SPF级动物实验室中,自由饮水饮食,动物实验的操作经本院动物实验伦理委员会审核批准。
RPMI 1640培养基、胎牛血清、胰蛋白酶等细胞培养试剂购自美国Gibco公司;CCK⁃8试剂盒购自日本同仁化学;淋巴细胞分离培养基和Annexin V⁃FITC/PI试剂购自美国Sigma⁃Aldrich公司;重组人粒细胞⁃巨噬细胞集落刺激因子(rhG⁃CSF)、重组人白细胞介素(rhIL⁃4)、重组人干扰素⁃γ(rhIFN⁃γ)、重组人白细胞介素⁃2(rhIL⁃2)和重组人肿瘤坏死因子(rhTNF⁃a)均购自美国R&D Systems公司;PD⁃1和PD⁃L1抗体及相应HRP标记的第二抗体购自英国Abcam公司;RIPA裂解液购自上海碧云天生物技术有限公司;流式抗体(CD3、CD8、CD56、CD83和CD86)购自美国BD公司。
1.2 细胞培养
将HOS细胞冻存管放入37℃水浴中解冻,加入含有10%胎牛血清和1%青霉素链霉素的RPMI 1640完全培养基5 mL,置于37℃、5% CO2的恒温无菌培养箱中培养,每日观察细胞状态,待细胞密度>80%后,用胰蛋白酶消化传代或种板培养。
1.3 DC和CIK的分离和共培养
根据本院伦理委员会批准的研究方案,并参考文献[8],采用Ficoll密度梯度离心法从健康志愿者的外周静脉血中分离外周血单个核细胞(peripheral blood monoculear cell,PBMC),并以5×106/mL的密度接种至RPMI 1640完全培养基中培养2 h后,收集贴壁细胞和非贴壁细胞,分别分离DC和CIK。DC的分离:向贴壁细胞中加入1 000 U/mL rhG⁃CSF和500 U/mL rhIL⁃4进行培养,每3 d更换培养基和细胞因子;于第6天向DC中加入1 000 U/mL的rhTNF⁃α继续培养2 d,诱导成熟。CIK的分离:将非贴壁细胞培养于含1 000 U/mL rhIFN⁃γ的RPMI 1640完全培养基中,孵育24 h后,加入50 ng/mL小鼠抗人CD3单克隆抗体和1 000 U/mL rhIL⁃2,每3 d补充细胞因子,传代培养8 d。
将上述步骤分离得到的DC和CIK常规培养9 d后,消化、计数并按照5∶1的比例混合培养7 d。分别收集当天(0 d)和第7天培养的DC、CIK及共同培养的DC⁃CIK。用PBS洗涤、离心后,将DC与FITC结合的相应抗体(CD83和CD86)、CIK与FITC结合的相应抗体(CD3、CD8和 CD56)置于室温下反应 20 min,再用PBS洗涤2次后,采用流式细胞术检测DC和CIK的免疫表型。
1.4 流式细胞术检测DC和CIK的免疫表型
分别收集DC和CIK,离心,去除上清后加入溶于PBS的FITC结合相应抗体(DC:CD83和CD86;CIK:CD3、CD8和CD56),吹打混匀后于室温下静置20 min,取1 mL样品上流式细胞仪检测。
1.5 CCK⁃8检测骨肉瘤HOS细胞增殖能力
HOS细胞以1×105/孔的密度接种于6孔板,正常培养24 h后,以相同密度将DC⁃CIK配入Transwell 6孔板。将共培养的DC⁃CIK与HOS细胞在Transwell平板上组装,其中单纯培养的HOS细胞为正常对照组(HOS组),以共培养的DC⁃CIK+HOS细胞为实验组(DC⁃CIK+HOS组)。分别于共培养24 h、48 h和72 h后取出6孔板,用胰蛋白酶消化,将细胞置于96孔板(3 000/孔),加入CCK⁃8溶液(10 μL/孔),继续培养1 h,用酶标仪测定450 nm波长处的吸光度(A)。
1.6 流式细胞术检测骨肉瘤HOS细胞凋亡能力
DC⁃CIK与HOS细胞共培养后,使用预冷的PBS洗涤细胞2次,取1×105个细胞重新悬浮在100 μL 1×结合缓冲液中,然后在室温下加入5 μL Annexin V和5 μL PI,避光染色 10 min,再加入 400 μL 1×结合缓冲液,上流式细胞仪进行定量分析。
1.7 Western blot法检测PD⁃1/PD⁃L1信号通路相关蛋白的表达
各组细胞加入RIPA裂解液,冰板上裂解5 min,收集细胞裂解液至离心管中,以12 000 g的速度离心5 min,收集上清液,用BCA试剂盒测定蛋白浓度,并用上样缓冲液调整蛋白浓度,使每组蛋白浓度一致。各组蛋白煮沸5 min后,取10 μg蛋白进行电泳,转至PVDF膜,加入封闭液封闭1 h,PBS清洗后加入抗PD⁃1或PD⁃L1的第一抗体,4℃孵育过夜;次日用PBS溶液洗膜,加入HRP标记的相应第二抗体,室温反应1 h,再次洗膜,使用化学发光法检测蛋白的表达。用Image J软件分析条带图片,以GAPDH为内参,计算目标蛋白与内参蛋白的吸光度比值。
1.8 构建裸鼠移植瘤模型
裸鼠左右腋窝或左右腹股沟每次注射0.2 mL含HOS细胞的PBS溶液(细胞密度为1×106/mL),第2天和第3天分别原位复种1次,构建裸鼠皮下移植瘤模型。待肿瘤生长14 d后,将裸鼠随机分为HOS+DC⁃CIK组和HOS组,每组3只。HOS组不作任何处理,HOS+DC⁃CIK组注射DC⁃CIK细胞(1×106个细胞),每次在肿瘤组织周围的4个位点分别注射0.05 mL含DC⁃CIK混合物的PBS溶液(细胞密度为1×106/mL)。第14天采用二氧化碳安乐死,剥离肿瘤,用卡尺测量并计算各组裸鼠的皮下肿瘤体积。
1.9 统计学方法
采用GraphPad Prism 6.0对实验数据进行统计分析,计量资料用均数±标准差(x±s)表示,两组间均数比较采用Student′st检验;多组间均数比较采用单因素方差分析,组间差异有统计学意义时进行Bonferroni检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 DC和CIK免疫表型的鉴定
流式细胞术检测结果显示,经细胞因子诱导DC分化成熟后,CD83+和CD86+阳性细胞比例均高于未成熟的DC(P=0.009,0.006),见图1A;DC⁃CIK共培养后,CD3+CD8+和CD3+CD56+的阳性细胞比例均高于CIK单独培养组(P=0.004,0.004),见图1B。

图1 流式细胞术检测DC和CIK的免疫表型Fig.1 The immunophenotype of DC and CIK detected by flow cytometry
2.2 DC⁃CIK共培养对人骨肉瘤HOS细胞增殖和凋亡的影响
CCK⁃8检测结果显示,与DC⁃CIK共培养后,HOS细胞生长速度受抑制,且呈时间依赖性。培养48 h和72 h后,HOS+DC⁃CIK组细胞增殖能力均较HOS组降低(P=0.036,0.002),见图2A。流式细胞术检测结果显示,与DC⁃CIK共培养48 h后,HOS细胞凋亡率高于HOS组[(9.16±0.88)%vs(3.87±0.19)%,P=0.007],见图2B。

图2 DC⁃CIK共培养对人骨肉瘤HOS细胞增殖的影响Fig.2 The effect of DC⁃CIK on the proliferation and apoptosis of human osteosarcoma HOS cells
2.3 DC⁃CIK共培养对PD⁃1/PD⁃L1信号通路的影响
Western blot检测结果显示,与DC组和CIK组相比,DC⁃CIK共培养体系中PD⁃1的表达水平明显下调(P=0.004,0.007),见图3A;与DC⁃CIK共培养后,HOS细胞中PD⁃L1的表达水平也较HOS单独培养组明显下调(P=0.006),见图3B。
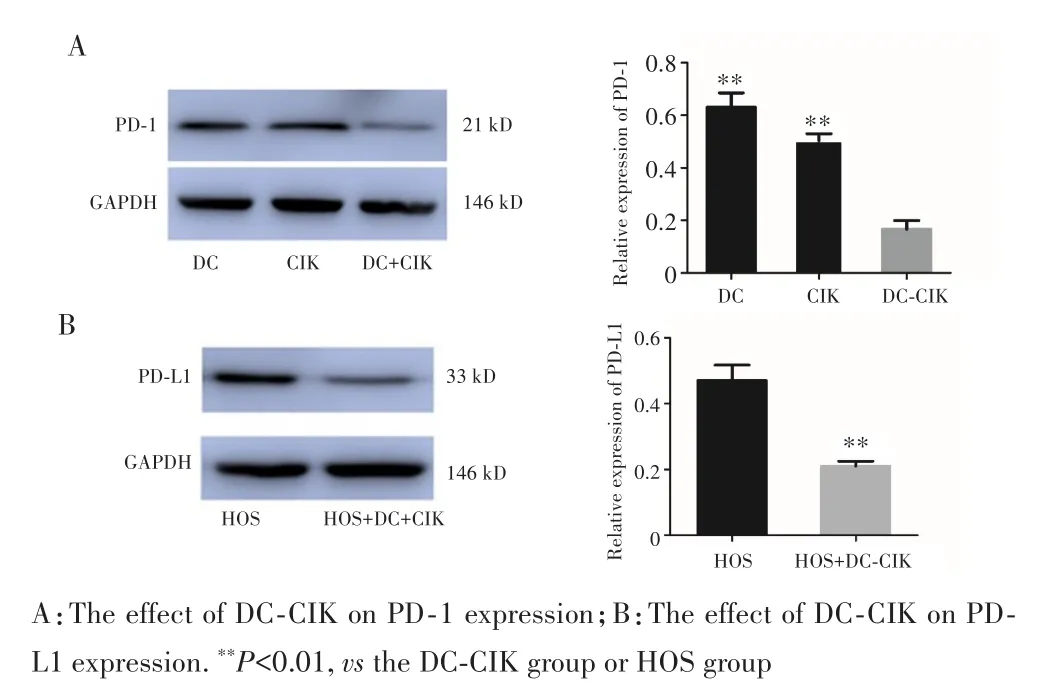
图3 DC⁃CIK共培养对PD⁃1和PD⁃L1表达的影响Fig.3 The effect of DC⁃CIK on PD⁃1 and PD⁃L1 expression
2.4 DC⁃CIK共培养对骨肉瘤HOS细胞诱导裸鼠皮下肿瘤的影响
所有裸鼠均存活,成瘤率为100%。接种14 d后,HOS+DC⁃CIK组裸鼠注射DC⁃CIK,结果显示,皮下肿瘤平均体积明显小于HOS组[(656.1±39.5)mm3vs(938.3±83.1)mm3,P=0.008],见图4。

图4 DC⁃CIK对裸鼠皮下肿瘤生长的影响Fig.4 The effect of DC⁃CIK on subcutaneous tumor in nude mice
3 讨论
肿瘤生物治疗是继手术、放疗和化疗后的第四种治疗选择,具有广阔的临床应用前景[12⁃13]。目前临床上应用的免疫细胞治疗主要包括肿瘤浸润性淋巴细胞、淋巴因子激活的杀伤细胞和CD3单克隆抗体激活的杀伤细胞等[14⁃15]。DC具有抗原呈递能力,是治疗性肿瘤疫苗开发的潜在载体[16]。研究显示采用rhIFN⁃γ、rhIL⁃2和CD单克隆抗体刺激人PBMC可以获得CIK,并表达T细胞和自然杀伤细胞(natural kill⁃er cells,NK)的表面标志物[17]。本研究使用这一细胞分离培养技术,在体外成功分离并共培养DC⁃CIK,为后续实验奠定基础。
CIK是一种T细胞亚群,具有NK细胞特性,DC和CIK在体内外对多种癌细胞具有较好的细胞杀伤性,已成功应用于多种癌症患者。此外,CIK能主动攻击表达CD3/CD56的肿瘤细胞,与DC共培养时,杀伤效果更显著[18]。例如,DC⁃CIK在体外培养中能对人食管癌ECA⁃109细胞实现有效地杀伤,在荷瘤小鼠模型中,DC⁃CIK也能显著抑制肿瘤生长[19]。CIK与DC联合应用在非小细胞肺癌、肝细胞癌和卵巢癌等多种肿瘤中也展现了较好的杀伤效果[20⁃22]。本研究首先在体外分离并共培养了DC⁃CIK,并在体外和体内研究中证实其对人骨肉瘤HOS细胞具有较强的杀伤能力,不仅能显著抑制HOS细胞的增殖活性,增加细胞凋亡比例,同时在裸鼠移植瘤模型中也观察到DC⁃CIK能显著抑制肿瘤生长。类似地,有研究报道,肝癌干细胞抗原负载的DC可激活针对含抗原细胞的特异性内源性细胞毒性T细胞反应,从而在裸鼠模型中有效抑制肿瘤生长[23]。
阻断免疫检查点相关信号通路是逆转免疫抑制和诱导免疫杀伤的抗癌研究热点之一。PD⁃1/PD⁃L1信号通路能抑制效应T淋巴细胞活化,从而诱导肿瘤免疫逃逸[24]。PD⁃1/PD⁃L1作为重要的免疫检查点蛋白,被认为是肿瘤诱导免疫抑制的关键机制。最近研究[25⁃26]发现,抗PD⁃1治疗能促进DC⁃CIK增殖分化为CD3+CD56+NKT细胞和CD3+CD8+CTL细胞,同时显著上调DC⁃CIK中IFN⁃γ、TNF⁃α等免疫刺激性细胞因子分泌,从而下调免疫抑制性细胞因子IL⁃10分泌,此外抗PD⁃1也能促进DC⁃CIK细胞的早期活化。这些研究结果表明,抗PD⁃1在DC⁃CIK增殖、分化和早期激活中发挥了关键的调控作用。为检验DC⁃CIK共培养体系中PD⁃1/PD⁃L1信号通路的改变,本研究检测DC⁃CIK共培养细胞中PD⁃1的表达以及HOS细胞中PD⁃L1的表达,结果发现,在DC⁃CIK共培养体系中,PD⁃1表达量显著下降;DC⁃CIK与HOS细胞共培养时PD⁃L1表达被显著抑制,提示PD⁃1/PD⁃L1可能是DC⁃CIK发挥抗肿瘤作用的关键通路。
本研究证实,DC⁃CIK共培养对人骨肉瘤HOS细胞具有较强的杀伤能力,能抑制HOS细胞增殖并诱导细胞凋亡,且DC⁃CIK共培养可能通过靶向调控PD⁃1/PD⁃L1信号通路发挥作用。本研究结果为骨肉瘤的免疫治疗提供了实验证据和潜在的治疗靶点。
