沉默环状RNAhsa_circ_0000591表达对肝癌细胞增殖及迁移的影响
2021-07-20刘新宇罗涛蒋志俊刘昊天黎乐群
刘新宇 罗涛 蒋志俊 刘昊天 黎乐群
肝细胞癌(hepatocellular carcinoma,HCC)是全球范围内癌症相关死亡的主要原因之一,占全部原发性肝癌的80%~90%[1]。目前国际主流的治疗方式为肝切除、肝移植或经皮局部消融,并以经肝动脉化疗栓塞(TACE)、放疗、全身药物治疗等手段配合治疗,但术后1年内复发率仍接近40%,5年生存率仅为15%~40%[2]。探索肝癌发生发展的分子机制,寻找新的早期诊断标志物及预后预测的分子靶点对提高患者生存期具有重要意义。环状RNA是具有共价键闭环结构的特殊非编码 RNA[3⁃4],在转录及转录后水平具有重要的基因表达调控作用[5]。研究表明,环状RNA在肿瘤发生发展中发挥着重要的调控作用,参与肿瘤发生、侵袭和迁移等恶性生物学行为[6⁃8]。本课题组前期根据HCC术后切除组织的高通量测序结果,筛选出一组包括57个差异表达的环状RNA与HCC患者不良预后显著相关,查阅文献尚未见hsa_circ_0000591在HCC中的报道。因此,本研究检测hsa_circ_0000591在HCC组织及肝癌细胞系中的表达,同时构建hsa_circ_0000591沉默的肝癌细胞模型,探讨其对肝癌细胞增殖和迁移能力的影响,为阐明hsa_circ_0000591在肝癌中的作用提供实验依据。
1 材料与方法
1.1 主要材料及试剂
1.1.1 临床样本 收集2014—2018年于广西医科大学附属肿瘤医院接受肝癌切除术的84例HCC患者癌组织及其相应癌旁正常组织标本。纳入标准:经组织病理学检查诊断为HCC,术前未行放疗、化疗或靶向药物治疗等抗肿瘤治疗。本研究方案获广西医科大学附属肿瘤医院伦理委员会批准,患者或家属知情同意。通过门诊或电话随访,术后每3个月随访1次,随访内容包括肿瘤复发或死亡,随访时间截至2021年2月1日。总生存期定义为自确诊之日至死亡或随访截止的时间。
1.1.2 主要材料及试剂 人肝癌细胞系Li⁃7、HepG2、Hep3B、Huh7及人正常肝细胞系HL⁃7702均购自上海研究院生命科学细胞资源中心或美国ATCC细胞库。hsa_circ_0000591沉默慢病毒(siRNA)及相应的阴性对照组慢病毒(NC)由上海吉凯基因科技有限公司构建。胎牛血清、DMEM培养基购自Gibco公司,Trizol购自美国Invitrogen公司,PrimeScript RT reagent Kit with gDNA Eraser购自日本Takara公司,荧光定量试剂盒 FastStart Universal SYBR Green Master(ROX)购自德国Roche公司,CCK⁃8试剂购自碧云天公司,Transwell小室、Transwell细胞培养板及基质胶购自Corning公司。
1.2 qRT⁃PCR检测hsa_circ_0000591 mRNA的表达水平
使用TRIzol法提取HCC组织及肝癌细胞系中的总RNA,根据Takara逆转录试剂盒说明书的方法将总RNA逆转录为cDNA,并进行PCR扩增。PCR反应条件:95℃,10 min变性;57 ℃,10 s退火;60 ℃,10 s延伸;共40个循环。反应体系:5 μL的2×SYBR Green Master(ROX),上下游引物各0.3 μL,cDNA模板1 μL,RNase Free dH2O补至10 μL。反应序列:GAPDH正向引物序列为5′⁃GGAGCCAAAAGGGTCATCATCTC⁃3′,反向序列为 5′⁃GAGGGGCCATCCACAGTCTTCT⁃3′;hsa_circ_0000591正向引物序列为5′⁃CATGGATACT⁃GATTCAGCACTT⁃3′,反向序列为 5′⁃ACTGTTCCAC⁃CATCTTGATTAG⁃3′。以GAPDH为内参,使用2-△△Ct法分析目的基因的相对表达量。
1.3 细胞培养和感染
所有细胞接种于含10%胎牛血清、1%双抗的DMEM培养基中,置于37℃、5% CO2细胞培养箱中培养。Hep3B细胞使用胰酶消化后接种至6孔板,待细胞贴壁生长状态良好时感染。感染前6 h更换培养基,然后用稀释后的慢病毒与增强感染液混合。参照吉凯公司稀释后的慢病毒使用说明书分别将hsa_circ_0000591沉默慢病毒及相应阴性对照组慢病毒感染Hep3B细胞,分别记为siRNA组和NC组,6 h后替换常规培养基继续培养。慢病毒感染48~72 h后,更换含嘌呤霉素(终末浓度为2 μg/mL)培养基,继续培养2周,然后用qRT⁃PCR实验检测感染效率。
1.4 CCK⁃8法检测肝癌Hep3B细胞增殖能力
将转染后的Hep3B细胞消化后,吹打混匀、计数,接种至96孔板,每个样本设置5个重复孔,每孔分别加入100μL细胞数为1×104个的细胞悬液。分别于培养0 h、24 h、48 h、72 h时加入10 μL CCK⁃8试剂,继续孵育2 h,用酶标仪检测450 nm波长处的光密度(OD)值。
1.5 平板克隆形成实验检测肝癌Hep3B细胞增殖能力
用500 μL 0.25%胰蛋白酶覆盖感染后的Hep3B细胞表面,消化至细胞变圆脱落后,加入5 mL全培养液终止消化,制成细胞悬液,移至15 mL离心管,1 000 r/min离心5 min,弃上清;加入3 mL完全培养液,按每孔200个细胞的密度接种至6孔板,培养2周至细胞集落形成。用4%多聚甲醛固定30 min,PBS洗涤2次,1%结晶紫染色20 min,观察细胞集落形成情况并计算细胞克隆形成率。细胞克隆形成率(%)=(细胞克隆数量/接种细胞数量)×100%。
1.6 划痕实验检测肝癌Hep3B细胞迁移能力
在6孔板后面均匀划横线,并向每孔板添加50 μL纤维连接蛋白,置于4℃冰箱中冷藏过夜。将转染后的Hep3B细胞制成细胞悬液(1×106/mL),混匀后接种于6孔培养板,置于37℃、5% CO2培养箱中常规培养。用200 μL枪头在细胞板上划痕,PBS溶液冲洗3次,清除被划下的贴壁细胞,然后加入无血清培养基培养,置于37℃、5% CO2培养箱继续培养。分别于划痕后 0 h、6 h、24 h、48 h时取样,拍照记录,用ImagePro⁃Plus 6.0软件测量同一时间点上各组细胞8个任意位置的划痕宽度,计算细胞迁移率。细胞迁移率=(1-其他时间点距离/0 h距离)×100%。
1.7 Transwell小室实验检测肝癌Hep3B细胞迁移和侵袭能力
细胞迁移实验:实验前12 h换成无血清培养基,饥饿细胞过夜。胰蛋白酶消化细胞,1 000 r/min离心5 min,弃废液,用无血清培养基将下部细胞沉淀重悬,密度调节为2.5×105/mL。将200 μL细胞悬液接种于Transwell上室,下室加入600 μL包含10%胎牛血清的培养基,置于37℃,5% CO2细胞培养箱培养24 h后终止培养,弃培养基,PBS溶液清洗后用棉球轻轻擦拭上室,加入甲醛,固定30 min。用0.1%结晶紫溶液染色30 min,然后用300 μL 30%醋酸洗脱小室底面的结晶紫,各孔取100 μL加入96孔板,用酶标仪读取590 nm波长处的OD值。细胞侵袭实验中,首先将稀释好的100 μL基质胶均匀铺于上层小室,室温固化30 min,其他实验步骤同迁移实验。
1.8 统计学方法
采用SPSS 22.0(Chicago,IL,USA)统计软件对实验数据进行统计分析,并采用GraphPad Prism 5.0(La Jolla,CA,USA))软件绘制统计图像。计量资料以均数±标准差(x±s)表示,癌组织与癌旁组织中hsa_circ_0000591表达水平的比较采用配对样本t检验;非配对设计两组间均数比较采用独立样本t检验,多组间比较采用单因素方差分析,若组间差异有统计学意义,进一步多重比较采用Bonferroni检验;采用Kaplan⁃Meier法计算生存率,组间比较采用 Log⁃rank检验。以双侧P<0.05为差异有统计学意义。
2 结果
2.1 hsa_circ_0000591的鉴定
针对hsa_circ_0000591分别设计内扩型引物(Convergent primer)和外扩型引物(Divergent primer),提取HepG2细胞的gDNA和RNA,将RNA逆转录为cDNA,提取gDNA和cDNA后分别用两种引物进行扩增,结果显示内扩型引物可以在cDNA及gDNA中扩增出条带,外扩型引物只能在gDNA中扩增出条带,见图1A。
对扩增产物进行Sanger测序,比对是否与剪切位点序列一致。结果显示,3′端的GTAAGT与5′端的GATGGG相连,证实hsa_circ_0000591来源于chr15:41961026⁃41962156反向剪切形成的环状RNA,见图1B。将HepG2细胞核质分离后,qRT⁃PCR检测结果显示,hsa_circ_0000591主要位于细胞质内,见图1C。
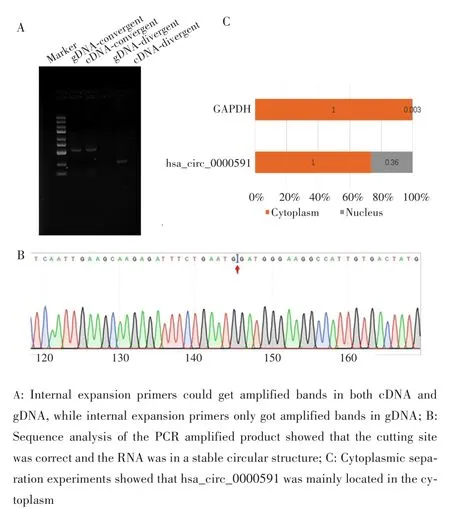
图1 环状RNA hsa_circ_0000591的鉴定Fig.1 Identification of circular RNA hsa_circ_0000591
2.2 hsa_circ_0000591在HCC组织中的表达及其对预后的影响
qRT⁃PCR检测结果显示,hsa_circ_0000591在HCC组织中的表达水平高于癌旁组织(t=2.466,P<0.001),见图2A。以hsa_circ_0000591表达中位数为分界,分为 hsa_circ_0000591高表达组(n=42)和 hsa_circ_0000591低表达组(n=42)。84例HCC患者至随访结束存活48例,5年总生存率为57.14%。高表达患者术后5年总生存率为47.2%,低表达患者为69.1%;两组患者生存曲线比较差异有统计学意义(χ2=9.812,P=0.002),见图2B。
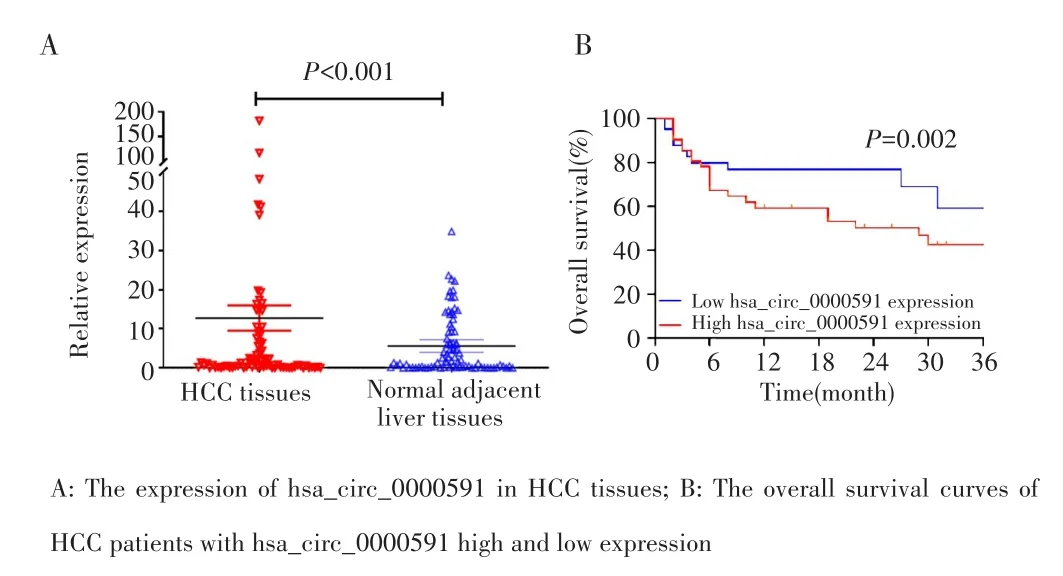
图2 hsa_circ_0000591在HCC组织中的表达及其对预后的影响Fig.2 Expression of hsa_circ_0000591 in HCC tissues and its influ⁃ence on prognosis
2.3 hsa_circ_0000591在肝癌细胞系中的表达及沉默效果
qRT⁃PCR检测结果显示,hsa_circ_0000591在肝癌细胞系Li⁃7、HepG2、Hep3B、Huh7及人正常肝细胞系HL⁃7702中的表达差异有统计学意义(F=2 967.884,P=0.012),其中在Hep3B细胞中的表达量高于其余肝癌细胞系及正常肝细胞系HL⁃7702(均P<0.05),见图3A。经过嘌呤霉素筛选2周后,用qRT⁃PCR法检测NC组和siRNA组hsa_circ_0000591的表达水平,结果显示,siRNA组Hep3B细胞中hsa_circ_0000591表达水平高于NC组(12.19±1.69vs1.14±0.37,t=8.190,P=0.024),见图3B。表明成功建立沉默hsa_circ_0000591的Hep3B细胞株。
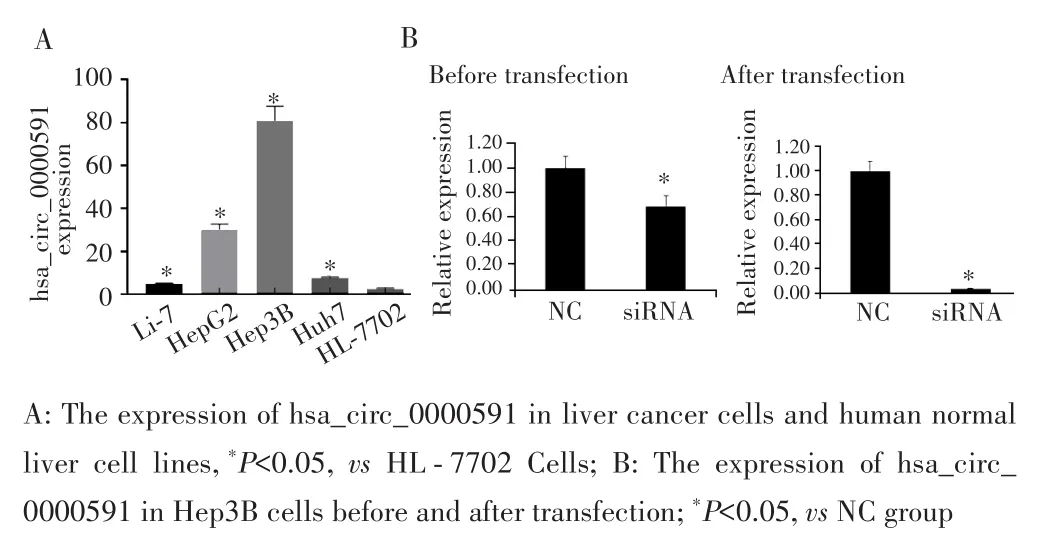
图3 qRT⁃PCR检测hsa_circ_000059在肝癌细胞系中的表达及沉默效果Fig.3 Expression and silencing effect of hsa_circ_000059 in liver cancer cell lines detected by qRT⁃PCR
2.4 沉默hsa_circ_0000591对肝癌Hep3B细胞增殖的影响
CCK⁃8实验结果显示,感染24 h、48 h、72 h时后,siRNA组Hep3B细胞增殖能力较NC组降低(均P<0.01),见图4A。平板克隆形成实验结果显示,与NC组比较,siRNA组Hep3B细胞克隆形成数减少(t=24.568,P=0.002),见图4B。
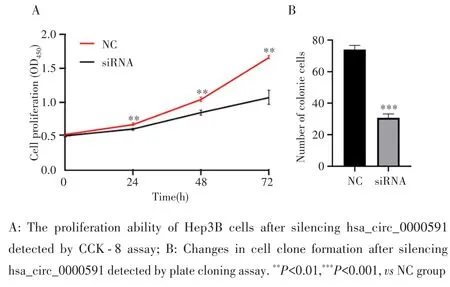
图4 沉默hsa_circ_0000591对Hep3B细胞增殖的影响Fig.4 Effect of silencing hsa_circ_0000591 on the proliferation of Hep3B cells
2.5 沉默hsa_circ_0000591对肝癌Hep3B细胞迁移和侵袭的影响
细胞划痕实验结果显示,24 h、48 h、72h时,siRNA组细胞迁移数目均较NC组少(均P<0.05),见图5。Transwell实验结果显示,siRNA组细胞侵袭和迁移数目均较NC组少(均P<0.05)。见图6。

图5 沉默hsa_circ_0000591对Hep3B细胞迁移的影响Fig.5 Effect of silencing hsa_circ_0000591 on the migration of Hep3B cells
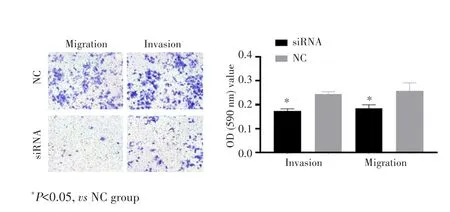
图6 沉默hsa_circ_0000591对Hep3B细胞侵袭和迁移的影响Fig.6 Effect of silencing hsa_circ_0000591 on the migration and invation of Hep3B cells
3 讨论
肝癌的发病机制涉及诸多关键信号途径[9],环状RNA作为非编码RNA家族中的一员,与线性RNA不同,环状RNA由于具有闭合环路结构,不具备5′帽子和3′尾巴结构,具有保守、稳定的结构特征[10]。环状RNA生物功能包括作为microRNA海绵、调节基因剪接和转录、作为RNA结合蛋白海绵和调节蛋白质翻译等[11⁃15]。越来越多的证据表明,环状 RNA 具有重要的生物学意义,在肿瘤细胞增殖、迁移、侵袭等发挥重要的调控作用[16⁃17]。目前多项研究证明环状RNA异常表达可以促进或抑制肝癌的发生与进展。例如,FAN等[18]研究发现circARHGAP12在鼻咽癌中作为促癌基因发挥作用,在鼻咽癌组织和细胞系中circARHGAP12表达上调,并促进鼻咽癌细胞迁移和侵袭。而LIU等[19]报道,在HCC组织中circRNA⁃5692表达下调,过表达circRNA⁃5692可抑制HCC细胞生长,说明circRNA⁃5692作为抑癌基因发挥作用。也有研究显示环状RNA在HCC中充当促癌基因,如HUANG等[20]报道hsa_circRNA_104348在HCC组织和细胞中均上调,并促进细胞增殖、迁移和侵袭,而抑制细胞凋亡。
基于本课题组前期对HCC术后切除组织的测序的结果,本研究选择在肝癌中表达差异较明显的hsa_circ_0000591作为研究对象,首先分析hsa_circ_0000591在肝癌组织中的表达及对患者预后的影响,结果发现hsa_circ_0000591在肝癌组织和细胞系中高表达,且高表达组患者的总生存率较低,这与前期测序预测方向一致。为进一步阐明hsa_circ_0000591在肝癌恶性生物学行为中的作用,本研究建立沉默hsa_circ_0000591的Hep3B细胞模型,结果发现沉默hsa_circ_0000591可以显著抑制肝癌细胞在体外的增殖、迁移及侵袭能力,并初步推测hsa_circ_0000591可能与miRNA结合并通过经典的circRNA⁃miRNA⁃mRNA轴发挥转录后调控作用。下一步将通过生物信息学分析,利用双荧光素酶等实验筛选和验证与hsa_circ_0000591结合的miRNA,探索miRNA下游作用的mRNA,为肝癌潜在的分子机制研究提供实验依据。
综上所述,hsa_circ_0000591在肝癌组织及细胞系中表达上调,沉默hsa_circ_0000591可抑制Hep3B细胞增殖、迁移和侵袭。hsa_circ_0000591可能是参与肝癌恶性生物学功能的重要分子,有望成为肝癌预后预测指标以及治疗靶点。但本研究仅针对一个细胞系,且未验证过表达hsa_circ_0000591的作用,因此hsa_circ_0000591在肝癌发生发展中确切的作用及其分子机制仍需后续深入研究。
