小麦TraesCS7A02G543300 基因的克隆及生物信息学分析
2021-07-20黄文芳王雪琳任豫超史敏莉贺立恒
杨 茜,黄文芳,王雪琳,任豫超,史敏莉,贺立恒
(山西农业大学农学院,山西太谷030801)
小麦(Triticum aestivumL.)是世界三大粮食作物之一,其种植面积在谷物类作物中位居首位,是全球2.5 亿余人的主粮[1]。小麦还为人类提供了约21%的膳食热量和20%的蛋白营养,在保障粮食安全方面发挥着突出作用[1-3]。
气孔作为植物水分排出和二氧化碳进入的主要通道,其状态强烈影响着蒸腾作用和光合作用的生理过程[4]。在拟南芥中,表皮成熟的气孔是由表皮原细胞(Protodermal cell,PC)经一系列的分裂和分化活动发育而来的,3 种紧密相关的basic helixloop-helix(bHLH)家族蛋白 SPCH、MUTE 和 FAMA介导了这一过程[5]。其中,SPCH 是气孔发育起始的关键因子,控制着PC 向拟分生组织母细胞(Meristemoid mother cell,MMC)的分化和 MMC 向拟分生细胞(Meristemoid cell,MC)的分裂[6];MUTE 控制着 MC向保卫母细胞(Guard mother cells,GMCs)的分裂[7];FAMA 控制着 GMC 向成熟保卫细胞(GC)的转变[8]。研究发现,ICE1/SCREAM(SCRM)和 SCRM2 直接与SPCH、FAMA 和MUTE 相互结合形成二聚体,并影响其功能发挥[5]。此外,为了协调发育中的气孔和表皮细胞之间的信号,防止气孔彼此相邻形成,许多胞外质膜结合蛋白也是必不可少的[9],包括表皮模式因子EPF 以及EPF-like 信号肽、Leu-rich repeat ERECTA 家族受体激酶以及TOO MANY MOUTHS(TMM)[10-11]。
单子叶植物和双子叶植物的气孔形态有着较大的差异,其中,单子叶植物的气孔成排排列,呈哑铃型;双子叶植物的气孔在叶片上不规则排列,呈肾型[12],尽管二者在气孔形态上存在较大的差异,但陆生植物气孔形成的基本机制是相对保守的[13]。在水稻中,OsSPCH、OsMUTE、OsFAMA和OsICE1是成熟气孔形成所必需的,其基本功能与拟南芥同源基因类似[14-15]。在现存最古老的气孔谱系植物苔藓中,成熟气孔的形成同样需要拟南芥中SPCH、MUTE、FAMA和ICE/SCRM的同源基因PpSMF1和PpSCRM1的介导[16-17]。在小麦近缘种二穗短柄草(Brachypodium distachyon)中,气孔发育的起始同样是由BdISCRM、BdSPCH1和BdSPCH2组成的气孔发育模块调控的[18]。
ICE1/SCRM 与 SPCH、MUTE 和 FAMA 的伙伴关系对于单子叶植物气孔的启动和成熟是必不可少的,但它们在单子叶植物中的蛋白功能可能与拟南芥中略有不同[14,19]。例如,在禾本科植物二穗短柄草中,存在着ICE1 和SCRM2 功能的特异化,而在拟南芥中这些蛋白似乎是冗余的[12,14]。类似地,在二穗短柄草中也发生了新的SPCH 重复和新功能化[20],MUTE 对于二穗短柄草气孔的副卫细胞的形成具有决定性作用[18]。
中国农业科学院小麦基因资源课题组利用基因定位获得了1 个与小麦气孔密度相关的候选基因TraesCS7A02G543300。本研究利用生物信息学软件对小麦TraesCS7A02G543300基因的基本理化性质、蛋白质结构等进行分析,同时利用RT-qPCR分析小麦根、叶、茎在3 个时期的基因表达模式,旨在为进一步研究小麦TraesCS7A02G543300基因的功能和调控机制奠定基础。
1 材料和方法
1.1 试验材料
供试材料为普通小麦品种矮抗58。
1.2 试验方法
本试验于中国农业科学院国家小麦改良中心完成,采用盆栽法进行小麦植株的培养,分别于两叶一心期、拔节期和抽穗期收集健壮小麦根、茎、叶,并进行液氮速冻。
1.2.1TraesCS7A02G543300基因的克隆 使用北京庄盟公司的Plant Total RNA Kit(ZP405)提取小麦总RNA,使用EX RT kit(gDNAremover)(ZR108)试剂盒逆转录为cDNA。根据Ensembl Plants 登录的TraesCS7A02G543300基因序列,设计基因组特异引物(表1)。根据WANG 等[21]所述的方法进行PCR反应。PCR 产物经1.2%的琼脂糖凝胶电泳分离后,回收纯化并进行测序。

表1 用于基因克隆及表达分析的引物
1.2.2 TraesCS7A02G543300 蛋白的生物信息学分析 利用NCBI-ORF finder 工具获取基因的开放阅读框[22];用Expasy-ProtParam 进行蛋白质等电点、亲疏水性等基本的理化性质分析[23];用NLS Mapper 预测核定位信号[24];用Plant-mPLoc 预测蛋白质亚细胞定位[25];用 SignalP 4.0 预测蛋白的信号肽[26];用NetPhos 3.1 分析蛋白质序列潜在磷酸化位点[27];用NPS-SOPMA 和SWISS-MODEL 分别对蛋白质的二级结构和三级结构进行预测[28-29];利用DNAMAN 软件进行序列比对。
1.2.3TraesCS7A02G543300基因的表达分析 以1.2.1 获得的 cDNA 为模板,参考 WANG 等[30]所述的方法进行实时荧光定量 PCR(RT-qPCR)(TaTubulin为内参基因,引物序列如表1 所示)。相对表达量的计算参考文献[30]进行。采用SPSS 25.0软件进行差异显著性分析。
2 结果与分析
2.1 TraesCS7A02G543300 基因的克隆
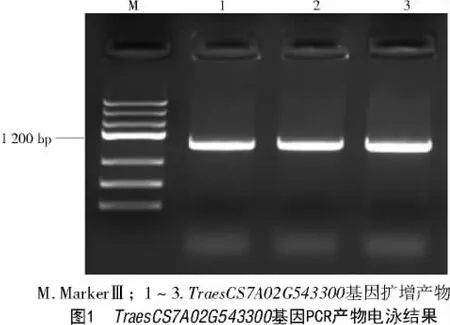
以1.2.1 得到的cDNA 为模板进行TraesCS7A02 G543300基因的扩增,电泳结果表明,在1 100 bp 左右有1 条明显的特异性条带(图1);测序结果表明,TraesCS7A02G543300基因的cDNA全长为1084bp;ORF 分析结果表明,该序列包含一个990 bp 的开放阅读框,编码329 个氨基酸。
2.2 TraesCS7A02G543300 蛋白的生物信息学分析
TraesCS7A02G543300 蛋白理化性质分析表明,该蛋白分子式为C1540H2447N435O476S25,分子质量为35.473 5 ku,理论等电点为5.1,亲水系数为-0.182,脂溶系数为73.98,不稳定系数是57.3(>40),预测该蛋白为稳定的酸性、亲水性蛋白。在氨基酸序列第47—57 位含有核定位信号序列PASRKKRVEGM,表明该蛋白定位于细胞核。SignalP 4.0 分析无信号肽,表明该蛋白不是分泌型蛋白。NetPhos 3.1 分析结果表明,该蛋白中有18 个氨基酸可能被磷酸化,其中,包含11 个丝氨酸、5 个苏氨酸和2 个酪氨酸。
通过NCBI 数据库对该蛋白进行了功能结构分析,结果表明,该蛋白包含1 个保守的碱性/螺旋-环- 螺旋(basic helix-loop-helix,bHLH)结构域。利用 BLAST 程序在 The Arabidopsis Information Re-source 数据库中进行比较分析,结果表明,与其相似度最高的3 个拟南芥蛋白分别为AtbHLH093(相似性 51.76%)、AtICE1/AtSCRM(相似性 31.61%)和AtSCRM2(相似性33.6%),这3 个蛋白同属于bHLH-LZs 亚家族,在拟南芥中参与了气孔的发育过程。氨基酸序列比对结果表明,TraesCS7A02G543300蛋白与拟南芥SPCH、FAMA、MUTE 的相似度较低,其氨基酸一致性分别为20.00%、11.81%和21.15%(图 2)。
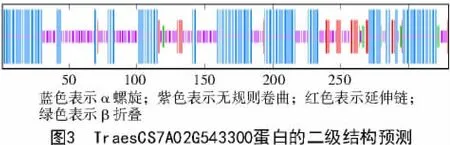
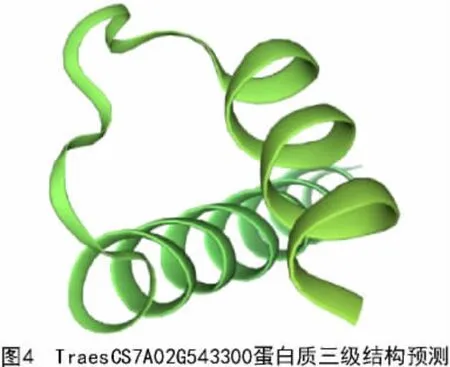
TraesCS7A02G543300 蛋白的二级结构预测结果如图3 所示,其主要由α- 螺旋和无规则卷曲组成,分别占比47.72%和40.73%;此外,N 端以α-螺旋的形式存在,C 端以延伸链的形式存在。以AtbHLH093 为模型蛋白对TraesCS7A02G543300 进行了三维结构的建模,预测结果如图4 所示,TraesCS7A02G543300 蛋白具有典型的螺旋- 环-螺旋(HLH)结构。
2.3 TraesCS7A02G543300 基因的表达分析
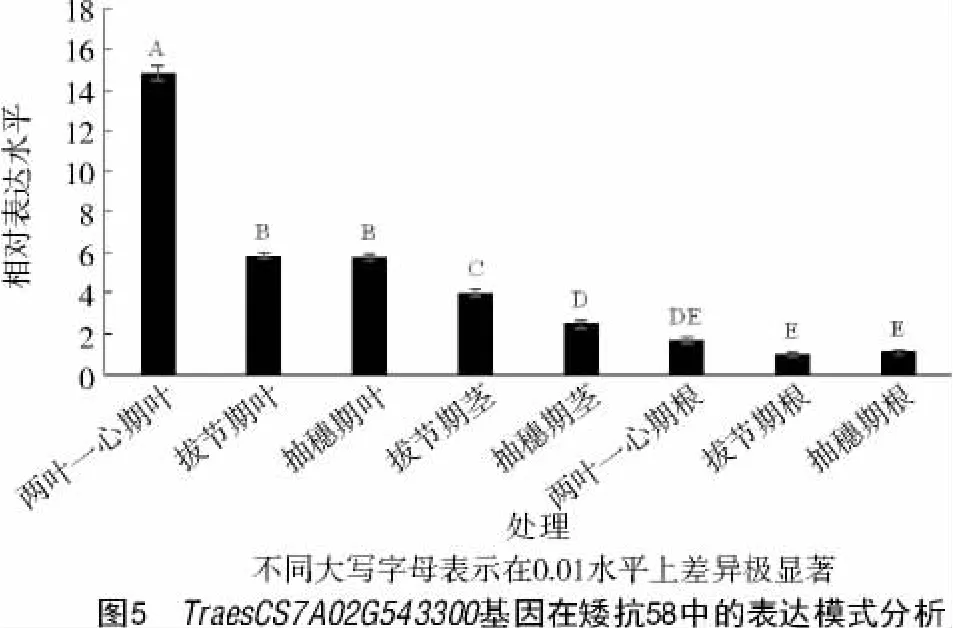
RT-qPCR 结果表明(图5),TraesCS7A02G543300基因在小麦叶中表达量极显著高于根和茎;且在两叶一心期的表达量极显著高于拔节期和抽穗期,预测TraesCS7A02G543300基因在小麦的生长发育前期发挥主要作用。
3 结论与讨论
为进一步了解TraesCS7A02G543300基因在小麦中的功能,本研究对TraesCS7A02G543300基因进行了生物信息学分析,并研究了TraesCS7A02G543300基因在矮抗58 不同组织及不同发育时期的表达特性。结果表明,TraesCS7A02G543300基因包含的完整开放阅读框长度为990 bp,编码了329 个氨基酸。TraesCS7A02G543300 蛋白的亚细胞定位被预测位于细胞核,这与其作为转录因子的功能是一致的。TraesCS7A02G543300 蛋白包含1 个保守的b HLH 结构域,属于 bHLH-LZs 亚家族,与拟南芥中的AtICE1/SCRM 高度同源,因此,TraesCS7A02G 543300 的功能可能与拟南芥AtICE1/SCRM 类似[5]。TraesCS7A02G543300基因在小麦叶中的表达量显著高于其他组织,在两叶一心期的表达量明显高于其他时期,这与ICE1/SCRM等气孔发育调控因子在拟南芥等植物中的表达特性一致[5,13]。这些结果为TraesCS7A02G543300基因在小麦叶片中参与气孔的发育过程奠定了理论基础。
前人研究表明,ICE1/SCRM 能与SPCH、FAMA和MUTE 相互作用并影响气孔的形成[6]。本研究对TraesCS7A02G543300 蛋白的基本理化性质进行了预测分析,但关于其蛋白功能的研究相对粗浅。接下来可以利用酵母杂交等验证TraesCS7A02G543300是否能与SPCH、FAMA 和MUTE 形成二聚体,从而研究TraesCS7A02G543300基因在小麦中的功能。除了参与气孔发育过程外,ICE1/SCRM 和SCRM2还能参与植物的逆境响应过程,过表达SCRM 能够增强水稻的耐逆性[31]。因此,下一步可分析TraesCS7A02G543300基因在逆境胁迫下的表达量,从而验证TraesCS7A02G543300基因是否参与了小麦的逆境响应过程。但由于单子叶植物气孔结构及气孔调控机制的差异,TraesCS7A02G543300基因的功能在小麦中是否有功能特化等还需进一步验证。
