茄子衰老叶质体小球降解途径的观察
2021-07-19陈雯新李萌孙悦宸毛新月韩秋爽刘林张桂芝
陈雯新 李萌 孙悦宸 毛新月 韩秋爽 刘林 张桂芝
摘 要:采用透射电子显微技术对茄子幼叶和衰老叶的质体小球进行了比较,并着重对衰老叶质体小球的降解途径进行了观察。结果表明,茄子幼叶质体小球小,电子染色深,老叶质体小球大,电子染色浅;老叶中质体小球发生降解,降解发生在叶绿体内或液泡内,显示降解遵循叶绿体途径或液泡途径。在叶绿体途径中,降解不是从质体小球整个表面同时开始,而是从质体小球表面某一点开始,降解区域电子透明,结果使质体小球呈现为一侧凸起而另一侧凹陷。在液泡途径中,液泡中的质体小球由基质包围着,显示质体小球并不单独进入液泡,而是连同部分叶绿体基质一起进入液泡。
关键词:茄子;叶衰老;质体小球降解;降解途径
中图分类号:S641.1 文献标志码:A 文章编号:1673-2871(2021)05-109-04
Observation on the degradation pathways of plastoglobules in senescent eggplant leaves
CHEN Wenxin, LI Meng, SUN Yuechen, MAO Xinyue, HAN Qiushuang, LIU Lin, ZHANG Guizhi
(College of Pharmacy, Linyi University, Linyi 276005, Shandong, China)
Abstract: Plastoglobules in young and senescent eggplant leaves were observed comparatively and plastoglobule degradation pathways in senescent leaves were investigated, by means of transmission electron microscopy. Plastoglobules were less in number and size and more strongly stained in young leaves than in senescent leaves. Plastoglobules in senescent leaves underwent degradation inside either chloroplasts or vacuoles. Two pathways were demonstrated, chloroplast associated pathway and vacuolar pathway. During the chloroplast associated pathway, chloroplasts are the site for degradation. The degradation was found to happen from one side of the plastoglobule rather than the whole surface of the plastoglobule. As a result, the plastoglobule became convex on the intact side, but concave on the degrading side. During the vacuolar pathway, where vacuoles are the site for the degradation, plastoglobules were showed to be transported into the vacuole together with a portion of chloroplast stroma that surrounded the plastoglobules.
Key words: Eggplant; Leaf senescence; Plastoglobule degradation; Degradation pathway
電子显微镜刚开始用于细胞研究时就发现,叶绿体、有色体以及白色体等不同类型质体中都存在一种嗜锇小球体[1],大小不等,直径从30 nm到5 μm,由于小球体的脂含量非常高,因此称为质体小球[1-2]。后来进一步研究表明,质体小球是由半乳糖脂单分子层膜包围甘油三酯所形成的细胞器,膜上结合一层蛋白质[3-5],甘油三酯中溶解有胡萝卜素、类胡萝卜素和维生素E[4-6]。质体小球不仅发生在维管植物,也发生于藓类植物[7]和藻类植物[3,5,8]。质体小球的大小、数量和嗜锇性因植物种类、质体类型和发育阶段而变化,这些特点显示出质体小球具有多方面生物学作用。最主要的作用是作为中性脂和胡萝卜素的贮藏场所,其次, 质体小球参与类囊体的发育及解体,体现在诸多方面,例如,在白色体中,质体小球多则类囊体少,类囊体多而质体小球少[9];叶绿体衰老时类囊体膜解体,质体小球数量增多或体积增大[1,10-11];类囊体发育相关基因的突变体中,类囊体较少而质体小球明显增多[12-13]。叶绿体转化成有色体之后,出现了类胡萝卜素的微纤丝,成为有色体的重要特征,这些类胡萝卜素微纤丝就来源于质体小球[14-15],显然质体小球在叶绿体向有色体转化以及类胡萝卜素微纤丝形成过程中起作用[16]。
叶衰老是叶发育的最后阶段,是细胞组分有序降解、降解产物作为养分向植株生长部位转移的过程[17-18],质体小球是贮藏大量中性脂的细胞器,它的降解产物对作物产量和品质会有一定影响,因此研究质体小球降解不仅具有理论意义也有实践意义,然而目前对质体小球降解的研究还很少[19-20],质体小球降解的途径还不清楚。茄子是广泛栽培的蔬菜作物,关于茄子质体小球在叶衰老期间的降解途径还尚未见报道。笔者采用透射电子显微技术对衰老前后茄子叶中的质体小球变化进行观察,以期了解质体小球降解的亚细胞途径。
1 材料与方法
1.1 材料
供试茄子(Solanum melogena)品种为辽茄六号,由临沂市种子公司提供。
1.2 方法
2018年3月进行茄子育苗,4月将苗移栽于临沂大学教学实验基地大田内,6月取样。在离茎尖较近的位置取叶片正在扩展的幼叶,从植株基部节上取浅绿色的老叶。于晴天10:00—11:00,从3株茄子上取样,每株取3个幼叶和3个老叶。
1.3 透射电子显微技术
从每片幼叶和老叶上剪下部分叶片,幼叶一组,老叶一组,分别置于盛有2%戊二醛固定液(磷酸缓冲液配制)中进行初固定,带回实验室进一步切成小于1 mm2小块,12 h后再用1%四氧化锇溶液固定12 h。用梯度酒精脱水,Epon 812树脂包埋,然后切片,厚度60~70 nm。切片用柠檬酸铅和醋酸双氧铀双重染色,在JEOL1220透射电镜下观察叶绿体。幼叶和老叶各观察9个样品。
2 结果与分析
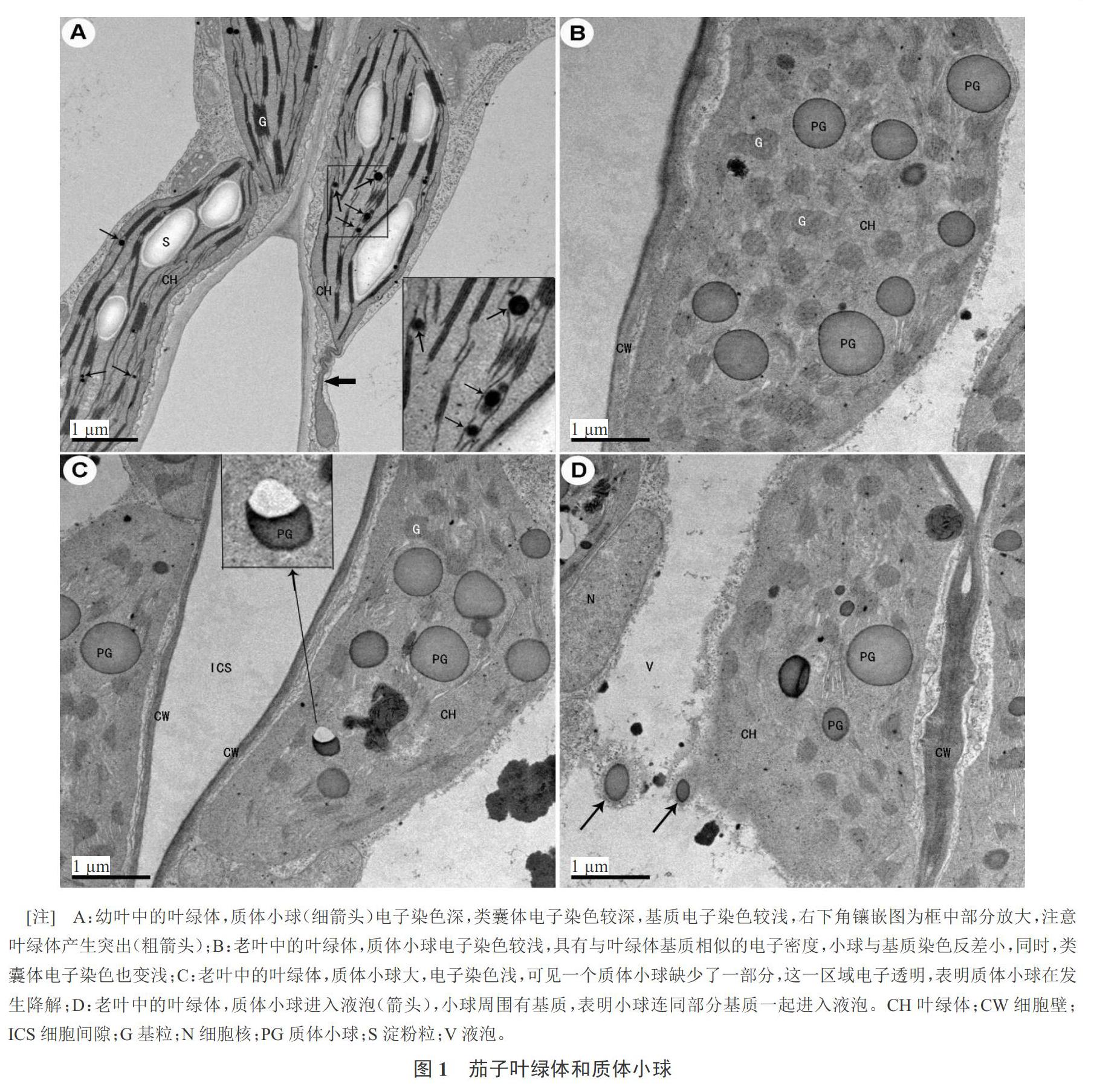
由图1-A可以看出,在尚未充分扩展的叶片中,每个叶绿体的一个切片上可观察到(8.6±1.6)个质体小球,小球总是与类囊体靠在一起。质体小球嗜锇性强,电子密度大,呈现深黑色小球体,直径小的只有0.02 μm,最大也不足0.2 μm,平均(0.06±0.02) μm。叶绿体基质与类囊体的电子着色能力不同,基质电子密度较小,类囊体电子密度大,因此基质与类囊体形成的基粒之间有明显反差。基粒的电子密度与质体小球电子密度相同,显示质体小球与类囊体之间的密切关系。这个时期的叶绿体积累淀粉粒,淀粉粒厚约0.5 μm,长1~2 μm,电子染色非常浅。叶绿体还向外伸展形成突起,突起中只有基质,没有类囊体。
植株基部的叶发生早,随着株龄增大,这些叶首先开始自然衰老,成为衰老叶。电镜下观察,老叶一个叶绿体的一个切片上有(8.6±1.2)个质体小球,与幼叶相比,质体小球数量基本没有明显变化,然而质体小球的体积则显著增大,平均直径增大到(0.7±0.1) μm,很多达到0.8 μm,比幼叶中的质体小球直径增大了10倍左右,体积增大数百倍至千倍,显然,虽然叶衰老对质体小球的数目没有明显影响,但引起小球体积剧烈增大(图1-B~D)。质体小球的内部电子染色较浅,质体小球的表面电子染色较深,结果小球表面与内部形成较明显的染色反差。蛋白质具有较强的嗜锇性,质体小球表面染色深,表明质体小球膜上结合有大量蛋白质。质体小球内部与类囊体的电子染色非常接近,显示两者之间的嗜锇性同步变化。类囊体电子染色变浅,与基质间的电子密度差变小。衰老叶的叶绿体不含淀粉,显示叶绿体衰老抑制淀粉积累。
大量观察显示,衰老叶的质体小球发生降解,降解途径有两种:叶绿体途径和液泡途径。在叶绿体途径中,质体小球在叶绿体内发生降解。在部分叶绿体的部分切片上能够观察到质体小球降解,而不是所有的叶绿体或所有的切片上都能观察到质体小球降解,显示质体小球降解是不同步的。正在发生降解的质体小球具有明显的特征,表现为形状不规则,不再呈球形,并且与电子透明的区域相联系(图1-C)。这一现象表明,降解不是在质体小球整个表面发生,而是从质体小球的一侧发生,因此降解中的质体小球不再呈球形,缺少了部分,致使不完整的这一侧表面凹陷,而另一侧是凸起的曲面(图1-C)。尽管只能观察到少数质体小球发生原位降解,但大量的观察表明降解现象是真实的,不是假象。
在液泡途径中,质体小球转移到中央大液泡内,在液泡内降解。大量观察表明,质体小球进入液泡后仍然被一层基质包围(图1-D),这些基质与叶绿体基质形态特征一致,显示质体小球连同部分叶绿体基质一起被液泡吞噬,一同进入具有水解功能的液泡,而不是先离开叶绿体再进入液泡。当液泡内出现质体小球时,附近的叶绿体中质体小球通常较少,表明液泡中的质体小球就来自附近的叶绿体。含质体小球较少的叶绿体(图1-C~D)比含质体小球多的叶绿体(图1-B)略小,是部分质体小球降解或与部分基质一起离开叶绿体的结果。叶绿体中的质体小球数不相等,表明质体小球离开叶绿体或原位降解并不同步。
3 讨论与结论
对大量样品观察的结果表明,茄子叶衰老引起质体小球体积增大,质体小球发生叶绿体内降解或液泡内降解。叶绿体中的质体小球数没有增加,有些叶绿体中质体小球还减少,可能是小球降解的结果。质体小球直径增大10倍左右,体积增大数千倍左右,意味着衰老引起中性脂的合成量剧烈增加。用于合成中性脂的脂肪酸可能来自类囊体膜,是膜脂降解产物[21-22]。
本研究直观显示老叶中质体小球降解,这与转录组学研究结果相互支持。转录组学研究表明,叶衰老提高了脂肪酶基因表达水平[23-24],即脂肪酶量增加,可能会参与类囊体膜脂组分的降解。
茄子叶质体小球进入液泡内降解,转录组学研究结果显示衰老叶部分表达水平升高的脂肪酶是定位于液泡内的[23-24],即液泡内负责脂分子降解的酶随着叶衰老而增多,这表明显微镜下的观察结果与转录组学的分析结果互为佐证,相互支持。茄子叶质体小球向液泡中转移是一个复杂的细胞生物学过程,涉及到质体小球和部分叶绿体基质被液泡吞噬。细胞组分不经自噬小体而直接被液泡吞噬并消化的过程属于微自噬,而先形成自噬小体再被液泡或溶酶体消化的过程为巨自噬[25]。通过转录组学分析显示叶衰老大大增强自噬相关基因的表达[23],间接支持茄子衰老叶质体小球发生液泡内降解的观察。实际上,在西瓜[19]、黄瓜[20]和大豆[10]衰老叶中也观察到了质体小球发生液泡内降解的现象,但质体小球进入液泡的方式不相同,茄子叶质体小球连同叶绿体基质一起进入液泡,而西瓜、黄瓜和大豆衰老叶中质体小球先从叶绿体分泌出来,再被液泡吞噬。
茄子叶质体小球发生原位降解,即在叶绿体内降解,这一现象也发现于西瓜[19]和黄瓜[20]衰老叶。质体小球在叶绿体内降解是否是普遍现象,还需要对更多植物做进一步观察。质体小球在叶绿体内降解涉及两个重要过程,一是脂肪酶的转运,一是降解产物脂肪酸的聚集。脂肪酸对细胞有毒性,因此脂滴降解產生的脂肪酸必须有隔离机制。在油性种子中这两个过程已经研究清楚,油性种子发芽时,乙醛循环体将脂肪酶运送到脂滴表面,并收集隔离酶解产物脂肪酸[26]。脂肪酸在乙醛酸循环体内通过β-氧化途径和乙醛酸循环途径进一步降解为小分子琥珀酸,琥珀酸再经线粒体中的三羧酸循环和细胞质基质中的糖异生途径转化为可运输低分子糖[26]。衰老叶内叶绿体中脂肪酶如何运输到质体小球表面,质体小球的降解产物如何聚集并隔离,都还有待于进一步研究,对这些关键过程的了解有助于对叶绿体内质体小球降解机制的认识。
茄子植株下部葉片发生衰老时,质体小球降解产物最终以蔗糖的形式转运到生长部位,对果实和新叶发育具有重要意义,但是要了解质体小球降解与果实产量和品质的关系还需要做大量工作。
参考文献
[1] GREENWOOD A D,LEECH R M,WILLIAMS J P.The osmiophilic globules of chloroplasts.I.Osmiophilic globules as a normal component of chloroplasts and their isolation and composition in Vicia faba L. [J].Biochimica et Biophysica Acta,1963,78(1):148-162.
[2] BAILEY J L,WHYBORN A G.The osmiophilic globules of chloroplasts.II.Globules of the spinach-beet chloroplast[J].Biochimica et Biophysica Acta,1963,78(1):163-174.
[3] KATZ A,JIMENEZ C J,PICK U.Isolation and characterization of a protein associated with carotene globules in the alga Dunaliella bardawil[J].Plant Physiology,1995,108(4):1657-1664.
[4] LAIZET Y,PONTIER D,MACHE R,et al.Subfamily organization and phylogenetic origin of genes encoding plastid lipid-associated proteins of the fibrillin type[J].Journal of Genome Science and Technology,2004,3(1):19-28.
[5] SCHMIDT M,GEBNER G,LUFF M.Proteomic analysis of the eyespot of Chlamydomonas reinhardtii provides novel insights into its components and tactic movements[J].Plant Cell,2006,18(8):1908-1930.
[6] STEINMULLER D,TEVINI M.Composition and function of plastoglobuli.I.Isolation and purification from chloroplasts and chromoplasts[J].Planta,1985,163(2):201-207.
[7] RINNAN R,HOLOPAINEN T.Ozone effects on the ultrastructure of peatland plants:Sphagnum mosses,Vaccinium oxycoccus,Andromeda polifolia and Eriophorum vaginatum[J].Annals of Botany,2004,94(4):623-634.
[8] STANIER G.Fine structure of cyanobacteria[J].Methods in Enzymology,1988,167:157-172.
[9] LICHTENTHALER H K,PEVELING E.Plastoglobuli in verschiedenen differenzierungsstadien der plastiden bei Allium cepa L.[J].Planta,1966,72(1):1-13.
[10] GUIAME T J,PICHERSKY E,NOODEN L D.Mass exodus from senescensing soybean chloroplasts[J].Plant Cell Physiology,1999,40:986-992.
[11] GHOSH S,MAHONEY S R,PENTERMAN J N,et al.Ultrastructural and biochemical changes in chloroplasts during Brassica napus senescence[J].Plant Physiology and Biochemestry,2001,39(9):777-784.
[12] RUDELLA A,FRISO G,ALONSO J M,et al.Downregulation of ClpR2 leads to reduced accumulation of the ClpPRS protease complex and defects in chloroplast biogenesis in Arabidopsis[J].Plant Cell,2006,18(7):1704-1721.
[13] KROLL D,NEIERKOFF K,BECHTOLD N,et al.VIPP1,a nuclear gene of Arabidopsis thaliana essential for thylakoid membrane formation[J].Proceedings of the National Academy of Sciences of United States of America,2001,98(7):4238-4242.
[14] DERUERE J,ROMER S D,HARLINGER A.Fibril assembly and carotenoid overaccumulation in chromoplasts:a model for supramolecular lipoprotein structures[J].Plant Cell,1994,6(1):119-133.
[15] LIU L.Ultrastructural study on dynamics of lipid bodies and plastids during ripening of chili pepper fruits[J].Micron,2013,46:43-50.
[16] VISHNEVETSKY M,OVADIS M,VEINSTAIN A.Carotenoid sequestration in plants:the role of carotenoid-associated proteins[J].Trends Plant Science,1999,4(6):232-235.
[17] HIMELBLAU E,AMASINO R M.Nutrients mobilized from leaves of Arabidopsis thaliana during leaf senescence[J].Journal of Plant Physiology,2001,158(10):1317-1323.
[18] JIBRAN R,HUNTER D A,DIJKWEL P P.Hormonal regulation of leaf senescence through integration of developmental and stress signals[J].Plant Molecular Biology,2013,82(6):547-561.
[19] LIU L.Ultramicroscopy reveals that senescence induces in-situ and vacuolar degradation of plastoglobules in aging watermelon leaves[J].Micron,2015,80:135-144.
[20] 葛姝君,趙丹,周雪,等.黄瓜叶片衰老过程中脂滴的原位降解和液泡内降解[J].园艺学报,2016,43(10):2021-2028.
[21] MURPHY D J.The biogenesis and functions of lipid bodies in animals,plants and microorganisms[J].Progress in Lipid Research,2001,40(5):325-438.
[22] MURPHY D J.The dynamic roles of intracellular lipid droplets:from archaea to mammals[J].Protoplasma,2012,249(3):541-585.
[23] GEPSTEIN S,SABEHI G,CARP M J,et al.Large-scale identification of leaf senescence-associated genes[J].Plant Journal,2003,36(5):629-642.
[24] GUO Y,CAI Z,GAN S.Transcriptome of Arabidopsis leaf senescence[J].Plant Cell and Environment,2004,27(5):521-549.
[25] PHILLIPS A R,SUTTANGKAKUL A,VIESTRA R D.The ATG12-conjugating enzyme ATG10 is essential for autophagic vesicle formation in Arabidopsis thaliana[J].Genetics,2008,178(3):1339-1353.
[26] THOMPSON J E,FROESE C D,MADEY E,et al.Lipid metabolsim during plant senescence[J].Progress in Lipid Research,1998,37(2/3):119-141.
