西瓜炭疽病及抗性育种研究进展
2021-07-19郜森王恩煜杨小振曾郅隆杨建强马含月张显
郜森 王恩煜 杨小振 曾郅隆 杨建强 马含月 张显


摘 要:西瓜炭疽病是由瓜类炭疽病菌诱导发生的一种全球性病害,对瓜类危害极大,仅次于西瓜枯萎病。从西瓜炭疽病病菌的病理学研究入手,进而对西瓜炭疽病的抗性育种概况、抗性基因研究、品種抗性鉴定以及防治方法等多方面研究现状进行了总结阐述,以期能够为西瓜炭疽病的进一步研究提供科学理论基础。
关键词:西瓜;炭疽病;病理学;抗性鉴定
中图分类号:S651 文献标志码:A 文章编号:1673-2871(2021)05-001-07
Research progress of watermelon anthracnose and resistance breeding
GAO Sen1, WANG Enyu1, YANG Xiaozhen1, ZENG Zhilong1, YANG Jianqiang1, MA Hanyue2, ZHANG Xian1
(1. College of Horticulture, Northwest A&F University, Shaanxi 712100, Yangling, China; 2. Dongtai National Modern Agricultural Industrial Park, Dongtai 224200, Jiangsu, China)
Abstract: Watermelon anthracnose(Colletotrichum orbiculare) is a global disease, imposing huge threat to watermelon second only to Fusarium wilt. We summarize research progress in pathological study of the pathogen of watermelon anthracnose, watermelon anthracnose resistance breeding, resistance genes, variety resistance identification and control methods, aiming to.provide a scientific theoretical basis for further research on the disease.
Key words: Watermelon; Anthracnose; Pathology; Resistance identification
西瓜炭疽病是由瓜类炭疽病菌引发的一种全球性真菌病害。该病在西瓜的全生育期内均可发生,且具有潜伏侵染特性,在西瓜采后贮运过程中,亦可发生,引起西瓜腐烂变质[1-2]。西瓜炭疽病的田间发病率一般为20%~40%[3],在高温高湿环境中发病更为严重,发病率可达100%,减产40%以上,其危害仅次于西瓜枯萎病[4-5],严重制约西瓜产业的发展。笔者对西瓜炭疽病的国内外研究成果进行了总结,以期能够为西瓜炭疽病的进一步研究提供科学理论基础。
1 西瓜炭疽病的病理学研究
1.1 西瓜炭疽病菌的侵染循环与发病规律
带菌的种子或土壤是导致西瓜炭疽病发生的主要初侵染源。若种子带菌,病菌会随着种子的萌发过程侵入子叶,从而诱导瓜苗发病;若土壤带菌,且环境相对适宜,病菌能够萌发产生分生孢子,通过寄主的气孔或伤口来侵染寄主,并形成炭疽病病斑,且病斑亦可再产生分生孢子,并可借助风雨或灌水以及人畜活动等途径来传播分生孢子,完成再侵染。
炭疽病的发生与环境的温湿度密切相关,其发生的温度范围为10~30 ℃,最适发病温度为24 ℃[6]。由于田间生产中,环境温度一般都能满足发病的基本要求,因此,湿度是诱发该病的关键因素。温度适宜时,湿度范围在85%~95%,发病最快;湿度愈低,潜育期愈长,低至54%以下,病害就无法发生[7]。
1.2 西瓜炭疽病的症状及危害
炭疽病在西瓜整个生长周期内均可发生。幼苗发病,子叶上出现圆形、褐色病斑,幼茎基部亦可受害、溢缩,引起幼苗猝倒;成株期染病,叶片初期为黄色、附有同心轮纹的圆形小斑,易穿孔(图1-a),后期多个病斑相互连片,颜色深褐,叶片焦枯致死;若叶柄或茎蔓上染病,病斑初期为黄褐色、长椭圆状且凹陷,随后病斑逐渐扩大并转变为黑褐色,最后引起茎蔓枯死(图1-b)。果实感病时,初期显暗绿色油渍状小斑点,后迅速扩大为圆形、暗褐色、凹陷且易龟裂的轮纹病斑[8-10](图1-c)。西瓜在贮运过程中,炭疽病也常发生,从而引起果实腐烂、变质、失去商品价值,造成经济损失。
1.3 西瓜炭疽病菌的生物学特征
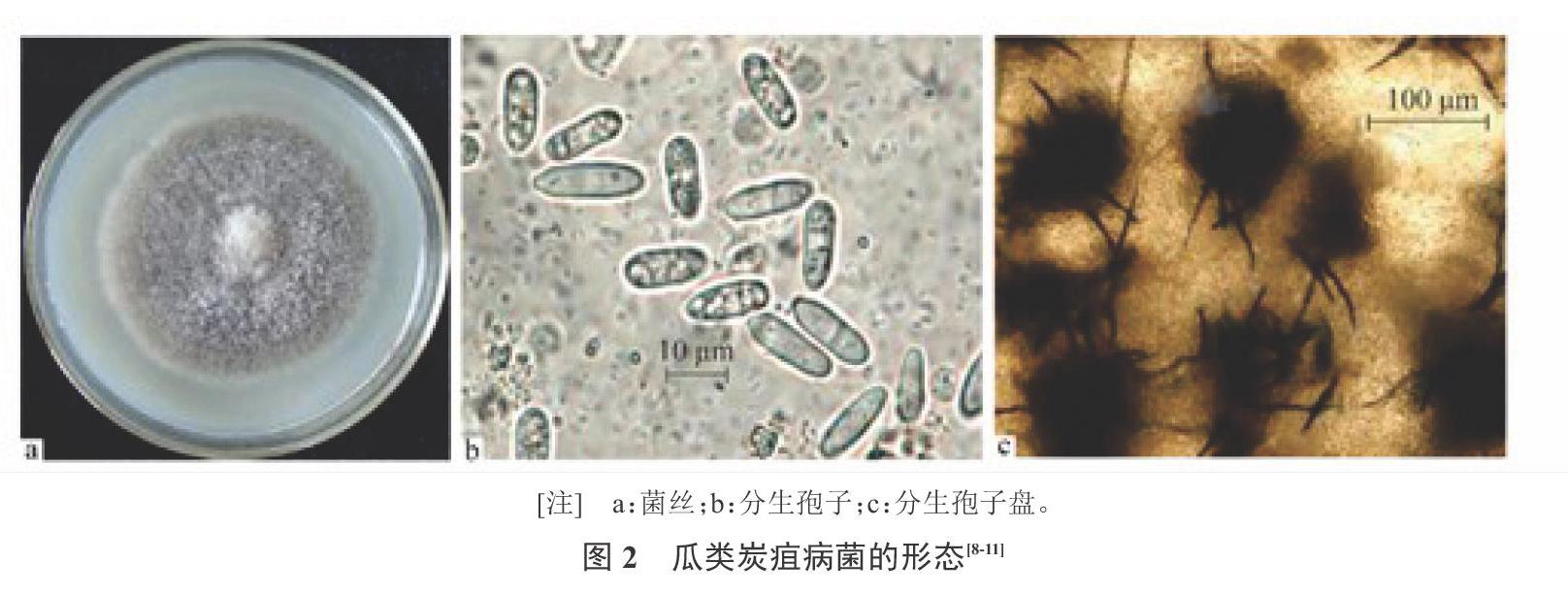
西瓜炭疽病病原菌[Colletotrichum orbiculare Berk. et Mont](异名)[Colletotrichum lagenarium (Pass.) Ell. et Halst],为半知菌亚门、黑盘孢目、刺盘孢属。分生孢子盘寄生在寄主表皮下,成熟后突破寄主表皮而向外露,上部着生一层黑褐色的刚毛,长90~120 ?m,具有2~5个隔膜。分生孢子梗为无色单孢,呈圆筒状,大小一般为(20~26) ?m×(2.6~3.0) ?m。分生孢子常为长圆形无色单孢,多数堆聚时呈粉红色,具有2~3个横膈膜,大小为(14~20) ?m×(5.0~6.0) ?m[11](图2)。
罗婷[12]研究发现,C. orbiculare经人工培养2~3 d,菌落整体呈乳白色且着生绒毛状气生菌丝;3~5 d,菌落面积增大且中部呈现为淡粉红色、边缘渐浅至白色;5~7 d,菌落面积进一步变大,具有同心轮纹,菌落边缘为波状,菌落颜色整体为灰色;7~12 d,菌落布满整个平板,颜色变深呈深灰色,从背面看菌落边缘有一淡粉色晕圈;12~15 d,菌落可产生红褐色、黏稠状孢子团。
1.4 西瓜炭疽病菌的病原学鉴定
目前关于西瓜炭疽病菌的分离、纯化、培养及鉴定方法的研究已较为完备,故将其总结如下,为开展西瓜炭疽病菌生理小种分化、材料抗性鉴定、抗性遗传、抗性机制及抗性育种等的研究提供科学理论基础。
1.4.1 西瓜炭疽病菌的分离与纯化 田间采集具有典型西瓜炭疽病病状的植物标本,利用常规组织分离法,分离病植物组织,进行消毒后,接种于PDA培养基上,置于恒温培养箱中培养,待其生长3~4 d时,挑取菌落边缘菌丝,转接至新的PDA平板上,转接3~4次可使病菌纯化。
1.4.2 西瓜炭疽病菌的培养 C. orbiculare通常使用PDA培养基来进行培养,但该菌在人工培养条件下存在生长缓慢、只长菌丝、不长孢子等问题[13-14],这对该菌的深入研究带来了困难。为解决这一难题,罗婷[10]通过比较C. orbiculare在5种不同培养基上的生长速度,发现将其接种于西瓜皮培养基上,产孢速度最快,仅10 d即可产孢,而接种于胡萝卜培养基与西瓜汁培养基上,C. orbicular的菌落形成速度最快。王勇方等[15]研究发现,C. orbiculare的最适生长温度为26 ℃,pH值为5~8,在PDA培养基中添加适合的碳源与氮源,如将碳源更换为木糖,氮源更换为牛肉浸膏时可以促进病原菌的生长。刘志恒等[16]也对C. orbiculare的产孢条件进行了研究,通过比较C. orbiculare在不同培养基及不同氮源、碳源、温度培养基上的生长状况与产孢量,发现使用西瓜茎叶煎汁培养基在25 ℃恒温黑暗培养30 d,C. orbiculare可产生大量分生孢子。唐爽爽等[17]研究了C. orbiculare的产毒条件、粗毒素的生物活性并对其理化性质测定方法进行了优化,发现粗毒素是致使西瓜感染炭疽病的主要致病因子,且使用pH值为6的Richard培养液置于25 ℃黑暗环境条件下连续振荡培养20 d的C. orbiculare产生的粗毒素毒性最强。
上述研究初步得出了C. orbiculare产生分生孢子的基本条件,为C. orbiculare的深入研究奠定了基础。
1.4.3 西瓜炭疽病菌的致病性鉴定与分子生物学鉴定方法 为确定分离得到的病原菌是否为C. orbiculare,待病原菌产孢后,挑取其孢子与少量无菌水混合均匀,使用血球计数板观察、统计孢子浓度,并用无菌水将孢子悬浮液稀释至1×106 个·mL-1,以無菌水为对照,采用喷雾法进行回接鉴定,逐日观察发病情况,并拍照记录,可从接种发病的植株上再次分离纯化病菌来比较其是否与最初分离到的菌株一致。同时亦可采用分子生物学的鉴定方法来对病原菌进行鉴定:使用CTAB法提取DNA,以提取到的DNA为模板,进行特异性扩增,经1%的琼脂糖凝胶电泳检测后,将PCR产物进行测序,根据测序结果,提交到GenBank,与核酸数据库进行Blast序列比对,找到同源性最高的序列[18-19]。将分子生物学的鉴定结果与病原菌培养性状及其形态学的鉴定结果相结合,并查阅相关的文献,进行综合分析,判断其是否为C. orbiculare[20-21]。
1.4.4 西瓜炭疽病菌的保存 目前菌种的保存方法主要有:1.短期保存,可将菌种接种于PDA平板或试管斜面PDA培养基上,置于25 ℃恒温培养箱内培养3~6 d后,保存于4 ℃冰箱,每2~3个月转接1次,可保持菌种活性;2.长期保存,可将菌种接种于试管斜面PDA培养基上,置于25 ℃恒温培养箱内培养,待其长满斜面后,加入适量50%的甘油溶液(灭菌),置于-80 ℃或液氮中保存,一般可保存2~4 a(年)。
1.5 生理小种的分化及鉴定方法
目前,根据瓜类炭疽病菌对不同瓜类致病性的差异,已发现7个瓜类炭疽病生理小种,其中小种1、2、3的分布最广,危害最重[22],其鉴别方法如下(表1)[23]。而小种4、5、6、7对寄主的致病性为:小种4对所有的鉴别寄主致病;小种5对西瓜高度致病,对黄瓜致病性稍弱;小种6对西瓜的致病性很强,但对厚皮甜瓜较弱;小种7类似于小种3,仅在黄瓜品种Pixie上致病性稍弱[24-25]。
2 西瓜炭疽病抗性遗传的研究
2.1 西瓜炭疽病抗性遗传规律
西瓜炭疽病抗性遗传的研究最早始于1937年,Layton等[27]利用抗病材料非洲8、9、13与感病材料Iowa King、Iowa Belle杂交,F1表现为抗病,经F1代自交及回交后,结果表明抗病性相对于感病性为显性且抗性是由单一的显性基因控制的。1959年,Winstead[28]分别使用小种1、2、3对86个西瓜品种进行接种,发现对小种1表现抗性的品种同样对小种3表现出抗性,但却对小种2感病。进一步研究发现,确认使西瓜对小种1和3的抗性由一对显性基因控制,随后Hall等[29]的研究得到了同样的结果。1980年,Sowell等[30]报道了PI 271778、PI 189225、PI 326525等对小种2产生抗性的材料。随后,Suvanprakorn等[31]利用上述PI系抗病材料与感病材料Jubilee、Crimson Sweet、Charleston Gray及AWB-10系进行杂交,结果表明,上述PI材料对小种2的抗性均系单基因显性遗传。但随后Love[32]新的研究结果发现,品系PI 189225和PI 299379的抗性均为单基因显性遗传,且由相同的基因控制,但二者存在不同的修饰基因;而品系R309的抗性系多基因显性遗传。
2.2 西瓜炭疽病抗性基因
目前,以葫芦科作物为研究对象的抗性基因定位及克隆的研究日益广泛、深入,已取得了一系列进展。许勇等[33]利用西瓜野生抗性种质PI 296341与感病材料97103为亲本,找到了与抗枯萎病生理小种1的抗性基因紧密连锁的RAPD标记,遗传距离为3.0 cM,并成功转化为SCAR标记,构建了一套西瓜抗枯萎病育种分子标记辅助选择技术系统,该技术系统在抗病转育的F3群体中得到了很好的应用。丁群英[34]针对西瓜枯萎病2号生理小种的抗性材料PI 296341与感病材料M17,采用BSA法对F2群体进行分析(分离比例为3∶1),首次获得了与西瓜抗枯萎病生理小种2基因相连锁的显性标记,命名为OPG13/530。马少芹等[35]以西瓜病毒病抗性材料PI 595203与感病98R为亲本,采用RAPD法和BSA法得到一条与ZYMV-CH抗性基因连锁的谱带AK13-644,并转化成为了SCAR标记SCAK13-644。2007年,王慧哲等[36]以黄瓜炭疽病抗性材料66与感病材料A18为亲本,采用BSA法与AFLP对F2群体进行分析,研究发现黄瓜对炭疽病的抗性是由单隐性基因控制的,感病相对抗病为不完全显性。李淑菊等[37]将黄瓜抗炭疽病相关基因的一个共显性AFLP标记成功地转换为简单实用的SCAR标记,2对引物在F2单株和抗感病材料验证中符合率高达97.27%,可以用于黄瓜炭疽病抗性的分子鉴定。Pan等[38]以自交系Gy14与WI2757为亲本构建群体,将炭疽病的抗性基因定位至5号染色体一个32 k的区域内上,并得到一个名为STAYGREEN(CsSGR)的候选基因。
但关于西瓜炭疽病相关的分子研究并不多见,2007年,唐建辉等[39]对西瓜炭疽病菌核糖体基因的ITS区段进行了克隆和序列分析,发现C. orbiculare在种内十分保守,可利用ITS区段设计特异性引物来识别C. orbiculare,为其进一步研究提供分子依据与基础;2014年,牛晓伟等[40]对抗性材料PI 189225接种西瓜炭疽病1号生理小种进行分子标记鉴定,利用AFLP引物组合获得了与抗性基因连锁的3个标记。2019年,Jang等[41]研究发现,抗性材料P1DrHs7250对西瓜炭疽病1号生理小种的抗性由显性单基因控制,获得了一个非同义单核苷酸多态性(SNP)位点的分子标记,位于富亮氨酸重复域。同时通过对来自89种植物的1007个同源物进行鉴定,获得了一个可以决定植物对外源病毒侵入抗性的保守基序,为IxxLPxSxxxLYNLQTLxL。总体而言,关于西瓜炭疽病的抗性遗传与抗性基因的研究,还需进一步深入。
3 西瓜炭疽病抗性育种研究概况
作为一种高效且经济的防治西瓜炭疽病的方法,抗性品种的选育一直是育种家们研究的重点方向。早在19世紀末,美国育种家们就已开展抗炭疽病种质资源引进、筛选及培育工作[42]。1947年,Layton等[27,43]利用来自非洲的西瓜品种非洲8、9、13与当地栽培种杂交,选育出兼抗西瓜枯萎病和炭疽病的品种Kleckley Hybrid和Black Kleckley。同时期,兼抗西瓜枯萎病和炭疽病的品种Charleston Gary、Fairfax与抗西瓜炭疽病的Congo被Podle和Andrus[44]成功选育出来,并得到广泛推广。其中,Charleston Gray作为美国主栽品种长达30年之久,且被推广至其他国家种植。自2号小种被发现后,育种家一直在挖掘2号小种的抗性材料。1976年,材料PI 326515被发现其兼抗2号小种[45];随后,Sowell等[30]相继发现,PI 271778、PI 189225等抗性材料具有生理小种2的抗性。1983年Norton等[46]选育出了2个抗2号生理小种的品种AU-Producer和AU-Jubilant。2年后,Crall等[47]选育了兼抗枯萎病和炭疽病的品种Icebox。1994年,Crall等[48]再次选育出兼抗枯萎病和炭疽病的新品种SSDL,该品种凭借其抗病性强与商品性好等优点在生产中广泛栽培。
20世纪50年代前后,日本利用从美国引进的抗性材料Congo和Charleston Gary,先后选育出了光玉绿、南都绿、都锦等抗性品种[49-50]。苏联育种家,为得到西瓜炭疽病的抗性材料,利用人工接种和自然发病的方法,鉴定了大量的种质资源,筛选后发现K-643、K-1298、K-2814、K-4598等野生材料在人工接种西瓜炭疽病菌后,不会引起果实发病,可作为西瓜炭疽病的有效抗源,为西瓜炭疽病抗性品种的选育奠定了材料基础[51]。
早在1956年,我国台湾省便开始有计划地进行抗病育种工作,并选育出了一系列优质品种,如富光、富宝、新富宝等[52]。30年后,我国内地开始有计划地开展西瓜抗病品种的选育工作,但初期主要以抗西瓜枯萎病为主要研究方向,选育出了高抗枯萎病的新品种—西农8号[53]。随后,关于西瓜炭疽病的相关研究也陆续展开。1990年,刘莉[54]采用苗期抗性鉴定的方法,对59份西瓜种质资源进行抗性研究,发现材料的抗病性与其来源和生态型密切相关,抗性排序一般为非洲生态型>美国生态型>华北和东亚生态型。1994年,文生仓等[26]首次提出取代传统“DI评价法”的“AD评价法”以及西瓜炭疽病离体叶人工接种技术。上述研究成果为西瓜炭疽病抗性材料的筛选、培育提供了科学的理论依据,目前我国已选育出西瓜炭疽病的抗病品种有京抗2号、京抗3号、抗病948等[55-56]。
4 西瓜炭疽病品种的抗病性鉴定方法及标准
植物对病原菌的抗病性鉴定方法,可分为自然条件下抗性鉴定和人工接种抗性鉴定。其中,自然条件下抗性鉴定易受环境因素影响,调查周期长且不易控制;而通过人工接种进行抗病鉴定筛选,可以缩短调查时间,便于控制发病因素,可以准确地反映材料抗性水平[51]。
目前,西瓜炭疽病的人工接种方法有滴液法、菌饼打孔法、叶片涂刷接种法、喷雾法以及离体叶接种法。1990年,刘莉等[54]对西瓜炭疽病品种的抗病性鉴定方法进行了研究,得出采用喷雾法,利用浓度为1×106个·mL-1孢子悬浮液进行西瓜苗期炭疽病的抗性鉴定效果最佳,初步制定了关于西瓜炭疽病的苗期抗病性鉴定方法流程,并从59份西瓜材料筛选得到了AW1-1、AW5、AW9、PI 191392等4份西瓜炭疽病高抗材料。随后,文生仓等[26]利用3个不同抗性的西瓜品种,对西瓜炭疽病的离体叶接种法进行了探究,发现离体叶接种法不仅可以与苗期喷雾接种法准确鉴别、反映出不同品种固有的抗性水平且能节省大量菌液、时间,降低试验成本与工作量并可更加精确地控制发病因素,同时更首次提出平均病斑直径法(AD评价法)。罗婷[12]研究发现,西瓜苗期人工接种鉴定(喷雾法)适宜的孢子液接种浓度为1×106个·mL-1,适宜的接种苗龄为2片真叶期,适宜调查病情的时期为接种后第7天。孙玉燕等[57]利用点滴法对西瓜离体叶片进行了炭疽病抗性鉴定,从12份西瓜种质材料中,鉴定得到了1份西瓜炭疽病菌免疫材料PI 368509。Shim等[58]利用喷雾法对112份瓜类材料进行了抗性鉴定,筛选得出6份黄瓜中抗材料,12份南瓜中抗材料。
总之,关于西瓜炭疽病的人工接种抗性鉴定技术已较为成熟,具体内容可参考魏春华等[59]总结的接种技术规程,该规程可为抗性材料的筛选及培育提供科学指导。
5 西瓜炭疽病的防治方法
近年来,西瓜炭疽病的发生日益严重,采取科学合理的防治措施可有效控制西瓜炭疽病的蔓延,常见的防治方法有:(1)种子处理,使用无菌种子,且进行温汤浸种后催芽、播种[60-61];(2)选用抗病品种,合理布局,根据种植地的环境,因地制宜选择合适品种,可有效控制西瓜炭疽病的发生,如在生产中使用抗病品种948、西农8号等[62];(3)播种前对苗床和棚室进行消毒[63];(4)加强田间栽培管理[64];(5)使用化学药剂防治[65-66]。任何一种方法和措施都难免有其局限性,故应采取综合措施:预防为主,选用抗性品种、结合农业措施、辅以药剂保护。
[21] ZIVKOVIC S,STOSIC S,STEVANOVIC M,et al.Colletotrichum orbiculare on watermelon:Identification and in vitro inhibition by antagonistic fungi[J].Zbornik Matice Srpske za Prirodne Nauke,2017(133):331-343.
[22] 吉加兵.西瓜抗炭疽病育种现状[J].长江蔬菜,1994(2):7-8.
[23] 中国农业科学院郑州果树研究所,中国园艺学会西甜瓜专业委员会,中国园艺学会西甜瓜协会.中国西瓜甜瓜[M].北京:中国农业出版社,2000.
[24] JLEVI A,THOMAS C E,KEINATH A P,et al.Genetic diversity among watermelon (Citrullus lanatus and Citrullus colocynthis) accessions[J].Genetic Resources & Crop Evolution,2001,48(6):559-566.
[25] DUTTA SK,HALL CV,HEYNE EG.Pathogenicity of biochemical mutants of Colletotrichum lagenarium[J].Botanical Gazette,1960,121(3):166-170.
[26] 文生仓,王鸣.西瓜炭疽病人工接种鉴定的新方法:离体叶接种和AD评价法[J].西北农业大学学报,1994,22(1):17-22.
[27] HAMMERSCHMIDT R,BONNEN A M,BERGSTROM G C,et al.Association of epidermal lignification with nonhost resistance of cucurbits to fungi[J].Canadian Journal of Botany,1985,63(12):2393-2398.
[28] WINSTEAD N N.Resistance of watermelon to Colletotrichum lagenarium race 1,2 and 3[J].Plant Disease Reporter,1959,43:570-577.
[29] HALL C V,DUTTA S K,KALIA H R,et al.Inheritance of resistance to the fungus Colletotrichum lagenarium (Pass.) Ell. and Halst. in watermelons[J].Proceedings American Society for Horticultural Science,1960,75:638-643.
[30] SOWELL G J,RHODES B B,NORTON J D.New sources of resistance to watermelon anthracnose[J].Journal American Society for Horticultural Science,1980,105(2):197-199.
[31] SUVANPRAKORN K,NORTON J D.Inheritance of resistance to race 2 anthracnose in watermelon[J].Trends in Microbiology,1980,8(11):483-486.
[32] LOVE S L.Inheritance of disease resistance and related peroxidase and lignification of watermelon to anthracnose species 2[J].Plant Physiology and Biochemistry,1985,55(4):2952.
[33] 许勇,张海英,康国斌,等.西瓜抗枯萎病育种分子标记辅助选择的研究[J].遗传学报,2000,27(2):151-157.
[34] 丁群英.西瓜枯萎病生理小种2抗性基因的分子标记研究[D].陕西杨凌:西北农林科技大学,2005.
[35] 马少芹,许勇,张海英,等.西瓜抗小西葫芦黄花叶病毒基因的连锁分子标记研究[J].植物病理学报,2006,36(1):68-73.
[36] 王惠哲,李淑菊,刘秀峰,等.与黄瓜抗炭疽病相关基因连锁的AFLP标记的筛选[J].园艺学报,2007,34(1):213-216.
[37] 李淑菊,王惠哲,霍振荣,等.黄瓜抗炭疽病相关基因AFLP标记的SCAR转换[J].园艺学报,2008,35(1):123-126.
[38] PAN J,TAN J,WANG Y,et al.Staygreen (CsSGR) is a candidate for the anthracnose (Colletotrichum orbiculare) resistance locus cla in Gy14 cucumber[J].Theoretical and Applied Genetics,2018,131(7):1577-1587.
[39] 唐建輝,王伟,王源超.西瓜炭疽病菌Colletotrichum orbiculare的分子检测[J].中国农业科学,2006,39(10):2028-2035.
[40] 牛晓伟,唐宁安,范敏,等.西瓜抗炭疽病的遗传分析和抗性基因定位研究[J].核农学报,2014,28(8):1365-1369.
[41] JANG Y J,SEO M,HERSH C P,et al.An evolutionarily conserved non-synonymous SNP in a leucine-rich repeat domain determines anthracnose resistance in watermelon[J].Theoretical and Applied Genetics,2018,132(2):473-488.
[42] 王浩波,王鸣,高秀武,等.美国西瓜育种历程及育成品种的种质基础[J].园艺学报,2003,30(3):366-369.
[43] PAERIS G K.Watermelon breeding[J].Economic Botany,1949,3(2):193-212.
[44] 俞大钹.植物病理学和真菌技术汇编[M].北京:人民教育出版社,1977:697-697.
[45] SOWELL G J,POINTER G.Gummy stem bloght resistance of introduced watermelon[J].Plant Disease Reporter,1962,46:883-885.
[46] NORTON J D,COSPER R D,SMITH D A,et al.‘AU-Jubilant and ‘AU-Producer watermelons[J].Hortscience,1986,21(6):1460-1461.
[47] CRALL J M,ELMSTROM G W.Florida “Icebox” cultivars as a factor in watermelon production in Florida and other producing states[J].Proceedings Soil & Crop Science Society of Florida,1986,45(1):132-134.
[48] CRALL J M,ELMSTROM G W,MCCUISTION F T J.SSDL:a high-quality icebox watermelon breeding line resistant to fusarium wilt and anthracnose[J].Hortscience,1994,29(6):707-708.
[49] 山川邦夫.蔬菜抗病品种及其利用[M].北京:农业出版社,1982.
[50] 森田欣一,洪伯伟.日本西瓜育种[J].世界农业,1992(1):36-38.
[51] 唐宁安.西瓜抗炭疽病基因的分子标记研究[D].浙江金华:浙江师范大学,2013.
[52] 刘文革,何楠,赵胜杰,等.我国西瓜品种选育研究进展[J].中国瓜菜,2016,29(1):1-7.
[53] 王鸣,孙振久,张显,等.西瓜新品种“西农8号”的选育及推广[J].西北农业大学学报,1997,25(4):115-117.
[54] 刘莉,王鸣.西瓜种质资源苗期对炭疽病抗性的研究[J].中国西瓜甜瓜,1990,3(1):9-13.
[55] 刘君璞,马跃.中国西瓜甜瓜发展70年暨科研生产协作60年回顾与展望[J].中国瓜菜,2019,32(8):1-8.
[56] 赵卫星,常高正,徐小利,等.西瓜主要病害及抗病育种研究进展[J].江西农业学报,2010,22(7):75-78.
[57] 孙玉燕,范敏,何艳军.西瓜炭疽病菌离体叶片接种鉴定技术[J].浙江农业科学,2019,60(8):1460-1462.
[58] SHIM S A,JANG K S,YONG H C,et al.Resistance degree of cucurbits cultivars to Colletotrichum orbiculare[J].Wonye Kwahak Kisulchi Korean Journal of Horticultural Science and Technology,2013,31(3):371-379.
[59] 魏春华,郜森,甘露,等.西瓜炭疽病接种技术规程[J].中国瓜菜,2019,32(1):45-47.
[60] SHI Y,MENG S,XIE X,et al.Dry heat treatment reduces the occurrence of cladosporium cucumerinum,ascochyta citrullina,and Colletotrichum orbiculare on the surface and interior of cucumber seeds[J].Horticultural Plant Journal,2016,2(1):35-40.
[61] PRASAD S R,KAMBLE U R,SRIPATHY K V,et al.Seed bio-priming for biotic and abiotic stress management[M]//SINGH D P,SINGH H B, PRABHA R.Microbial inoculants in sustainable agricultural productivity.(Vol.1)Springer India,2016:211-228.
[62] 李振国.西瓜炭疽病的发生规律及农业防治[J].现代农业科技,2018(4):119-120.
[63] 梅丽艳,王喜庆,贾云鹤,等.黑龙江省西瓜主要病害症状及防治措施[J].黑龙江农业科学,2019(10):172-174.
[64] 何勇,李基光,彭建文.西瓜炭疽病的发生与综合防治[J].現代农业科技,2012(20):136-137.
[65] KEINATH A P.Minimizing yield and quality losses in watermelon with multi-site and strobilurin fungicides effective against foliar and fruit anthracnose[J].Crop Protection,2018,106:72-78.
[66] 曾向萍,何舒,符美英,等.海南省冬瓜炭疽病菌对嘧菌酯的敏感基线及抗药性监测[J].中国蔬菜,2017(8):41-46.
