H3K4me3对猪卵母细胞体外成熟和早期胚胎发育的影响
2021-07-19曾毅仁张彩玉侯晗琦恽雪丹李湘萍
曾毅仁,张彩玉,侯晗琦,恽雪丹,李湘萍
亚热带农业生物资源保护与利用国家重点实验室,广西大学,南宁 530004
哺乳动物卵母细胞发育过程中经历了大量的表观遗传修饰. 其中,组蛋白修饰确保了卵子发生过程中基因的正确表达,平衡了合子基因组的转录激活. H3K4me3精确地调控了卵子发生的起始,动态地控制着早期胚胎的发育. 组蛋白H3K4me3对调控基因活化和发育功能有重要作用,在胚胎干细胞中调控重要的多能性相关基因的表达.
我们的前期研究[1]表明,H3K4me3在猪卵母细胞成熟过程中均有表达,说明H3K4me3在猪卵母细胞成熟阶段起到了重要的调控作用. 通过敲除Cxxc1基因降低H3K4me3的表达,不利于组蛋白变体的交换,降低了基因组的可接近性和卵母细胞中整体的转录活性[2]. 敲除卵母细胞中编码H3K4甲基化酶或去甲基化酶的基因,会导致减数分裂进程受损,包括生发泡破裂延迟,纺锤体组装和染色体分离错误,极体排出率降低. 很多研究都表明环境的改变会影响表观遗传修饰. Wu等[3]研究表明,小鼠IVF(体外受精)早期胚胎中H3K4me3的表达模式与体内受精胚胎的十分相似,但体内受精胚胎中H3K4me3的表达显著高于IVF 胚胎,采用TSA(曲古抑菌素A)处理之后,IVF胚胎中的H3K4me3表达显著上调,说明培养条件和环境不同会改变组蛋白修饰. 因此,猪卵母细胞体外成熟效率和质量低于体内,可能是由于表观遗传修饰的改变所致. Sha等[4]研究表明,SN(环绕核仁)染色质构型的卵母细胞比NSN(非环绕核仁)构型的卵母细胞具有更好的发育潜能,H3K4me3表达水平在SN染色质构型的卵母细胞中高于NSN构型[4]. 因此,适当提高H3K4me3的表达有利于卵母细胞的体外成熟和早期胚胎的发育.
本试验通过在猪卵母细胞体外成熟培养液中添加CPI-455,调控卵母细胞组蛋白甲基化及其相关基因的表达,以探讨组蛋白H3K4me3在卵母细胞体外成熟及胚胎发育过程中的重要作用.
1 试验材料与方法
1.1 试验材料
本试验所用卵巢均来源于广西南宁本地屠宰场. 试验所用胚胎为孤雌胚胎.
1.2 试验方法
1.2.1 猪GV(生发泡)期卵母细胞的获取与体外成熟
用预热好的生理盐水将卵巢清洗干净后,用10 mL注射器抽取3~8 mm的卵泡液,静置15 min后,在显微镜下挑选3层以上卵丘细胞的卵丘-卵母细胞复合体. 将COCs(卵丘-卵母细胞复合体)清洗干净后,移入成熟培养液中培养. 0~22 h将卵母细胞放入含有激素的培养液中培养,(22~44] h将卵母细胞移入另一个不含激素的培养液中继续培养. 试验组添加不同浓度的CPI-455处理.
1.2.2 猪卵母细胞的孤雌激活
试验前将融合仪的参数设置为80 μs,50 V/mm和3次脉冲,并在培养箱中平衡电激活液和胚胎培养液. 清洗融合槽,将卵母细胞在激活液中清洗3遍后在激活槽中进行电激活. 激活过的卵母细胞移入平衡好的胚胎培养液中,放入培养箱平衡15 min,然后移入覆盖有矿物油的胚胎培养液微滴中培养. 24 h统计胚胎分裂率,48 h统计4-细胞率,7 d统计囊胚率.
1.2.3 囊胚细胞总数的鉴定
将囊胚细胞放入4%的多聚甲醛中固定12 h,然后移入10 μg/mL Hoechst33342染色液中,避光室温染色10 min. 用PBS(磷酸缓冲盐溶液)将囊胚细胞清洗干净后,移入载玻片的抗淬灭剂中,用凡士林封片,在荧光显微镜下进行观察并做好试验记录.
1.2.4 细胞免疫荧光
收集不同时期的卵母细胞和孤雌囊胚,用4%多聚甲醛固定后在室温下用1% Triton X-100(聚乙二醇辛基苯基醚)透化30 min,之后用1% BSA(牛血清蛋白)进行非特异性位点封闭1~2 h,封闭后用T-BSA-PBS(吐温20-BSA-PBS)洗3次,之后放入H3K4me3的一抗中4 ℃ 12 h. 然后将样品放入培养箱孵育30 min,再用T-BSA-PBS清洗3遍,放入装有二抗的EP(Eppendorf)管中,避光孵育1.5 h,然后用清洗液清洗3遍,最后用10 μg/mL Hoechst33342复染10 min,放入滴有抗淬灭剂的玻片上,凡士林封片镜检.
1.2.5 样品的微量反转录和qRT-PCR(实对荧光定量聚合酶链式反应)检测
收集不同时期的猪卵母细胞和孤雌囊胚,清洗干净后移入装有细胞裂解液的EP管中并于-80 ℃冰箱保存. 微量反转录按照试剂盒说明书进行操作,反转录得到的样品存放于-20 ℃备用. 将反转录得到的产物作为模板,进行qRT-PCR检测,观察不同处理组基因的表达情况(表1). 反应程序为:95 ℃进行5 min,95 ℃进行30 s,60 ℃进行1 min,共40个循环. 猪的18S作为内参基因,目的基因的相对表达量用2-ΔΔCT法计算,引物设计和试验方法参考文献[1]和文献[5].

表1 qRT-PCR反应引物序列
1.3 统计与分析
本试验结果均使用SPSS 22.0软件进行分析,早期胚胎发育率先通过反正弦变化后再进行分析. 每个试验重复至少3次,每次重复试验中至少随机挑选10个以上卵母细胞进行试验.p<0.05表示差异具有统计学意义,p>0.05表示差异不具有统计学意义.
2 试验结果
2.1 0~22 h CPI-455处理对猪卵母细胞体外成熟及早期胚胎发育的影响
如表2所示,在猪卵母细胞体外成熟0~22 h过程中添加不同浓度的CPI-455处理,发现5 μmol/L处理组的第一极体排出率显著高于未处理组、1 μmol/L组和10 μmol/L组(88.80% vs 78.88%,79.23%,78.91%,p<0.05). 各组之间的胚胎分裂率、4-细胞率均无显著差异(p>0.05). 5 μmol/L处理组的囊胚率显著高于未处理组(41.44% vs 28.35%,p<0.05),与1 μmol/L和10 μmol/L组之间差异不具有统计学意义(p>0.05). 各组之间囊胚细胞总数差异不具有统计学意义(p>0.05).

表2 体外成熟0~22 h过程中添加CPI-455对猪卵母细胞体外成熟和胚胎发育的影响
2.2 (22~44] h与0~44 h采用CPI-455处理对猪卵母细胞体外成熟和早期胚胎发育的影响
如表3所示,在猪卵母细胞体外成熟(22~44] h过程中添加不同浓度的CPI-455处理,发现各组之间第一极体排出率、4-细胞率和囊胚细胞总数差异不具有统计学意义(p>0.05). 5 μmol/L处理组的胚胎分裂率显著低于未处理组和1 μmol/L处理组(74.51% vs 84.62%,85.87%,p<0.05). 如表4所示,猪卵母细胞体外成熟0~44 h添加不同浓度的CPI-455处理时,发现各组之间的第一极体排出率、胚胎分裂率、4-细胞率、囊胚率和囊胚细胞数差异均不具有统计学意义(p>0.05).
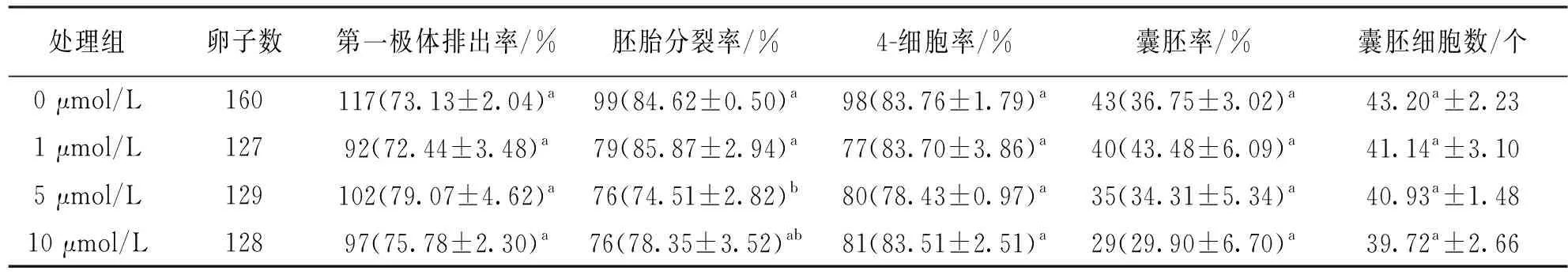
表3 体外成熟(22~44] h中添加CPI-455对猪卵母细胞体外成熟和胚胎发育的影响
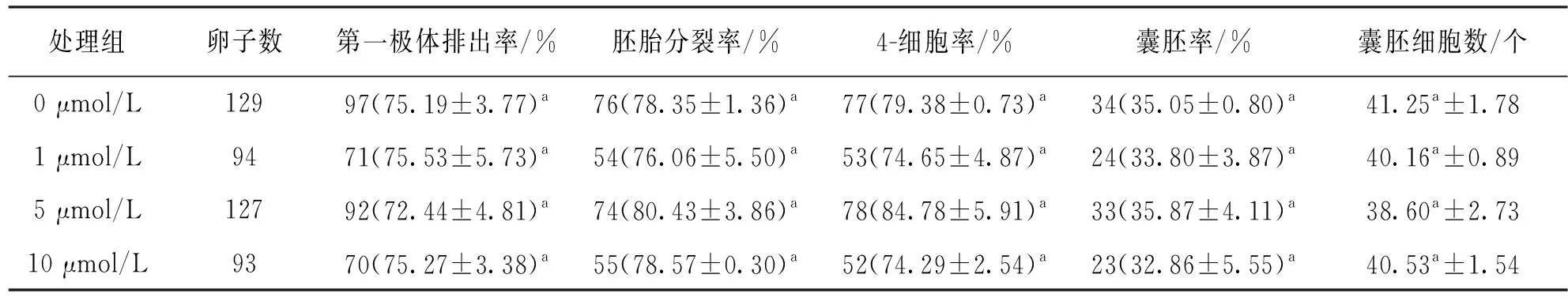
表4 体外成熟0~44 h中添加CPI-455对猪卵母细胞体外成熟和胚胎发育的影响
基于以上结果,后续试验均采用体外成熟0~22 h 添加5 μmol/L处理的方法.
2.3 CPI-455处理对猪卵母细胞和早期胚胎中组蛋白H3K4me3表达的影响
采用免疫荧光技术检测未处理组和5 μmol/L处理组的GV期、22 h和MⅡ期(成熟)卵母细胞及囊胚中H3K4me3的表达情况. 如图1、图2所示,GV期卵母细胞中H3K4me3有表达,两组中22 h和MⅡ期卵母细胞中未检测到H3K4me3表达信号. 与未处理组相比,5 μmol/L CPI-455处理组的囊胚中H3K4me3表达显著提高(p<0.05).

图1 CPI-455处理对不同时期猪卵母细胞和囊胚中H3K4me3表达的影响
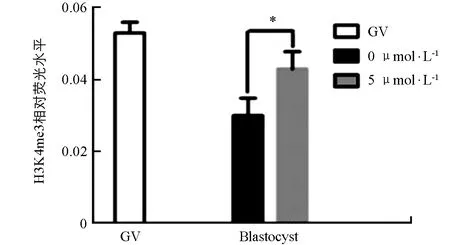
在相同时期各组之间*表示差异具有统计学意义(p<0.05). 试验重复数n=3.图2 GV期卵母细胞和囊胚中H3K4me3的相对荧光水平
2.4 CPI-455处理对猪卵母细胞和早期胚胎中重要基因表达的影响
采用qRT-PCR方法,检测CPI-455处理对猪卵母细胞和早期胚胎中相关基因表达的影响,结果如图3所示. 与未处理组相比,5 μmol/L处理组的22 h卵母细胞中KDM5A和KDM5B的表达均显著降低(p<0.05);5 μmol/L处理组的MⅡ期卵母细胞中KDM5A的表达显著降低(p<0.05),KDM5B的表达差异不具有统计学意义(p>0.05);5 μmol/L处理组囊胚中多能性基因Nanog,Oct4,CDX2的表达均显著提高(p<0.05).

在相同时期各组之间*表示差异具有统计学意义. 试验重复数n=3.图3 CPI-455处理对猪卵母细胞和囊胚中重要基因表达的影响
3 讨论与分析
组蛋白修饰是最重要的表观遗传修饰之一,在早期胚胎发育中发挥重要作用[6-7]. 组蛋白修饰主要包括乙酰化、甲基化、磷酸化、泛素化等,其中组蛋白甲基化在基因表达调控和卵母细胞生长中起重要作用[8]. 组蛋白甲基化受组蛋白甲基化酶和去甲基化酶共同调节,研究表明小鼠卵母细胞中MLL2(H3K4甲基转移酶)的缺乏会直接导致排卵停止和卵母细胞死亡;在MLL2不足的卵母细胞中,H3K4me2/3的表达降低,导致非正常卵母细胞成熟和异常的基因表达,表明了H3K4me2/3水平对小鼠卵母细胞成熟的重要性[9]. 在小鼠和人类干细胞中,大多数H3K4me3对基因表达的调节是维持基本生物学活性和干细胞多能性的关键因素[10]. H3K4me3在囊胚中存在大量表达,说明H3K4me3对胚胎发育和囊胚形成具有重要的调控作用. 尚明保[11]的研究表明,小鼠体内受精胚胎从受精卵到囊胚期的H3K4me3表达水平均高于其在体外受精各期胚胎的表达. 众多研究结果都表明,H3K4me3对卵母细胞成熟和早期胚胎发育具有重要的调控作用.
在人卵母细胞中H3K4me3呈现出动态表达,从GV期到MII期呈现出逐渐降低的趋势,合子期到4-细胞期表达升高,8-细胞期表达最低,囊胚期急剧上升[12]. 在猪胚胎中,H3K4me3表达水平从受精卵时期开始下降,到桑椹胚期至最低水平,随后在囊胚中表达上升[13]. 我们的研究也表明H3K4me3在猪卵母细胞和早期胚胎中呈现出动态表达,但本次试验在猪卵母细胞成熟22 h和MII期并未检测到H3K4me3的表达,与沈开元[1]对猪卵母细胞的研究结果不同,究其原因可能是由于成熟培养液成分不同,从而影响了H3K4me3的表达模式.
CPI-455是一种组蛋白去甲基化酶抑制剂,可特异性抑制KDM5A/B的活性,从而提高H3K4me3的整体表达水平. 本试验在卵母细胞成熟过程中添加CPI-455,抑制了卵母细胞中组蛋白去甲基化酶KDM5A和KDM5B的表达,提高了囊胚中H3K4me3以及相关多能性基因的表达,从而提高了猪卵母细胞体外成熟率和囊胚形成率. 以往的研究也表明,在果蝇卵母细胞中,组蛋白甲基化酶KDM5可调控卵母细胞减数第一次分裂时期中的染色质结构,KDM5缺失会引起H3K4me3表达增加[14]. 通过表达一个显性失活的组蛋白H3突变体抑制H3K4甲基转移酶的活性,会使合子基因组激活失败,损害胚胎的发育[15],这表明动态的组蛋白甲基化修饰H3K4me3对卵母细胞减数分裂和早期胚胎发育至关重要.
