外源海藻糖对NaHCO3胁迫下甘草幼苗生长调节及总黄酮含量的影响
2021-07-19柳福智张迎芳陈垣
柳福智,张迎芳,陈垣
(甘肃农业大学农学院,甘肃兰州730070)
随着工业的发展,盐碱化的土壤面积不断增加。盐碱化导致土壤盐碱组分不断积累[1],盐碱组分超标对植物生长具有严重的抑制作用,会阻碍植物根系的生长,进而导致植株无法正常生长[2]。植物适应盐碱胁迫需要植物体内各种生理生化反应共同调控[3],是一个非常漫长的过程。
甘草(Glycyrrhiza uralensis)是我国的大宗药材,有“国老”之美誉[4]。《本草纲目》有言[5]:“诸药中甘草为君,治七十二种乳石毒,解一千二百草木毒,调和诸药有功。”在我国,甘草大部分生长在内蒙、宁夏、甘肃和新疆等地[6],甘肃甘草的主产区位于河西走廊地区。甘草具有生命力旺盛的根系,对盐碱组分有一定的抗性。在长期的演进过程中,演变成了对逆境条件的顺应激励机制,可以在各种不利条件下生长,成为干旱半干旱地域的重要植物资源之一[7]。甘草除了具备极广泛的药用价值外,还具备极高的生态价值,是防治风沙、水土流失的重要植物[8]。
海藻糖是一种可溶性非还原性糖,大量存在于低等植物、真菌和一些无脊椎动物体内[9]。一些生物体抵抗和忍受恶劣外部环境的能力与它们体内的海藻糖直接相关[10],海藻糖有抗应激作用和显著的抗脱水功能,可以维持蛋白质结构的稳定性,保持细胞膜的完整性[11],有很强的非特异性保护功能。研究发现,小麦(Triticum aestivum)幼苗在高温胁迫下,外源施加适当浓度的海藻糖可增强小麦幼苗内抗氧化物保护酶活性[12],外源海藻糖可以增加低氮胁迫下烤烟(Nicotiana tabacum)叶片的叶绿素含量[13],降低盐胁迫下小麦幼苗的脯氨酸(proline,Pro)含量,提高根系活力[14],在高盐胁迫下外施海藻糖可以通过维持K+/Na+动态平衡,降低拟南芥中Na+的含量,减轻K+的损失,使得植株的抗盐性有所提高[15]。大量试验结果表明,生物体处于盐害[14−15]、低温[16−17]、干旱[18]和重金属超标[19]等恶劣环境下,施加适宜浓度外源海藻糖可以增强植株对逆境条件的耐受力和适应力。然而关于外源海藻糖在NaHCO3胁迫下调控甘草幼苗生长的报道较少。为此,本研究采用甘草无菌苗为试验材料,探讨外源海藻糖对NaHCO3胁迫下甘草幼苗的生长量、渗透调节物质的含量、抗氧化保护酶的活性和甘草总黄酮含量的影响,优选能缓解碱胁迫下甘草幼苗生长的最适海藻糖浓度,为在盐碱地发展高产优质甘草产业提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料与处理
本试验于2019 年3−8 月在甘肃农业大学农科楼中草药实验室进行,甘草种子产自甘肃酒泉,以甘草无菌苗的叶片和根系为供试材料。
挑选适量颗粒饱满、大小均匀的种子,加98%的浓硫酸搅拌加工35 min,无菌蒸馏水清洗5~6 次,76%乙醇浸润1 min,清洗4 次,用0.1%升汞在超净工作台上进行8 min 浸泡消毒,然后用无菌蒸馏水反复清洗至液体变澄清,最后用杀菌消毒的滤纸擦拭甘草种子,以每瓶8 粒种子接种到高压灭菌的MS 培养基(含大量元素N、P、K 和Ca 以及微量元素 I、B、Mn、Mo、Cu、Co 和 Fe),置培养室的培养架上。在光照时长为 12~14 h·d−1、温度为(24±2)℃、湿度为30%~50%的培养室中,使甘草种子发芽生长,待其生长至10、20 和30 d 时,分别测定幼苗叶绿素、丙二醛、渗透调节物质含量、抗氧化酶活性及甘草总黄酮含量,测定生长至20 d 的幼苗生长量。试验共7 个处理:1)CK1(MS 营养液);2)CK2(0 mmol·L−1海藻糖+50mmol·L−1NaHCO3+MS 营养液);3)T1(5 mmol·L−1海藻糖+50 mmol·L−1NaHCO3+MS 营养液);4)T2(10 mmol·L−1海藻糖+50 mmol·L−1NaHCO3+MS 营养液);5)T3(15 mmol·L−1海藻糖+50 mmol·L−1NaHCO3+MS 营养液);6)T4(20 mmol·L−1海藻糖+50 mmol·L−1NaHCO3+MS 营养液);7)T5(25 mmol·L−1海藻糖+50 mmol·L−1NaHCO3+MS 营养液)。每个处理重复 3 次。
1.2 测定指标与方法
1.2.1 甘草幼苗生长量的测定 用无菌滤纸擦拭供试幼苗表面附着的培养基,分离幼苗的地上和地下部分,分别测量其长度、称其鲜重。
1.2.2 叶绿体色素含量的测定[20]采用丙酮法进行叶绿体色素提取,用分光光度法进行叶绿体色素含量的测定。
1.2.3 丙二醛(malondialdehyde,MDA)含量的测定[20]采用硫代巴比妥酸法进行测定。
1.2.4 渗透调节物质的测定 用水浴法进行可溶性糖的提取,用蒽酮法测定其含量[20];用磺基水杨酸法进行脯氨酸提取,用水合茚三酮法测定其含量[21]。采用火焰光度法进行Na+和K+浓度的测定[22]。
1.2.5 抗氧化酶活性的测定 用冰浴研磨、冷冻离心法进行抗氧化酶液的提取。采用NBT 光化还原法测定超氧化物歧化酶(superoxide dismutase,SOD)活性[23];愈创木酚比色法测定过氧化物酶(peroxidase,POD)活性[23];用紫外吸收法测定过氧化氢酶(catalase,CAT)活性[24]。
1.2.6 总黄酮含量的测定 采用超声法[25]进行提取,用紫外分光光度法对甘草幼苗的总黄酮含量进行测定。
1.3 数据处理
采用SPSS 19.0 软件进行数据统计分析,Excel 2010 软件处理数据和绘图,用LSD 法进行方差分析(P<0.05)。
2 结果与分析
2.1 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗生物量的影响
表1 是甘草幼苗生长至20 d 所测的生物量,由此可知,CK2处理长势最弱,T3处理相对于其他6 个处理长势较好。NaHCO3胁迫显著抑制了甘草幼苗的生长,加入外源海藻糖后甘草幼苗生长受抑制作用减弱。与CK1处理相比,CK2处理根长、株高、根系鲜重和全重分别减少了18.88%、23.06%、31.25%和15.70%。梯度浓度外源海藻糖的施加,对甘草幼苗的生物量产生了正面影响,同一时期T1、T2、T3、T4、T5处理与CK2处理相比,根长分别增长了 24.52%、26.44%、29.73%、25.07% 和 20.00%,株高分别增长 27.25%、37.74%、55.14%、29.35% 和22.22%,根系鲜重分别增加了13.63%、29.54%、52.27%、38.63% 和6.81%,全株鲜重分别增加了6.21%、11.72%、19.31%、5.51%和1.38%,综上所知,T3处理最佳。
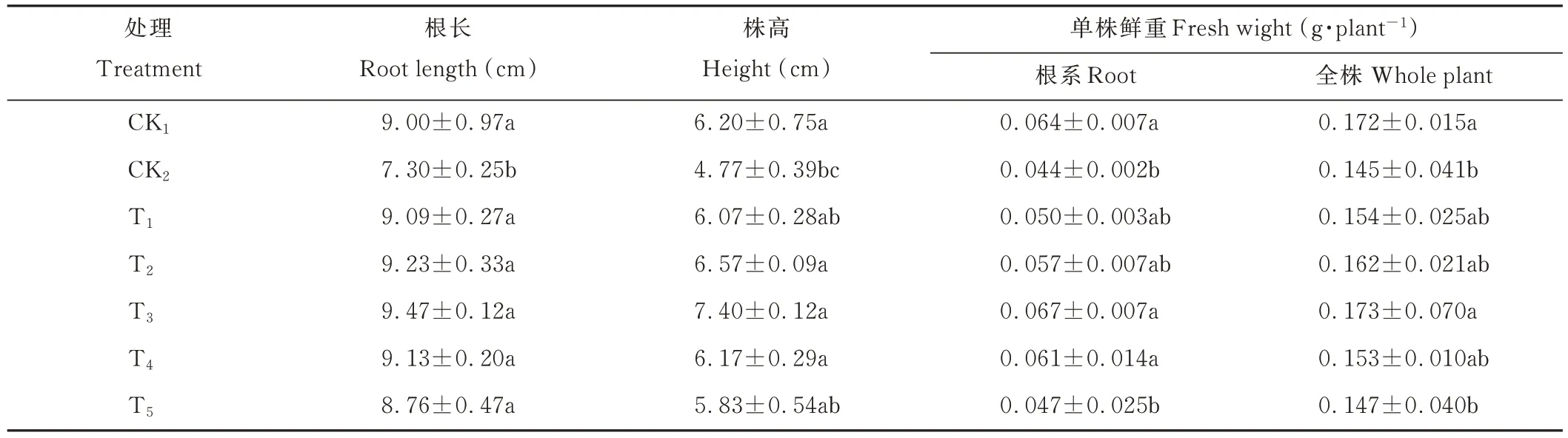
表1 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗生物量的影响Table 1 Effects of trehalose at different concentrations on the biomass of licorice seedlings under NaHCO3 stress
2.2 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗叶片中叶绿体色素含量的影响
图1 表明,随着生长天数的改变甘草幼苗叶片的叶绿素不断积累,NaHCO3胁迫(CK2)处理下甘草幼苗叶片的叶绿素含量均较CK1处理低,生长10、20 和30 d 后,分别较CK1处理减少了52.22%、49.95%、50.93%,与CK1处理均达到显著性差异,说明在NaHCO3胁迫下叶绿素部分被降解;施加不同浓度海藻糖的各处理中叶绿素含量均高于CK2处理,且与其差异显著,其中15 mmol·L−1的海藻糖浓度处理最佳,不同时期,分别较CK2处理增加101.21%、93.52%和92.33%,表明适宜浓度的外源海藻糖能提高NaHCO3胁迫下甘草幼苗叶片叶绿素含量。

图1 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗叶绿素含量的影响Fig. 1 Effects of trehalose concentration on chlorophyll content in licorice seedlings under NaHCO3 stress
2.3 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗丙二醛(MDA)含量的影响
MDA 的积累对植物细胞膜和细胞会造成一定的伤害 ,由图 2 可知 ,甘草 幼苗生长 10、20 和 30 d 后,NaHCO3胁迫下,甘草幼苗的MDA 含量显著高于CK1,分别升高34.38%、28.95%和29.27%,施加不同浓度海藻糖后,MDA 含量变化呈先下降再上升的趋势,T3处理的MDA 含量达到最低值,较CK2处理分别减少了23.26%、18.37%和14.15%。表明NaHCO3胁迫使得甘草幼苗细胞膜受到损伤,施加外源海藻糖能减轻NaHCO3胁迫对甘草幼苗造成的伤害。
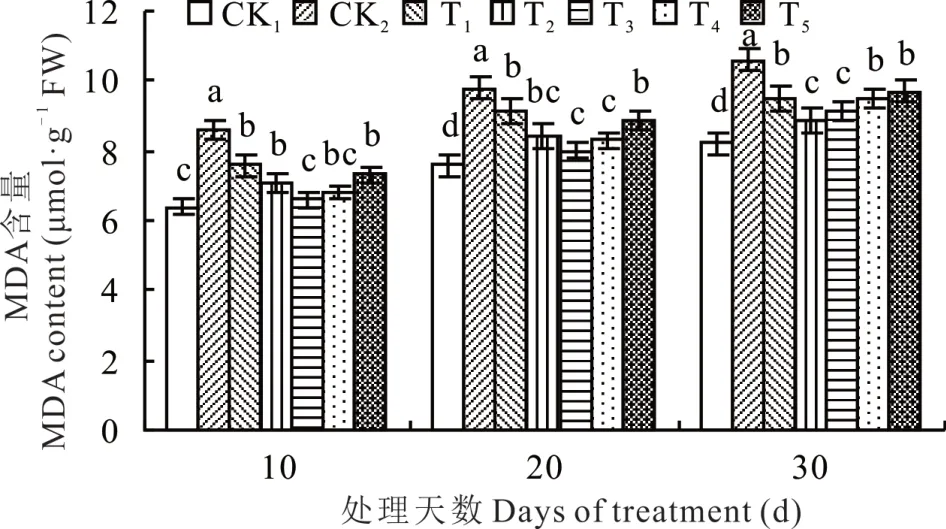
图2 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗MDA 含量的影响Fig. 2 Effects of trehalose at different concentrations on MDA content of licorice seedlings under NaHCO3 stress
2.4 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗中渗透调节物质的影响
图3 显示外源海藻糖对NaHCO3胁迫下甘草幼苗中可溶性糖含量的变化,结果表明,在NaHCO3胁迫下,不同生长天数甘草幼苗内的可溶性糖含量相比空白对照显著增加,生长 10、20、30 d 后,分别增加了44.79%、32.80%和25.31%,当外源海藻糖浓度增加到 15 mmol·L−1时,即 T3处理,甘草幼苗生长 10、20、30 d 后可溶性糖含量与CK1处理相近,分别较CK2减少34.53%、20.48% 和19.21%,说明外源海藻糖对NaHCO3胁迫条件下的甘草幼苗具有缓解效应。

图3 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗中可溶性糖含量的影响Fig. 3 Effects of trehalose at different concentrations on soluble sugar content in licorice seedlings under NaHCO3 stress
由图4 可知,NaHCO3胁迫下甘草幼苗中Pro 含量较 CK1处 理 增 加 ,生 长 10、20、30 d 后 ,分 别 增 加100.28%、82.01%和106.51%,NaHCO3胁迫下施加不同浓度海藻糖后,甘草幼苗中Pro 含量下降,T3处理达到最低水平,随着天数增加,T3处理分别较CK2处理降低61.24%、42.73%和51.01%,且生长到10、20和30 d 时均达到显著水平。
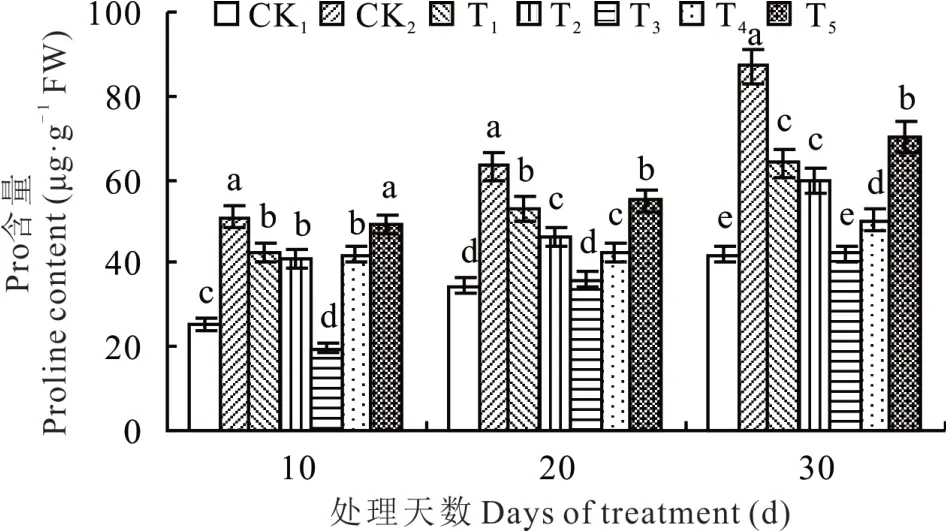
图4 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗中Pro 含量的影响Fig. 4 Effects of trehalose at different concentrations on Pro content of licorice seedlings under NaHCO3 stress
由图5 可知,NaHCO3胁迫下甘草幼苗中Na+浓度显著增加,K+浓度和K+/Na+显著降低,不同生长天数CK2处理的 Na+浓度为 CK1处理的 1.5~2.0 倍,K+浓度和 K+/Na+较 CK1处理分别降低 40%~50% 和71%~73%,表明外源海藻糖可显著降低NaHCO3胁迫下Na+浓度,提高K+浓度,进而提高甘草幼苗中K+/Na+。
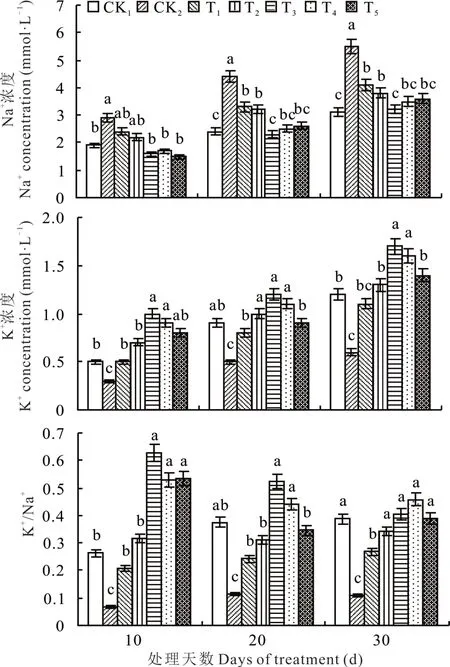
图5 NaHCO3 胁迫下不同浓度海藻糖对甘草幼苗中Na+浓度、K+浓度和 K+/Na+的影响Fig. 5 Effects of trehalose at different concentrations on Na+concentration,K+ concentration and K+/Na+ in licorice seedlings under NaHCO3 stress
2.5 NaHCO3胁迫下不同浓度海藻糖对抗氧化酶活性的影响
由图6 可知,NaHCO3胁迫下甘草幼苗中SOD、POD 和CAT 活性均低于对照,与对照相比,甘草幼苗生长10、20 和 30 d 后,SOD 活性与对照处理相比分别降低了21.91%、31.33%和21.77%,POD 活性分别降低了21.91%、35.89%和29.63%,CAT 活性分别降低了7.49%、8.56%和6.01%。用不同浓度海藻糖处理后 SOD、POD、CAT 活性均显著升高,T3处理达到最佳水平。随着生长天数增加,T3处理与CK2处理相比 ,SOD 活 性 分 别 升 高 112.28%、117.16% 和33.67%,POD 活性分别升高 105.88%、113.76% 和56.98%,CAT 活性 分别升高 50.03%、47.97% 和41.13% 。表明外源海藻糖可通过提高抗氧化保护酶活性而缓解NaHCO3胁迫对甘草生长造成的伤害。
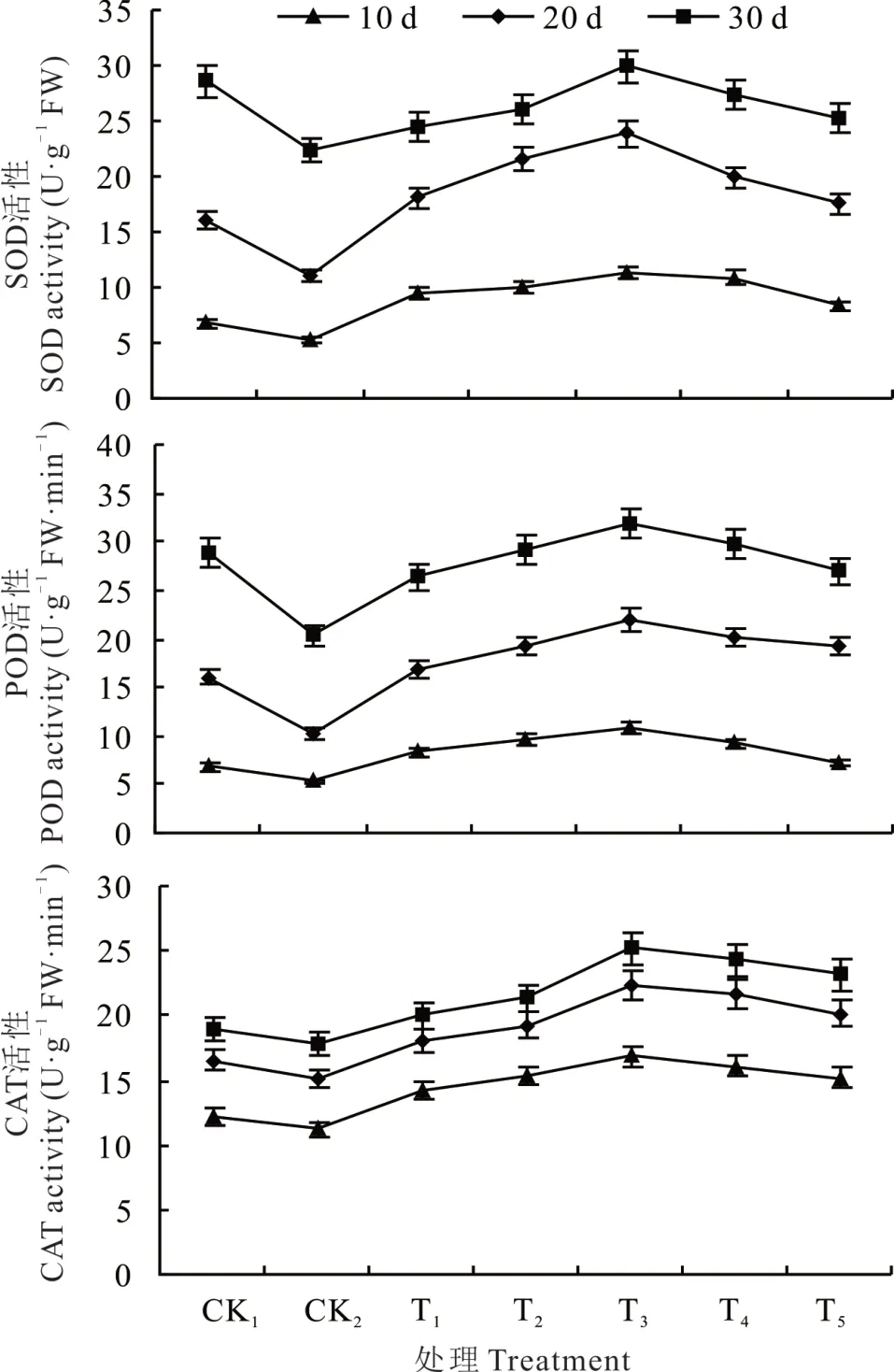
图6 NaHCO3 胁迫下不同浓度海藻糖对甘草幼苗中SOD、POD、CAT 活性的影响Fig.6 Effects of trehalose at different concentrations on SOD,POD,CAT activity in licorice seedlings under NaHCO3 stress
2.6 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗中总黄酮含量的影响
由图7 可知,随着生长天数增加,甘草幼苗中总黄酮含量不断积累,NaHCO3胁迫下甘草幼苗中总黄酮含量显著降低,甘草幼苗生长10、20 和30 d 时,CK2较CK1处理分别减少了72.94%、64.58%和62.66%。施加不同浓度外源海藻糖后,甘草幼苗中总黄酮含量先快速上升后缓慢降低,T3处理比CK1处理稍低,较其他处理显著升高,随着生长天数增加,较CK2处理分别升高2.43、1.48 和 1.56 倍 。
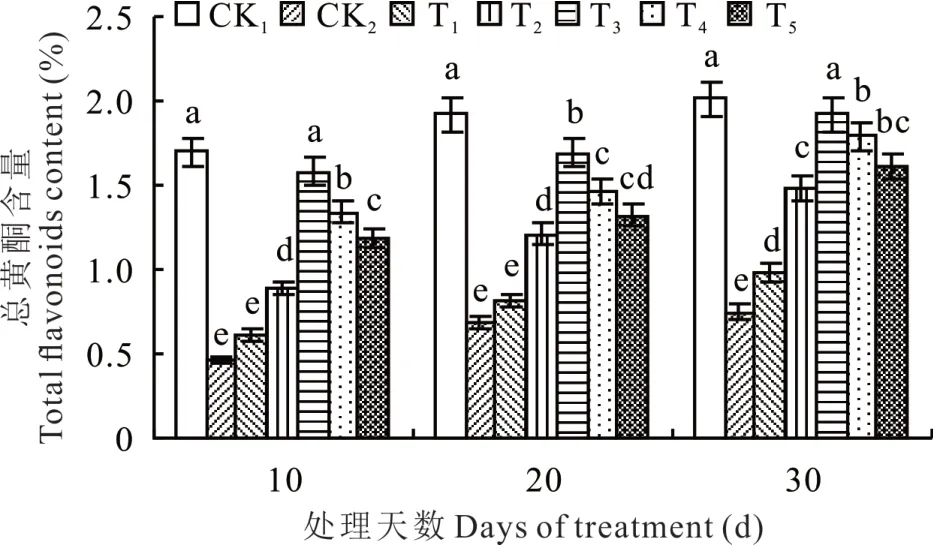
图7 NaHCO3胁迫下不同浓度海藻糖对甘草幼苗中总黄酮含量的影响Fig. 7 Effects of different concentrations of trehalose on total flavonoid content in licorice seedlings under NaHCO3 stress
3 讨论
生物量是植物对盐碱胁迫反应的综合体现,也是评估植物对碱胁迫抗性的直接指标[26]。盐碱组分是抑制植物生长最常见、最主要的非生物因子[27]。已有大量研究表明,碱胁迫可显著降低燕麦(Avena sativa)幼苗和红花(Carthamus tinctorius)幼苗的生物量[28−29]。本研究中,由于在 50 mmol·L−1NaHCO3胁迫下Na+含量过高,致使甘草幼苗严重失水,与甘草幼苗生长所需的其他矿质元素产生拮抗作用,影响幼苗对必须矿质元素的吸收,抑制了甘草幼苗的生长,甘草幼苗的生物量(根长、株高、地上部分的鲜重和幼苗全重)均显著降低。施加外源海藻糖降低了甘草幼苗中Na+的积累,甘草幼苗的生长量有不同幅度的提高,其中15 mmol·L−1的海藻糖增幅最大,为最佳处理浓度,表明施加适宜浓度海藻糖能够缓解NaHCO3胁迫对甘草幼苗生长的抑制作用。
叶绿体色素是绿色植物进行光合作用的物质基础,其含量的高低决定了光合作用的强弱[30]。在本研究中NaHCO3胁迫下叶绿体膜受损,妨碍叶绿体色素的合成,甘草幼苗叶片中叶绿素含量显著降低,施加梯度浓度外源海藻糖后叶绿素含量呈倒V 形变化,可能与海藻糖能够一定程度清除植物体内活性氧有关,从而保护甘草幼苗叶绿体膜的稳定性。
盐碱胁迫会引起植物体内产生大量的活性氧,发生膜脂过氧化反应,导致膜脂过氧化产物MDA 积累,其含量高低可以作为植物膜脂受损伤程度的衡量指标[31]。有研究表明,盐碱胁迫下,施加适宜浓度海藻糖可降低玉米(Zea mays)幼苗[27]和月见草(Oenothera biennis)[32]的 MDA 含量,本研究结果与之一致,NaHCO3胁迫导致甘草幼苗中自由基积累,引发膜脂过氧化作用,甘草幼苗中MDA 含量显著增加,施加15 mmol·L−1外源海藻糖后,MAD含量降到最低,减轻了MDA 对细胞膜的伤害,可能与海藻糖具有很强的抗脱水能力,可以在NaHCO3胁迫下保护生物膜免受伤害有关[33]。
NaHCO3胁迫下,渗透调节物质如Pro、Na+、K+和可溶性糖等,可以调节细胞的渗透势,不会造成细胞严重失水,使生物大分子的功能和结构保持稳定[34]。刘建新等[35]研究发现,施加外源过氧化氢后降低了碱胁迫下燕麦幼苗中Pro 含量和可溶性糖含量。本试验结果与之相似,50 mmol·L−1NaHCO3胁迫下甘草幼苗细胞吸水困难,造成甘草幼苗生理干旱,促进甘草幼苗中Pro 和可溶性糖的积累,其含量的增加可以提高甘草幼苗对NaHCO3胁迫的抵抗能力,施加15 mmol·L−1外源海藻糖甘草幼苗中Pro 和可溶性糖含量显著降低。Na+和K+的代谢具有重要意义,是生物体缓解碱胁迫带来严重危害的生理基础[36]。本研究与赵莹等[37]的研究结果一致,NaHCO3胁迫下施加外源海藻糖可以降低Na+浓度,升高K+浓度和K+/Na+,达到维持K+/Na+动态平衡的目的,从而可以增加细胞质浓度,调节细胞渗透势,减轻NaHCO3胁迫对甘草幼苗的伤害。海藻糖浓度超过15 mmol·L−1后,渗透调节物质对NaHCO3胁迫的缓解作用有所减弱,可能是由于海藻糖浓度过高,镶嵌在甘草幼苗细胞磷脂双分子层上的各种酶结构有所破坏,导致细胞膜受损。
抗氧化保护酶活性的高低与植物耐盐碱的程度有关,可以在一定程度上指示植物遭受胁迫的程度[38]。抗氧化保护酶体系主要组成成分有SOD、POD 和CAT 等,它们使植物体内的活性氧代谢处于动态平衡,从而抵御活性氧自由基对细胞的毒害[39]。研究发现,碱胁迫下黑麦草(Loliumspp.)[40]中 SOD、CAT 和 POD 活性显著降低,本研究结果与其一致,15 mmol·L−1海藻糖处理后,SOD、POD 和 CAT 活性显著增强,POD 可以清除甘草幼苗在NaHCO3胁迫下产生的过多的活性氧,CAT 和POD 可以清除在清除活性氧后所产生的其他自由基,维持了甘草幼苗细胞膜的稳定性和完整性,减轻活性氧对植物造成的伤害,提高甘草幼苗的耐碱性。以此推测,海藻糖提高碱胁迫下甘草幼苗中抗氧化保护酶活性可能与诱导SOD 基因表达有关。
甘草总黄酮目前在美容化妆品中应用极为广泛,因为甘草总黄酮可以抑制络氨酸酶活性、清除氧自由基、抗炎、抗变态,因此可以起到美白褪斑作用。本研究表明NaHCO3胁迫对甘草幼苗中总黄酮含量的积累有很强的抑制作用,15 mmol·L−1海藻糖对这种抑制作用的缓解效果极显著。
4 结论
50 mmol·L−1NaHCO3胁迫对甘草幼苗的生长具有明显的抑制作用,一定浓度的外源海藻糖可以缓解甘草幼苗生长受到的抑制,15 mmol·L−1海藻糖缓解效果最佳。15 mmol·L−1外源海藻糖能够显著提高NaHCO3胁迫下甘草幼苗的生长量,增加甘草幼苗叶片中的叶绿素含量,提高光合产量,有效调节甘草幼苗细胞的渗透势,高效提高抗氧化保护酶活性,维持甘草幼苗生长系统的完整性,还能显著提高甘草黄酮的含量,进而提升甘草的商用价值。
