产硫化氢细菌的筛选及阻控苜蓿吸收铅和改良土壤的作用
2021-07-19周倩倩张亚见张静殷涂童盛下放何琳燕
周倩倩,张亚见,张静,殷涂童,盛下放,何琳燕
(南京农业大学生命科学学院,农业农村部农业环境微生物重点实验室,江苏南京210095)
近年来随着畜牧业的快速发展,牧草的需求量也逐渐扩大,牧草的安全生产也愈受重视。紫花苜蓿(Medicago sativa)被誉为“牧草之王”,广泛种植于世界各地,不仅具有饲用价值,还具有食用和药用价值[1],因此,苜蓿的质量安全与人类健康息息相关。张虎等[2]发现,高浓度Co 胁迫会降低苜蓿幼苗抗氧化系统活性和活性氧清除能力,造成膜脂损伤,从而抑制了紫花苜蓿种子的萌发及幼苗的生长。邱丽莉等[3]通过探究不同Pb2+浓度对苜蓿幼苗生长的影响发现,高浓度Pb2+会影响苜蓿的呼吸强度,降低其叶绿素含量从而抑制苜蓿的生长。研究表明,苜蓿等牧草很容易从土壤和地下水环境中富集铅。生长在铅污染土壤中的苜蓿易受到铅的毒害,从而导致生长缓慢,品质下降,同时也易出现铅超标事件,威胁畜产品安全和人体健康[4]。为了确保苜蓿品质,保障人畜安全,必须减少苜蓿种植环境中的重金属含量,降低重金属向苜蓿的迁移。
土壤环境是植物生长的基础,也是生态环境的重要组成部分,一旦重金属进入土壤环境,很难通过自身的净化能力去除。目前针对重金属污染土壤的修复方法主要有物理、化学和生物修复。其中生物钝化修复成为研究热点,利用钝化金属的细菌来阻控植物吸收、积累重金属成为许多学者不断探索的方向。细菌表面具有许多官能团,能够与重金属结合,竞争吸附土壤中的重金属;有些菌株能够分泌一些胞外聚合物、多胺、硫化氢(H2S)等物质来降低植物根际土壤重金属的有效性[5]。研究表明,H2S 是细菌中重要的信号分子,在介导对生物或非生物胁迫的反应中起着至关重要的作用。最近,已有研究表明,H2S 和下游反应性硫类物质可通过蛋白质组的S 巯基化作用来调节某些细菌毒力基因的表达[6];Huang 等[7]的研究结果表明外源添加H2S 能够增强重金属胁迫下金黄色葡萄球菌细胞的超氧化物歧化酶和过氧化氢酶活性,降低重金属对细胞的毒害,增强细胞的存活率,提高细胞对重金属离子的去除能力。目前关于细菌产H2S 的研究大多与其耐药性有关,在应对重金属胁迫方面研究较少,而且,关于H2S 是否提高微生物的修复效率及相关机理解释还不清楚。
在植物细胞中,H2S 参与植物整个生长、发育、成熟和衰老的过程[8],如促进植物种子萌发[9],调节根的形态建成[10],调控阴离子通道[11]等。此外,H2S 能够提高植物对多种环境胁迫的抗性,包括干旱、高盐、极端温度以及重金属胁迫等[12]。近年来越来越多的学者通过外源添加H2S 的方式来缓解重金属对植物的毒害作用,Cui 等[13]发现,外源添加H2S 能够通过调节Cd 胁迫下苜蓿体内谷胱甘肽和活性氧(reactive oxygen species ,ROS)水平来增强苜蓿对Cd 的耐受性并减少苜蓿幼苗对Cd 的吸收;Fang 等[14]发现,在Pb 和Cd 污染土壤中,外源添加H2S 能够增加Pb 和Cd 胁迫下苜蓿体内叶绿素含量,促进苜蓿生长,提高苜蓿体内抗氧化酶活性,并通过增加污染土壤中过氧化氢酶和多酚氧化酶活性、根际细菌群落,从而减少苜蓿对Pb 和Cd 的吸收。但是外源添加H2S 的方式在生产实际中难以为继,应用很少,需要寻找其他更加可行的方法产生H2S,因此,以微生物产生H2S 具备了潜在应用前景,然而目前关于产H2S 细菌对植物吸收重金属的影响和机制研究鲜有报道。
本研究首先筛选耐重金属的产H2S 细菌,然后采用田间小区试验,以一株高产H2S 细菌为供试菌株,研究其对生长于Pb 污染土壤上的苜蓿吸收、积累Pb 以及土壤理化性质的影响,以期阐明产H2S 细菌钝化修复Pb 污染土壤、减少苜蓿Pb 含量的作用和机制,为今后牧草的安全生产及重金属污染土壤的修复提供理论依据和实践经验。
1 材料与方法
1.1 试验材料
培养基:LB 液体培养基(蛋白粉10 g,酵母粉5 g,氯化钠10 g,去离子水1000 mL,pH 7.0),1/5 LB 固体培养基(蛋白粉2 g,酵母粉1 g,氯化钠1 g,去离子水1000 mL,琼脂粉2 g,pH 7.0),1/5 LB 液体培养基(蛋白粉2 g,酵母粉 1 g,氯化钠 1 g ,去离子水 1000 mL,pH 7.0)。YN 液体培养基(蔗糖 10 g,硫酸铵 1 g,七水合硫酸镁0.5 g,氯化钠0.1 g,磷酸氢二钾 0.2 g,酵母粉 0.5 g,去离子水 1000 mL,pH 7.2)。
供试植物:紫花苜蓿,种子购自江苏省农业科学院种子站。
1.2 铅抗性产硫化氢细菌的分离筛选与鉴定
2019 年4 月1 日,将从云南省兰坪白族普米族自治县某矿区附近农田采集的苜蓿清洗干净,剪取干净完整的根部,用75%乙醇浸泡3 min 消毒,然后用无菌水冲洗3 次。用灭菌后的研钵将根部磨碎并进行适当的稀释,将其涂布于含有 50 mg·L−1Pb(NO3)2的 1/5 LB 固体培养基上,在 30 ℃培养箱中培养 3~5 d 后,挑取单个菌落,再划线纯化2~3 次,然后将菌株保藏备用。
H2S 检测参考Shatalin 等[15]的方法,配置 LB 固体培养基,灭菌后每100 mL 培养基加入1 mL 过滤除菌的10%硫代硫酸钠和醋酸铅,以实验室保存的一株不产H2S 的台湾假单胞菌(Pseudomonas taiwanensis)WRs8 作为对照,用牙签挑取纯化后的单菌落竖直插入H2S 培养基中,置于30 ℃培养箱中培养24 h,观察其颜色变化。以是否产生黑色硫化铅沉淀判断其是否有H2S 产生,以此筛选产H2S 的菌株。
菌株吸附 Pb 能力的测定参考 Han 等[5]的方法,将供试菌株接种于 1/5 LB 液体培养基中,30 ℃,180 r·min−1培养12~16 h 至对数生长中期,离心收集菌体并清洗,用无菌水重悬,然后将菌株接种于含10 mg·L−1Pb(NO3)2的1/5 LB 液体培养基中,以未接菌的培养基作为对照,每个处理设置3 个重复,30 ℃静置培养3 d。培养结束后,取4 mL 发酵液、6000 r·min−1离心10 min、取上清液2 mL,加入2 mL 10%的硝酸,用电感耦合等离子体发射光谱仪ICP−OES(inductively coupled plasma−optical emission spectrometer,Optima 2100DV,Perkin Elmer)测定上清液中Pb2+浓度。
将供试菌株接种于含不同浓度的 Cd(0、10、20、30、40 和 50 mg·L−1)和 Pb(100、200、300、400、500、600、700、800、900、1000 mg·L−1)的 1/5 LB 液体培养基中,以不接菌处理作为对照,30 ℃培养 3~5 d,观察菌株能否正常生长。吲哚乙酸(indole-3-acetic acid,IAA)的测定参考 Jiang 等[16]的方法。铁载体测定参考 Rajkumar 等[17]的方法。脲酶的检测参考 Ignatius 等[18]的方法。
提取供试菌株的总DNA,利用通用引物 27F(正向引物):5′-AGAGTTTGATCC TGGCTCAG-3′;1492R(反向引物):5′-TACGGCTACCTTGTTACGACTT-3′进行PCR 扩增。PCR 产物送至南京金斯瑞公司测序。测序结果用BLAST 软件与Gene Bank 中已知的16S rDNA 序列进行比对分析。
1.3 菌剂的制备
供试菌株经过活化,挑取单菌落接种至新鲜LB 培养基中,置于30 ℃、160 r·min−1摇床上过夜培养18 h,随后6000 r·min−1离心5 min,收集菌体,用生理盐水重悬(保持总体积不变),制得液体菌剂,含细菌数量108cfu·mL−1。将菌液一分为二,一份做活菌液接种,另一份经121 ℃、30 min 高压灭菌,作为灭菌液接种用。
1.4 田间试验
田间试验地点选自江苏省南京市栖霞区某矿区周边一处农田(32°9.7′N,118°56.8′E),土壤基本性质为:土壤总 Pb 含量为 400 mg·kg−1,有机质(11.67±1.49)g·kg−1,pH(6.81±0.05)(土∶水=1 g∶2.5 mL),肥力适中。试验进行前,将所选地块经过除草、翻地、晾干、碎土和平整后,用卷尺分成9 个2 m×3 m 的小区,每个小区之间留下20 cm 的间隙。试验共有3 个处理,分别是不接菌处理组(CK)、接活菌液处理组(Sar15)、接灭菌液处理组(dSar15)。每个处理3 个重复。为了降低地块区域环境对试验结果的影响,采用随机小区分布方式处理。
首先对苜蓿种子进行消毒,用5%的次氯酸钠溶液浸泡5 min,然后用无菌去离子水洗3 次。将牧草种子分别放到活菌液和灭菌液中浸种2 h,最后将种子均匀地撒到每个小区土壤的表面,薄土覆盖,用相对应菌液浇灌,对照浇等量水,再用遮阳网盖住。待种子生长5 d 后,掀开遮阳网,正常生长。同时,在生长的过程中,逐步间苗。整个牧草生长周期共计90 d,期间注意灌溉和除草。
1.5 土壤和植物样品的分析
将苜蓿植株清洗干净,根部用0.01 mol·L−1EDTA-2Na 溶液浸泡10 min,清洗完毕后沥干,称取苜蓿的鲜质量。将苜蓿地上部和根部组织在100 ℃下杀青30 min,然后在80 ℃下烘干至恒重,称取干质量。
将烘干后的地上部和根部组织磨碎,准确称取0.1 g 于微波消解仪中进行消解,5% HNO3定容,用ICP−OES 溶液中测定Pb2+浓度,分别计算苜蓿地上部和根部Pb 含量。
苜蓿Pb 转移系数、富集系数及Pb 的总含量按下面公式计算:
转移系数(translocation factor,TF)=苜蓿地上部 Pb 含量(mg·kg−1)/苜蓿根部 Pb 含量(mg·kg−1),根部富集系数(bioconcentration factor,BCF)=苜蓿根部 Pb 含量(mg·kg−1)/土壤 Pb 含量(mg·kg−1),Pb 总含量(mg)=苜蓿地上部(或根部)Pb 含量(mg·kg−1)×地上部(或根部)干质量(kg)。
DTPA(diethylene thiamine pentacetate acid,二乙烯五乙酸硫胺)提取剂的配制参照Li 等[19]的方法进行。准确称取风干后研磨过0.850 mm 筛的根际土壤,将其与DTPA 提取剂按1∶4 的质量体积比混合,置于160 r·min−1摇床上室温振荡2 h,8000 r·min−1离心后取上清液,用ICP−OES 测定上清液中Pb2+的浓度,并计算每kg 土壤样品中DTPA 提取态Pb 的含量。
使用BCR 分级提取法[20]对根际土壤中Pb 进行分级提取,每步提取完成后,用去离子水清洗,然后5000 r·min−1,离心10 min,将上清液与相应的提取液合并,用ICP−OES 测定Pb 的含量。第1 步为酸可提取态,第2 步为可还原态,第3 步为可氧化态。
将风干并研磨过0.425 mm 筛的根际土壤与去离子水按1∶2.5 的质量体积比混合,置于160 r·min−1摇床上室温振荡 2 h,6000 r·min−1离心 5 min,用 pH 计(Srtourius PB-10,赛多利斯科学仪器有限公司)测定土壤 pH 值。土壤酶活性的测定参考关松荫[21]的方法。
采集0.1 g 各处理组新鲜苜蓿根部,置于2 mL 离心管中加入1.9 mL 去离子水,在超声仪中振荡2~3 min,将此溶液进行梯度稀释,取含菌水溶液涂到加有 100 mg·L−1Pb、50 mg·L−1庆大霉素和 25 mg·L−1氯霉素的 LB 固体平板上,置于30 ℃培养箱中培养3~5 d,进行菌落计数,计算菌株在根表的定殖数目。然后取出根样品,用75%酒精消毒3 min,用无菌去离子水冲洗3 次,加入无菌水研磨并进行梯度稀释,将根匀浆液均匀地涂布在含有100 mg·L−1Pb、50 mg·L−1庆大霉素和 25 mg·L−1氯霉素的 LB 固体平板,30 ℃培养 3~5 d,统计菌落数目,计算菌株在根内的定殖数目。
1.6 数据统计与分析
本研究各处理均重复3 次,利用Microsoft Office 2016 和GraphPad Prism 制表、作图。利用SPSS 25.0 软件对数据进行统计分析,差异显著分析利用t值检验,P<0.05 表示差异显著。
2 结果与分析
2.1 供试菌株的筛选与鉴定
从紫花苜蓿根内分离纯化得到5 株具有较强产H2S 能力的菌株,编号分别为 Mr2、Mr3、Mr11、Mr40和Sar15,图1 为菌株在产H2S 培养基上生长的菌落和产 H2S 特征,其中 Sar15 产 H2S 能力最强。H2S 能与铅产生黑色硫化铅沉淀,培养基颜色变黑表明菌株具有产H2S 的能力,且颜色越深表明菌株产H2S 能力越强。随后对这5 株菌株吸附Pb 特性及生理特性进行了测定,发现除菌株Mr2 外,其余4 株菌株均能显著降低溶液中Pb2+浓度,其降低率为23%~60%,菌株Sar15 处理的溶液Pb2+浓度最低(图2)。5 株菌株均能产IAA、铁载体,菌株Mr3、Mr40 和Sar15 均产脲酶(表1)。通过对这5 株菌株产H2S 能力、吸附Pb 能力及生理特性的综合分析,将菌株Sar15 作为后续试验的供试菌株。16S rDNA 序列与 GeneBank 中彭氏变形菌 NCTC 12737(P. penneriNCTC 12737)的 16S rDNA 序列相似性达99.76%,将其归属为彭氏变形菌,16S rDNA 序列登录号为MT557004。
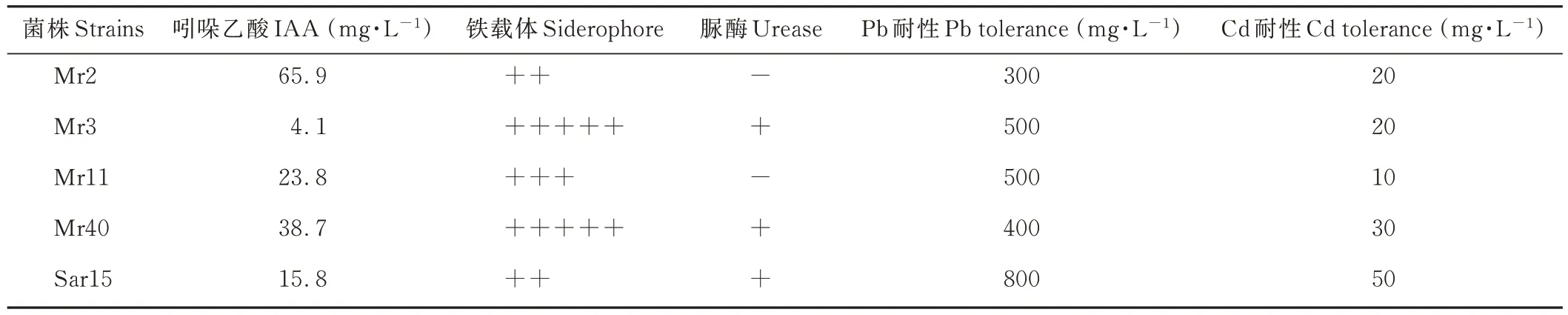
表1 菌株的生理特性Table 1 Physiological characteristics of the isolated strains
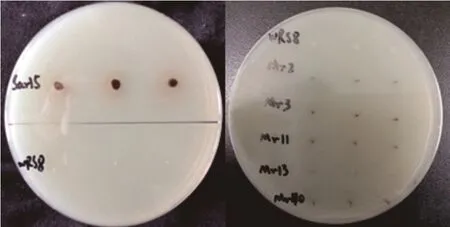
图1 菌株产H2S 特性Fig.1 Hydrogen sulfide-producing characteristics of strains
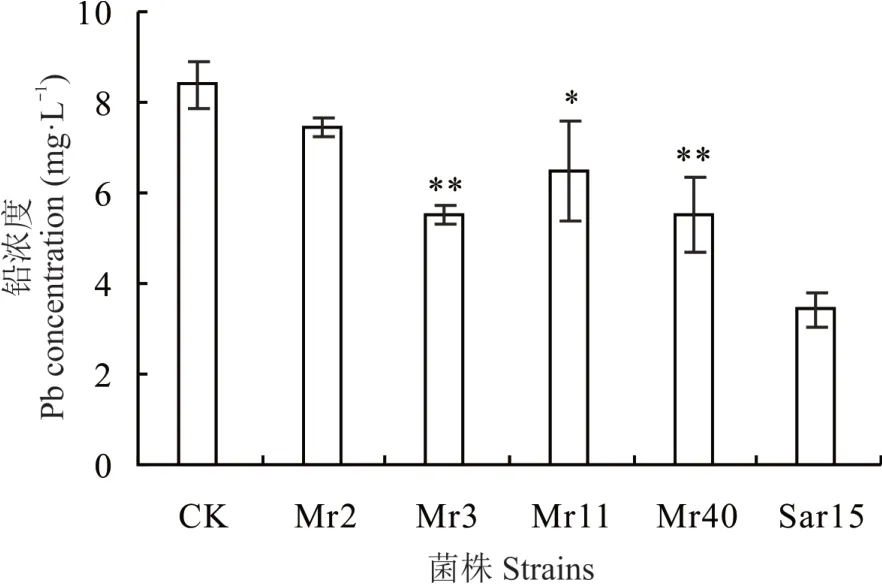
图2 菌株对溶液中铅浓度的影响Fig.2 Effect of strains on the concentration of Pb in solution
2.2 菌株Sar15 对苜蓿生物量和吸收Pb 的影响
在Pb 污染土壤中,与不接菌对照相比,接种活菌Sar15 的苜蓿地上部和根部干重分别显著增加20%和25%;与CK 相比,接种活菌Sar15 处理显著降低了苜蓿组织中的Pb 含量,其中地上部和根部Pb 含量分别下降了44%和45%,地上部和根部Pb 总量分别下降了32%和31%。Sar15 能显著减少紫花苜蓿Pb 的富集系数,与CK 相比,接种活菌Sar15 后苜蓿Pb 富集系数极显著下降了45%(P<0.01),对Pb 转移系数无显著影响。接种灭活菌液对苜蓿Pb 吸收特性无显著影响(表2)。
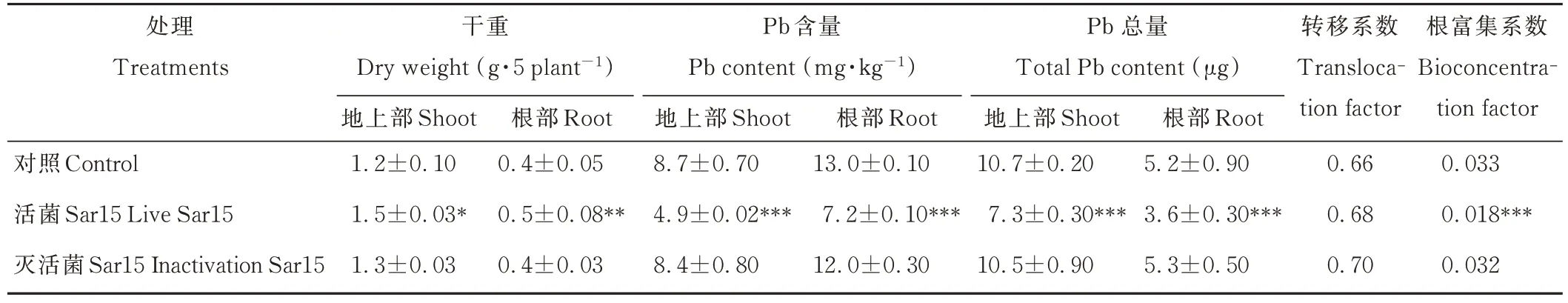
表2 Sar15 对紫花苜蓿干重、Pb 含量、总量、转移系数和富集系数的影响Table 2 Effects of strain Sar15 on the dry weight,Pb content,total content,translocation factor and bioconcentration factor of M.sativa
2.3 菌株Sar15 对紫花苜蓿根际土壤pH、DTAP 提取态Pb 含量和土壤酶活性的影响
通过对牧草土壤pH、DTAP 提取态Pb 含量、脲酶和硫酸酯酶活性测定发现,在Pb 污染土壤中,与CK相比,接种活菌Sar15 能够使苜蓿根际土壤pH 显著提高0.24 个单位(图3A);使得苜蓿根际土壤DTPA 提取态Pb 含量显著降低32%(图3B);接种活菌Sar15 使紫花苜蓿根际土壤脲酶和硫酸酯酶活性分别显著提高了15%和59%(图3C,D)。但接种灭活菌液的苜蓿根际土壤的pH、DTPA 提取态Pb 含量、脲酶和硫酸酯酶活性都没有显著变化。
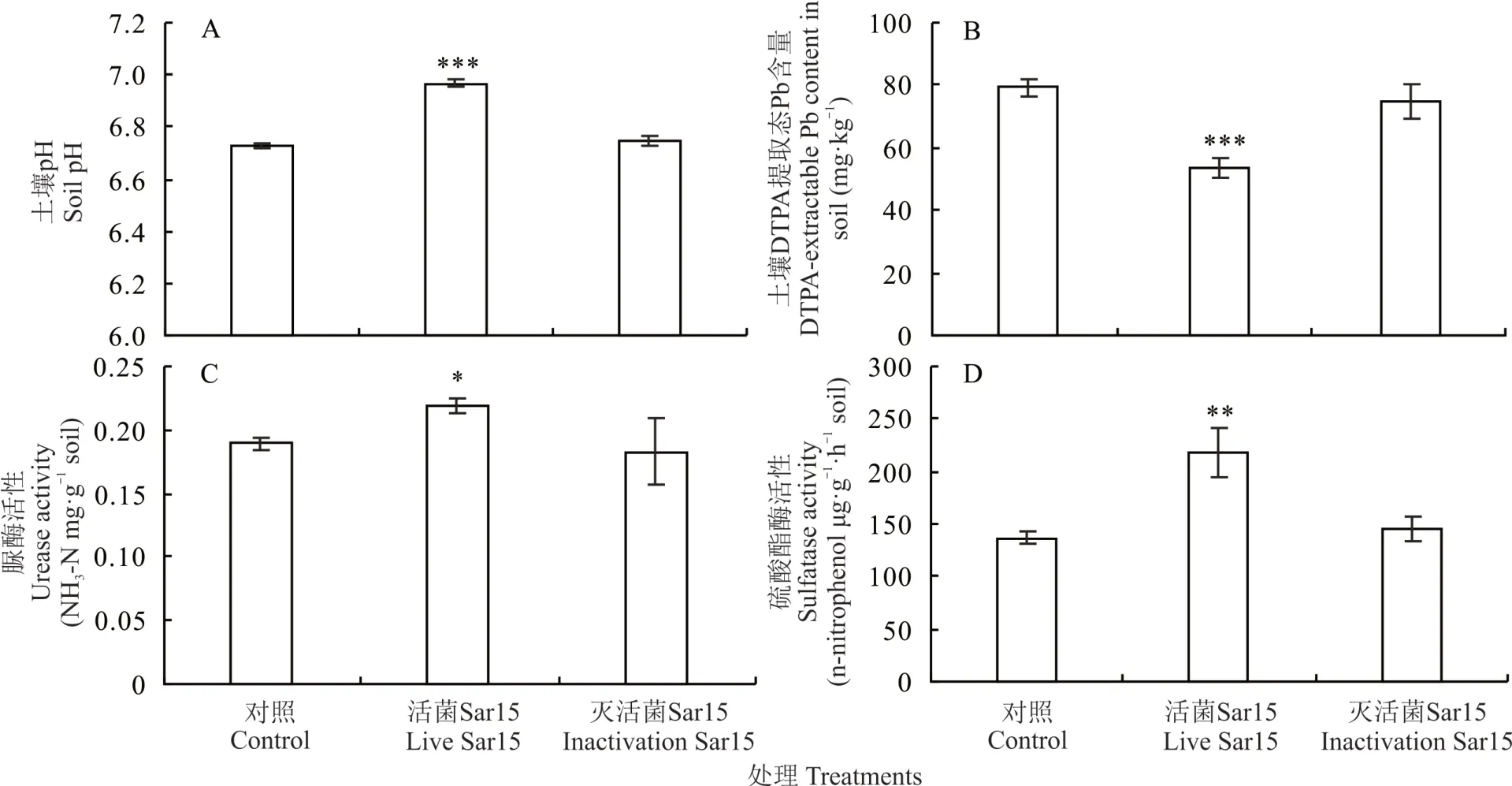
图3 菌株Sar15 对苜蓿根际土壤pH、DTPA 提取态铅含量、脲酶和硫酸酯酶活性的影响Fig.3 Effects of strain Sar15 on pH,DTPA-extractable Pb content,urease and sulfatase activity in rhizosphere soil of M.sativa
2.4 菌株Sar15 对苜蓿根际土壤Pb 形态及含量的影响
在Pb 污染土壤中,与CK 相比,接种活菌Sar15 使苜蓿根际土壤酸可提取态Pb 含量显著降低了43%(图4A);与CK 相比,各处理组对紫花苜蓿根际土壤可还原态Pb 没有显著影响(图4B)。与CK 相比,接活菌Sar15 处理能够显著增加紫花苜蓿根际土壤可氧化态Pb 含量,使得苜蓿根际可氧化态Pb 含量显著增加了33%(图4C)。而接灭活菌液组的紫花苜蓿根际土壤以及非根际土壤Pb 形态没有显著变化。说明Pb 向有机结合态转化,可能受土壤有机物、pH 等变化的影响。
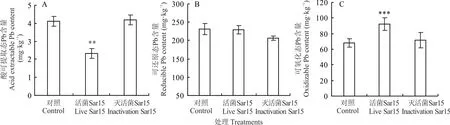
图4 菌株Sar15 对苜蓿根际土壤酸可提取态Pb、可还原态Pb 和可氧化态Pb 含量的影响Fig. 4 Effects of strain Sar15 on the content of acid extractable Pb,reducible Pb and oxidizable Pb in M. sativa rhizosphere soil
2.5 菌株在紫花苜蓿根部的定殖
通过平板计数方法发现,接活菌Sar15 组中在苜蓿根表和根内均能检测到Sar15 菌株,且其在根表的定殖数量可达105cfu·g−1(图5),菌株Sar15 在根表定殖数量大于根内,大量细胞可为土壤提供有机物。对照和接灭活菌液处理组的平板在该数量级没有观察到菌落的形成。
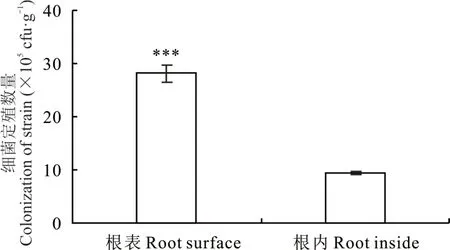
图5 菌株Sar15 在苜蓿根部的定殖Fig.5 Colonization of strain Sar15 in the roots of M. sativa
3 讨论
紫花苜蓿是重要的多年生牧草,在世界范围内分布广泛[22],包括许多被重金属污染的地区。生长在重金属污染土壤的牧草体内重金属含量升高,牧草组织中过多的重金属积累会抑制其生长,降低其产量,并增加重金属进入食物链的风险[23−24]。 因此,提高牧草的生物量和减少牧草组织中重金属的积累是有效和安全使用牧草的重要因素。最近的研究表明,H2S 可以保护植物免受重金属胁迫,例如 Ni[25],Cd[26],Cr[27],Pb[28]和 Zn[29]等,一些学者通过外源添加硫氢化钠生成 H2S,缓解重金属对植物的毒害。但是外源添加剂在生产实际中的应用受到限制,因此,分离筛选具有产H2S 特性的细菌在修复重金属污染土壤方面具有可行性。其中沙门氏菌、爱德华氏菌、亚利桑那菌、柠檬酸杆菌和变形菌等细菌具有产H2S 的特性。本研究从生长在重金属污染地区的苜蓿根内分离筛选到一株产H2S 的细菌Sar15,可以降低溶液中Pb 含量,可能是细菌产生的H2S 与铅形成了硫化铅沉淀,还需收集并检测到硫化铅沉淀加以证实。另外,菌株Sar15 具有合成IAA、铁载体和脲酶的能力,IAA 和铁载体能够促进植物生长和铁素营养、提高植物抗逆性。严警等[30]发现苜蓿中华根瘤菌 D10 具有产IAA 和铁载体的能力,该菌株能够促进苜蓿在Cu 污染土壤中的生长,增强苜蓿对Cu 的耐受性;脲酶可以分解尿素提高环境pH 值。Singh 等[31]通过研究发现,细菌释放的脲酶催化尿素水解为氨(NH3),能够增加溶液或土壤的pH,从而降低重金属的毒性和生物有效性。田间试验表明该菌株不仅可以提高苜蓿的生物量,还能降低苜蓿地上部和根部对Pb 的吸收量,为产H2S 细菌在阻控牧草吸收重金属的应用上提供了试验依据。
根际土壤是指受植物根系直接影响的那部分区域土壤,其区域的重金属形态直接影响到重金属对植物的有效性[32]。本研究发现,菌株Sar15 能够显著增加苜蓿根际土壤的pH、脲酶和硫酸酯酶活性,降低土壤DTPA 提取态铅含量。土壤脲酶能够作用于土壤有机物质中的C−N 键,从而促进土壤中尿素水解成氨,加速土壤中的氮循环,脲酶活性增加可能是土壤pH 升高的一个重要原因。土壤pH 一般与酸可提取态重金属含量呈负相关,而与可氧化态和可还原态重金属呈正相关。酸可提取态主要包括水溶态、可交换态及碳酸盐结合态,这一形态重金属对环境较敏感,易于迁移转化,容易被植物吸收;可氧化态重金属在土壤中主要表现为有机结合态,是土壤中各种有机物,动植物体腐殖质及矿物颗粒等包裹重金属形成的螯合物[33],随着土壤pH 值的升高,土壤中存在的有机物重金属络合物会逐渐稳定,有机结合态重金属含量增多。土壤可还原态重金属在土壤中主要表现为铁锰氧化态,土壤中pH 值和氧化还原电位较高时有利于铁锰氧化物的形成。细菌胞外分泌物如H2S 等与土壤中重金属形成沉淀,降低重金属有效性。本研究发现,接菌处理使苜蓿根际土壤中可氧化态Pb 含量增加,但可还原态Pb 变化无差异,推测细菌及其代谢物可与Pb 形成螯合物并以有机结合态的形式固定在土壤中,没有明显铁锰氧化物形成。土壤中的硫酸酯酶通常来自微生物,参与土壤中的硫素循环,催化土壤中的有机硫经中间体H2S 转化为无机硫酸盐形式被植物吸收[34]。菌株Sar15 能够显著增加苜蓿根际土壤硫酸酯酶活性,因而可能增加苜蓿硫素营养,从而增强苜蓿抗逆性,可进一步研究苜蓿硫素养分循环来阐明功能菌株阻控苜蓿吸收重金属的机理。此外,微生物在土壤中的生存能力是微生物修复重金属污染土壤的基础[35],菌株在植物根部大量聚集而发挥作用[5]。菌株Sar15 能够在苜蓿根内及根表定殖,有利于细菌发挥作用。
4 结论
本研究从受污染土壤中生长的紫花苜蓿根内筛选到了一株高产H2S 且可降低溶液中Pb 含量的菌株Sar15,在Pb 含量为400 mg·kg−1的土壤中,接种菌株Sar15 能够极显著降低紫花苜蓿地上部Pb 含量、根际土壤有效态Pb 含量,提高土壤pH、土壤脲酶及硫酸酯酶活性,降低酸可提取态Pb 含量,提高可氧化态Pb 含量,促进苜蓿的生长,为Pb 污染环境中牧草的安全生产提供实践经验。
