维生素C对酒精性肝损伤大鼠肠道菌群的影响
2021-07-19匡逸静谢安琪陶泳兵李永儒
◎匡逸静,谢安琪,田 鹏,陶泳兵,沈 奎,李永儒,杨 艳
(1.西南医科大学 公共卫生学院预防医学专业,四川 泸州 646000;2.西南医科大学 公共卫生学院卫生检验与检疫教研室,四川 泸州 646000;3.西南医科大学 公共卫生学院营养与食品卫生教研室,四川 泸州 646000)
酒精性肝病(Alcoholic Liver Disease,ALD)是指长期摄入酒精所引起的肝脏损伤性疾病,其发病率和死亡率在全球都处于较高水平。动物实验和人群研究均显示,ALD 与肠道菌群紊乱相互影响[1],肠道菌群紊乱可由酒精诱导产生,而其在ALD 的发病和转归过程中又起着重要的作用,其机制可能与乳酸杆菌等肠道菌群的生长被抑制有关[2-3]。维生素C 作为一种对氧自由基有很强的清除作用的高效抗氧化剂,它可以通过减轻氧化应激反应,促进受损组织细胞的修复,对酒精引起的肝损伤具有保护作用[4];维生素C还可提高肠黏膜的屏障功能,从而降低肠源性感染发生率,肠道内细菌移位可被抑制,同时保护肠黏膜[5-6]。实验采用酒精灌胃法复制大鼠酒精性肝损伤模型,给予低、中、高剂量维生素C 干预,验证维生素C对酒精性肝损伤保护作用,同时进一步探索维生素C对酒精性肝损伤大鼠肠道菌群的影响,为治疗ALD 与发现新的潜在作用靶点提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物
SD 雄性健康大鼠52 只,体重150~180 g,成都达硕公司提供,实验动物生产许可证:SCXK(川)2015-030,实验动物使用许可证:SYXK(川)2018-065。
1.1.2 试剂
56%vol 红星二锅头白酒(北京红星股份有限公司);维生素C(分析纯,西陇科学股份有限公司);谷丙转氨酶(Alanine aminotransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)、丙二醛(Malondialdehyde,MDA)、超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒均购于南京建成生物工程研究所;伊红美蓝培养基(Eosin-methylene blue medium,EMB)、BEA 琼脂培养基、LBS 琼脂培养基、BL 琼脂培养基平板计数琼脂(Plate Count Agar,PCA)均购于青岛海博生物科技有限公司。
1.2 仪器与设备
Versamax 连续波长酶标仪( 美国Molecular Devices 公司)、5810R 冷冻型台式大容量高速离心机(德国Eppendorf 公司)、LD4-2A 型台式低速离心机(北京众益中和生物技术有限公司)、HH-8 数显恒温水浴锅(常州国华电器有限公司)、LRH-150 生化培养箱(上海一恒科学仪器有限公司)、GR85DA 全自动高压灭菌器(美国致微仪器股份有限公司)及HG-9240A 鼓风干燥箱(上海一恒科学仪器有限公司)[7]。
1.3 方法
1.3.1 动物分组
适应性喂养一周后,将52 只雄性SD 大鼠按体重随机分为5 组,据实验经验,酒精模型组大鼠易死亡,故除酒精模型组为12 只大鼠外,其余每组10 只大鼠,其中4 组复制酒精性肝损伤模型:酒精模型组(以下简称模型组),维生素C 低、中、高剂量干预组(以下简称低、中、高剂量组),另设正常对照组(以下简称正常组)。
1.3.2 造模与干预
有研究显示,在酒精性肝损伤相关实验研究中梯度酒精灌胃的造模方式优于固定酒精灌胃造模方式[8],故采用屈胜胜等人所用的梯度酒精灌胃法复制酒精性肝损伤大鼠模型[9]。除正常组以外,其余各组以56%vol 白酒灌胃,白酒灌胃剂量为第1 周6 mL·kg-1,第2 周8 mL·kg-1,3 周~6 周10 mL·kg-1。维C 低、中、高剂量组分别按大鼠体重20 mg·kg-1·d-1、100 mg·kg-1·d-1、500 mg·kg-1·d-1灌胃维生素C。维生素C 溶液现配现用。正常组和模型组给予等量蒸馏水灌胃,5 h后灌胃白酒,持续6 周。实验过程中对各组大鼠的一般情况,包括毛色、摄食、精神状态及活动情况等进行观察并记录,每周称重。
1.3.3 标本的采集、制备与检测
按培养基说明书配制不同菌种专用培养基,实验最后一天,无菌操作采集各组大鼠新鲜粪便,称重,10 倍系列稀释至10-7g·mL-1。分别取10-5g·mL-1、10-6g·mL-1、10-7g·mL-1浓度的20 μL 粪便稀释液涂布于PCA 培养基(检测需氧菌,37 ℃培养48 h),LBS 琼脂培养基(检测双歧杆菌,37 ℃厌氧培养48 h),BL 琼脂培养基(检测乳酸杆菌,37 ℃厌氧培养48 h),分别取10-4g·mL-1、10-5g·mL-1、10-6g·mL-1浓度的20 μL粪便稀释液涂布于EMB 培养基(检测大肠杆菌,37 ℃培养48 h)、BEA 培养基(检测肠球菌,37 ℃培养48 h);每个稀释度做两个重复。按照前述培养条件培养后进行菌落计数。结果取对数,表示为lgCFU·g-1。
末次灌胃结束后禁食禁饮12 h,动物称重麻醉(按体重腹腔注射1%戊巴比妥钠,4 mL·kg-1),腹主动脉采血,3 000 r·min-1离心10 min 后取血清,按试剂盒说明检测AST、ALT、SOD、MDA。采血完毕后处死大鼠,迅速取出大鼠完整肝脏,冷生理盐水冲洗滤干,称重,并按式(1)计算大鼠肝体比。

1.4 统计学处理
使用Excel 2016 进行实验数据录入和整理,SPSS 22.0 统计软件进行分析。采用±s作统计描述,单因素方差分析作统计推断,LSD法(最小显著性差异法)作两两比较。以P<0.05 为差异有统计学意义。
2 结果与分析
2.1 维生素C对酒精性肝损伤大鼠一般情况的影响
正常组毛发光滑,活跃,对外界刺激反应灵敏,食欲佳,体重稳定增长。随着灌胃时间的延长,模型组出现毛色无光泽、反应迟钝、精神萎靡、食欲不佳、体重减少及嗜睡等现象,甚至翻正反射暂时性消失,0.5~1.5 h 后恢复正常,灌胃时挣扎剧烈,灌胃后站立不稳,实验中模型组2 只大鼠死亡。维生素C 干预组大鼠精神、食欲及活动状态较模型组稍好,但比正常组差。
2.2 维生素C对酒精性肝损伤大鼠肝体比的影响
与正常组大鼠相比,模型组、维生素C 干预组肝体比均增高(P<0.05);与模型组大鼠相比,维生素C 干预组的肝体比均降低(P<0.05);各维生素C 干预组大鼠肝体比无差异(P>0.05),具体检测结果见表1。

表1 维生素C对酒精性肝损伤大鼠肝体比的影响表(n=10)
2.3 维生素C对酒精性肝损伤大鼠血清AST、ALT 的影响
与正常组比较,模型组、维生素C 干预组血清AST、ALT 均升高(P<0.05);与模型组相比,维C 干预组的大鼠AST、ALT 均降低(P<0.05);中剂量组ALT、高剂量组AST、ALT 均低于低剂量组(P<0.05),其余维C 干预组AST、ALT 两两比较无差异(P>0.05)。具体检测结果见表2。
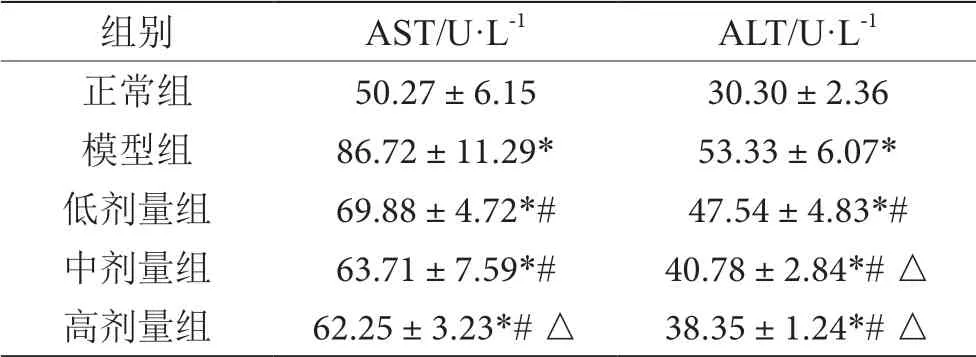
表2 维生素C对酒精性肝损伤大鼠血清AST、ALT 的影响表(n=10)
2.4 维生素C对酒精性肝损伤大鼠血清SOD、MDA 的影响
与正常组相比,模型组、各维生素C 干预组血清SOD 均降低,MDA 均升高(P<0.05);与模型组相比,低、中、高剂量组SOD均升高,MDA均降低(P<0.05);与低剂量组相比,高剂量组SOD 升高,中剂量组和高剂量组MDA 均降低(P<0.05),高剂量组SOD 高于中剂量组(P<0.05),其余维C 干预组SOD、MDA 两两比较无差异(P>0.05)。具体检测结果见表3。

表3 维生素C对酒精性肝损伤大鼠血清SOD、MDA 的影响表(n=10)
2.5 维生素C对酒精性肝损伤大鼠肠道菌群的影响
与正常组相比,模型组大鼠肠道中的需氧菌、大肠杆菌、肠球菌数量均增加,乳酸杆菌和双歧杆菌数量均减少(P<0.05);与模型组相比,维C 干预组需氧菌、大肠杆菌、肠球菌均减少,乳酸杆菌均增加(P<0.05),双歧杆菌除低剂量组与模型组之间无差异外,中、高剂量组较模型组均增加(P<0.05);与低剂量组相比,中剂量组大肠杆菌减少,乳酸杆菌增多,高剂量组的需氧菌、大肠杆菌、肠球菌均减少,乳酸杆菌、双歧杆菌均增加(P<0.05);高剂量组与中剂量组比较除肠球菌减少(P<0.05)外,其余菌种均无差异。具体检测结果见表4。

表4 维生素C对酒精性肝损伤大鼠肠道菌群数量的影响表(单位:lgCFU·g-1,n=10)
3 结论与讨论
酒精进入人体后90%~98%的氧化代谢都是在肝脏中进行,肝脏在酒精代谢过程中至关重要。许多研究显示,氧化应激是ALD 重要的发病机制之一[10],SOD 是细胞内抗氧化酶系中最重要的一种酶,正常肝脏内存在的SOD 能够清除自由基起到抗氧化的作用,而酒精的摄入引发自由基攻击健康肝细胞,消耗大量SOD,产生脂质过氧化物,MDA 是生物体脂质过氧化的标志物。实验采用梯度酒精灌胃方式复制酒精性肝损伤大鼠模型,将大鼠AST、ALT 升高及大鼠肝体比升高作为判断肝细胞损伤的标准[11],将SOD 降低和MDA 增加作为机体抗氧化失衡的标志。实验中模型组大鼠出现精神萎靡、食欲不佳、毛发发黄、肝体比升高现象,血清检测结果显示,模型组大鼠AST、ALT、MDA 升高,SOD 降低,说明大鼠肝细胞损伤,出现抗氧化失衡,酒精性肝损伤模型造模成功。实验结果显示各维C 干预组大鼠血清AST、ALT、MDA和肝体比均降低,SOD 升高,且呈现一定剂量反应关系,说明维生素C 对于酒精造成的大鼠肝损伤具有保护作用,与相关研究结果一致[1,6,12]。
肝脏具有特殊的生理结构,有动静脉和门静脉两个血液循环系统,通过门静脉收集各消化道回流的血液,这使肝脏在吸收肠道营养物质的同时,也暴露于来自肠道的有害微生物产物之中[13]。肝脏特殊的生理结构使其与肠道关系密切,称为“肝-肠”轴,也说明ALD 的发病与肠道微生态失调有密切关系[14-15]。在正常情况下,肠道菌群处于一种动态的平衡中,肠道中的双歧杆菌和拟杆菌具有维护肠道黏膜屏障功能和完整性的作用,而大肠杆菌等革兰氏阴性菌能够产生内毒素,如脂多糖(LPS)可介导炎症反应,降低肠道黏膜通透性[16-17]。许多研究已证实长期饮酒的人群和ALD 患者存在体内大肠杆菌、肠球菌等有害菌数量增加,而双歧杆菌、乳酸杆菌等有益菌数量减少的现象,在实验中模型组也出现了同样的结果,这说明酒精性肝损伤大鼠出现了肠道菌群的失调[4]。酒精进入机体后代谢产生的乙醛,在直接引起肝脏损伤的同时,也可以诱发肠道的炎症反应,增加肠道黏膜的通透性,由于肠道菌群结构改变,内毒素生成增多,大量LPS 通过肠道黏膜屏障借助门静脉循环到达肝脏,加重肝脏的炎症反应,从而促进ALD 的发生。实验发现,维生素C 干预组大鼠肠道的乳酸杆菌和双歧杆菌的数量较模型组显著增多,高剂量组甚至恢复到正常组水平,而需氧菌、大肠杆菌和肠球菌显著减少,各干预组之间呈现一定的剂量反应关系,与相关人群研究结果类似[4],说明维生素C对酒精性肝损伤大鼠的肠道菌群失衡有改善作用。
维生素C 可有效降低大鼠血清转氨酶含量,调节机体抗氧化失衡,改善酒精引起的大鼠肝脏损伤,其作用机制可能是:维生素C 通过调节肠道菌群结构,增加有益菌(如乳酸杆菌、双歧杆菌)数量,减少有害菌(如需氧菌、肠杆菌、肠球菌)数量,改善肠道菌群失调,保护肠道黏膜,促进肝脏损伤的恢复。
