术中唤醒麻醉联合多模态影像在再次切除脑复发胶质瘤中的应用:20例患者2年随访
2021-07-18马亚宾宁泽乾贺龙双钟德泉
周 辉,马亚宾,宁泽乾,贺龙双,钟德泉
广东药科大学附属第一医院神经外科,广东 广州 510000
脑胶质瘤是神经系统最常见恶性肿瘤之一,约占颅内肿瘤的50%。临床常采用以手术为主联合术后放化疗的综合治疗方式[1],术中肿瘤切除程度就成为神经外科医生面临的挑战,切除范围不足术后极易复发,切除范围过大易造成神经功能损伤,因此,术中唤醒麻醉、神经导航、神经电生理、术中MRI以及肿瘤黄荧光等新技术已被广泛应用于切除脑胶质瘤的手术中,有助于安全、最大范围地切除肿瘤[2-3],但在复发胶质瘤的再次手术中的应用未见报道。近年来研究表明,对复发胶质瘤患者实施再次手术仍是延长患者生存时间的主要手段。然而由于复发胶质瘤解剖结构的改变,如何在再次手术过程中保护脑功能,最大程度地切除复发肿瘤,同样是有效提高患者生存质量的关键[4]。本研究通过回顾性分析我院20例再次手术的复发脑胶质瘤患者的临床资料,探究术中唤醒麻醉结合多模态影像在胶质瘤复发再次手术中应用的临床效果。
1 资料与方法
1.1 一般资料
选取2017年1月~2020年12月我科手术治疗的复发胶质瘤患者20例,其中应用术中唤醒麻醉技术结合多模态影像进行手术的6例作为唤醒麻醉组,应用气管全麻结合多模态影像手术的14例作为常规手术组。纳入标准:年龄≥18岁,无明确的精神病史或严重精神症状者;第1次手术病理报告为胶质瘤,复发病灶位于幕上脑叶者;意识清醒,认知功能基本正常,自愿接受术中唤醒麻醉者。排除标准:年龄<18岁或有明确精神病史者;认知功能差,术前不能配合完成指定任务者;复发病灶位于脑室或基底节区者;伴有严重心、肺、肝、肾功能障碍或其他不适合接受神经外科开颅手术者;拒绝接受术中唤醒麻醉者。
20 例患者WHO 分级:Ⅰ~Ⅱ级7 例,Ⅲ~Ⅳ级13例。部位包括额叶9例,颞叶6例,顶叶1例,枕叶1例,跨脑叶3例。肿瘤复发距离首次手术治疗时间5~29月(14.65±7.64月);术前karnofsky功能状态评分(KPS)80~100分(93±5.71分)。两组患者术前一般资料对比,各项指标差异无统计学意义(P>0.05,表1)。
1.2 术前准备
术前行头颅1.5 T或3.0 T MRI检查,包括平扫、增强、磁共振弥散张量成像(DTI)、及血液氧饱和水平监测,评估病灶与脑功能区及神经纤维束走行关系。术前向患者解释手术过程及可能会出现的不适,让患者做好充分的心理准备,采用简易智力状态检查(MMSE)及KPS评估患者认知和功能状态。术前1 d对患者进行语言任务培训,包括简单数学计算、定向力、图片命名及文字阅读。1%荧光素钠注射液5 mL静推皮试,术前按5 mg/kg使用丙戊酸钠注射液预防癫痫。
1.3 手术方法
麻醉开始前,按5 mg/kg静脉注射10%荧光素钠,喉罩插管,用丙泊酚行全身麻醉,同时静脉泵入瑞芬太尼镇痛,监测脑电双频谱指数(BIS),待BIS值下降至60后用罗哌卡因行头皮局部麻醉,固定头架,神经导航注册定位肿瘤体表投影,依据原手术切口设计入路,开骨瓣,悬吊硬膜,0.25%罗哌卡因棉片贴敷硬膜10 min。减少麻醉药物,拔除喉罩,待BIS值>60时开始唤醒患者,待BIS值>80及患者能正确应答指令性动作时视为唤醒成功。剪开硬膜,用术中超声再次确认肿瘤边界后,与导航图像融合后引导定位运动或语言功能区后,使用术中脑电监测设备(Endeavor,尼高力,美国)在皮层以2 mA、60 Hz、1 ms双相方波进行刺激,并逐渐增减至5 mA,观察术中患者计数或阅读的连贯性,以及对侧面部、肢体、手指及足趾的运动情况,以患者出现有计数中断、语言延迟、命名错误及语序中断、肢体抽搐或无力时,判定为相应的语言和运动中枢,并予以标记。然后保护该区域,常规切除肿瘤,切除大部分后,荧光显微镜(蔡司Pentero 900,德国)下,参考肿瘤周边弱荧光或无荧光确定切除边界,最后关颅。
常规手术组患者则常规插管全麻后,原手术切口入路,同样在导航引导下,荧光显微镜下根据荧光染色辨别肿瘤边界进行切除。
1.4 术后评估和随访
所有患者术后均按我院胶质瘤术后患者进行一致化管理,术后72 h内复查头颅MRI了解肿瘤切除情况,通过开放性3D-slicer软件勾勒术前和术后MRI影像获得肿瘤体积,计算肿瘤减负率。肿瘤减负率(%)=(术前肿瘤体积-术后肿瘤体积)/术前肿瘤体积×100%。记录术后第1周的MMSE和KPS评分,均建议患者进行放化疗。
随访:患者术后第3月复查头颅MRI,每3月进行1次电话随访,记录患者的生存情况和生活质量。与术前相比,术后3月内能恢复至术前水平的神经功能障碍为近期神经功能障碍,大于3月未恢复者为远期神经功能障碍。
1.5 统计学分析
采用SPSS22.0软件对数据进行统计学分析。符合正态分布的连续计量资料以均数±标准差表示,组间比较行独立样本t检验。计数资料以n(%)表示,组间比较行χ2检验。使用Kaplan Meier法绘制生存曲线,两组间比较行Logrank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 术中患唤醒状态、功能区定位情况
所有患者手术均顺利进行,唤醒麻醉组患者配合术者指令动作良好,BIS意识监测数值均在80分以上(图1A),无唤醒失败病例,术中无癫痫发作、脑膨、寒颤等并发症。术中电刺激确定语言功能区1例,运动功能区1例(图1B~C),术中参考神经导航结合术中超声、肿瘤荧光等多模态影像切除肿瘤(图1D~F)。
2.3 术后肿瘤切除程度及并发症
术后病理均为胶质母细胞瘤,WHO Ⅳ级。术后72 h内复查头颅MRI见肿瘤基本大部分切除(图2)。根据3D-slicer软件测量显示,6例唤醒麻醉组患者的肿瘤体积范围为48.5~145.6 cm3(中位体积57.4 cm3),术后残留肿瘤体积为5.3~13.5 cm3(中位体积6.7 cm3);肿瘤减负率为86.6%~95.7%。14例常规手术组患者的肿瘤体积范围为45.7~136.7 cm3(中位体积67.8 cm3),术后残留肿瘤体积为6.7~37.6 cm3(中位体积21.5 cm3);肿瘤减负率为67.8%~85.3%(图3)。

图2 唤醒麻醉下复发胶质瘤的切除程度Fig.2 Resection degree of recurrent glioma under awake anesthesia.

图3 3D-slicer绘制肿瘤体积Fig.3 The tumor volume was calculated by 3D-slicer.***P<0.01.
2.4 术后患者MMSE、KPS评分及预后对比
唤醒麻醉组无术后并发症及死亡病例,常规手术组出现神经功能近期障碍者1例(肢体肌力下降)。术后1周患者的MMSE、KPS评分与术前相比明显降低(P<0.05),唤醒麻醉组差异无统计学意义(P>0.05,图4)。
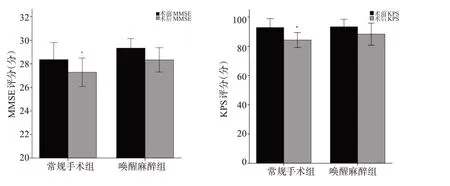
图4 两组患者手术前及术后MMSE、KPS评分对比Fig.4 Comparison in MMSE,KPS before and after operation between the two group.*P<0.05.
两组患者术后随访时间3~24月,其中常规手术组随访时间12.57±4.81月,唤醒麻醉组随访时间11.67±6.80月,两组患者无进展生存率和总生存率差异无统计学意义(P>0.05,图5)。

图5 两组复发脑胶质瘤患者无进展生存率(A)和总生存率(B)的Kaplan Meier生存曲线图Fig.5 Kaplan Meier survival curve of progression free survival (A) and overall survival (B) in two groups of patients with recurrent glioma.
3 讨论
脑胶质瘤是中枢神经系统最常见的一类原发恶性肿瘤,显微手术切除辅以术后放化疗是目前公认的治疗金标准[5-6]。然而由于胶质瘤常呈浸润性生长,术中难以区分正常组织和肿瘤组织边界,因此手术难以彻底切除肿瘤,导致术后极易复发,严重影响患者生存时间[7]。现阶段对于复发性胶质瘤的最佳治疗方法,特别是在再次手术方面尚无共识[8]。有学者认为第1次手术后的大脑解剖结构的改变,再次手术的神经功能缺损发生率高于第1次手术后,从而降低患者的生活质量,增加家庭的经济负担[9-10];但也有学者对400例复发性高级胶质瘤病例进行了回顾性分析,发现在重复手术中肿瘤的切除程度是预测患者生存期的一个独立因素[11]。有研究也证明了无论年龄和功能状态如何,只要无明显手术禁忌证,均可重复手术切除复发病灶,甚至高达4次,有利于增加患者的生存机会[12]。可见,如何在保护神经功能的同时最大限度地切除复发肿瘤才是争论的关键。本研究在此基础上,对复发性脑胶质瘤患者的重复手术治疗方式进行了一些尝试和探索。
近年来,为了指导神经外科医生进行最大程度地安全切除肿瘤,已经开发了多种技术手段。术中唤醒麻醉技术就是其中之一,它通过手术过程中使患者在清醒状态下配合术者完成指令性语言和动作的情况下,获得脑皮层功能区的一种手段,已成为切除脑功能区胶质瘤手术中定位感觉、语言及运动等相关脑功能区的金标准[13-14],是国内外神经外科领域的临床研究热点之一[15]。我们既往研究也将术中唤醒麻醉技术成功用于切除200例颅内病变的手术中[16]。本研究首次将术中唤醒麻醉技术应用到复发性胶质瘤的再次手术中,以期达到在切除肿瘤过程中保护神经功能的目的。结果显示,所有患者均顺利进行手术,术后1周患者的MMSE、KPS评分与术前差异无统计学意义,表明了术中唤醒麻醉技术在复发胶质瘤重复显微手术切除中的价值。
还有术中神经导航、术中电生理、术中超声、术中磁共振、术中肿瘤荧光等技术被广泛用于提高肿瘤的切除程度的研究中[2,17-18]。神经导航融合磁共振血液氧饱和水平监测、DTI和超声等多模态影像是一种方便、有效、无创的对脑功能区定位的方法,可有效的避开功能区,是复发肿瘤手术的支柱,但在第2次手术中,受脑组织结胶质增生和解剖标志的影响,根据单一的影像数据图像定位肿瘤边缘显得更加困难。因此我们在术前将神经导航融合多模态MRI影像资料勾画肿瘤边界与神经传导束之间的位置关系,制定个体化手术方案;术中再依据电生理监测和术中B超准确定位皮层功能区及肿瘤范围,一定程度上弥补了导航产生的漂移。此外,肿瘤荧光技术于2006年在胶质母细胞瘤患者手术中使用被首次发表[19],是荧光引导手术研究的一个突破,提高了肿瘤的切除程度,被列入中国恶性胶质瘤诊断和治疗共识(2015)中[20]。本组20例复发胶质瘤患者在二次手术中均注射了荧光素钠进行肿瘤标记,但由于先前手术和放射治疗的影响,肿瘤周围炎症细胞和反应性胶质细胞的增加,导致荧光强度在第2次手术中不像初次手术那样均匀,术中依据镜下导航的大脑DTI数据和患者遵嘱指令的情况,仍然尽可能做到同样的非荧光切除范围。术后根据3D-Slicer软件进行术前、术后肿瘤体积对比发现,唤醒麻醉组的肿瘤切除程度可达86.6%以上,接近于文献报道的原发性胶质瘤的首次切除程度[21],并且术后无遗留近远期神经功能障碍。同时我们在治疗过程中避免过强或过长时间的皮层电刺激所导致的脑功能区假阳性定位结果,以及与经验丰富的麻醉医师和手术室护理团队的配合,避免了以往文献提到的术中癫痫、脑膨出、寒战等并发症[22]的发生。
本研究的局限性:观察病例数较少,唤醒麻醉组患者的生存时间并未被有效延长,以及缺乏关于每位患者的肿瘤分子特征与复发肿瘤生物学行为之间的相关性。综上所述,本文从复发胶质瘤的手术技术上进行研究,将术中唤醒麻醉与神经导航、术中电生理和术中荧光等多模态影像相结合进行复发胶质瘤的重复手术切除,为保证患者再次手术后的生活质量和延长生存时间提供了一种安全有效的手术策略。