对肿瘤内miR-21表达进行契伦科夫光学成像的新方法:基于HSV1-tk报告基因
2021-07-18张卫善
李 淼,张卫善
西安交通大学第一附属医院1Med-X研究院肿瘤精准治疗研究室,2医学影像科,陕西 西安 710061
微小核糖核酸(microRNA)是一类可互补结合靶基因信使核糖核酸(mRNA)3’-端非翻译区(3’-UTR),继而降解靶基因mRNA或抑制其翻译的内源非编码单链核酸[1-2]。其中miR-21是一种表达于多数实体肿瘤的常见microRNA,是可靠的恶性肿瘤标志物[3],以及反义RNA 干扰抗肿瘤治疗的潜在靶点[4]。目前检测microRNA 常用的Northern 杂交、实时聚合酶链式反应、微阵列等体外方法[5],存在操作复杂、难以观察活细胞内microRNA表达等问题。将分子影像学与报告基因方法相结合,可展示基因的原位表达情况,一定程度上弥补了上述不足[6]。典型的报告基因体系,如I型单纯疱疹病毒胸苷激酶(HSV1-tk)报告基因,结合9-[4-[18F]氟-3-(羟甲基)丁基]鸟嘌呤([18F]FHBG)示踪剂和正电子发生断层成像(PET),已获美国食药监局批准用于临床成像[7]。
已报道的microRNA表达报告基因活体成像策略有[8]:(1)整合原microRNA启动子基因与光学报告基因,构建直接展示相应microRNA表达调控的融合基因,即经典的直接表征策略,仅能反映microRNA表达调控而非实际表达水平[9];(2)新兴的基于纳米材料的核酸杂交活化传感靶向探针,激发光学或磁共振信号的策略,需构建复杂的包装探针,其生物相容性尚不够理想[10];(3)构建含有报告基因与microRNA互补结合靶序列的融合表达载体策略,是目前最常用的策略,可直接响应内源性microRNA的调控效应,且应用不受成像模态的限制[11-12]。有鉴于光学模态在检测便捷性方面相较其他成像模态有明显优势,已广泛应用于报告基因成像,而前述成熟的HSV1-tk/[18F]FHBG体系是基于放射性示踪剂的报告基因体系。为尝试基于单一种类放射性示踪剂实现光学/核素协同成像[13],本研究拟整合策略(3)与HSV1-tk/[18F]FHBG体系,构建通过契伦科夫光学模态对肿瘤细胞内miR-21的表达进行可视化表征的新型报告基因成像方法。
1 材料与方法
1.1 试剂
A549肺癌细胞系(典型培养物保藏中心ATCC);添加了葡萄糖、1%青-链霉素双抗和10%胎牛血清(Gemini)的RPMI-1640培养基(Gibco),Lipofectamine脂质体及配套转染试剂盒、胰酶和乙二胺基四乙酸(EDTA)(Invitrogen);In vivo-jetPEI阳离子聚合物活体转染载体试剂(Polyplus Transfection);阴离子交换树脂/中性氧化铝/十八烷基键合硅胶固相萃取小柱(Sep-Pak Accell QMA/Alumina N/C18 Light;Waters),4,7,13,16,21,24-六氧杂-1,10-二氮杂双环[8,8,8]廿六烷(Kryptofix 2.2.2,K222;Merck),N2-(对甲氧苯基二苯基甲基)-9-[(4-甲苯磺酰基)-3-对甲氧苯基二苯基甲氧基-甲基丁基]鸟嘌呤前体(ABX);无水乙腈、盐酸(HCl)、氢氧化钠(NaOH)均为分析纯(Sigma-Aldrich),乙醇为药典级(Merck)。
1.2 质粒载体构建、转染及细胞培养
PCR扩增HSV1-tk基因并插入pcDNA3.1质粒的XhoI和EcoRI位点,构建转染载体。合成三联miR-21互补结合靶基因(3×miR-21t)序列并退火:有义链5'-GGCCGCTAGCTTATCAGACTGATGTTGATAGCTT ATCAGACTGATGTTGATAGCTTATCAGACTGATG TTGAT-3'及反义链5'-CTAGATCAACATCAGTCT GATAAGCTATCAACATCAGTCTGATAAGCTATCA ACATCAGTCTGATAAGCTAGC-3',然后插入CMVHSV1-tk基因下游3’-UTR区域的KpnI和BamHI位点,构建CMV-HSV1-tk-3×miR-21t报告基因载体(图1)[14]。
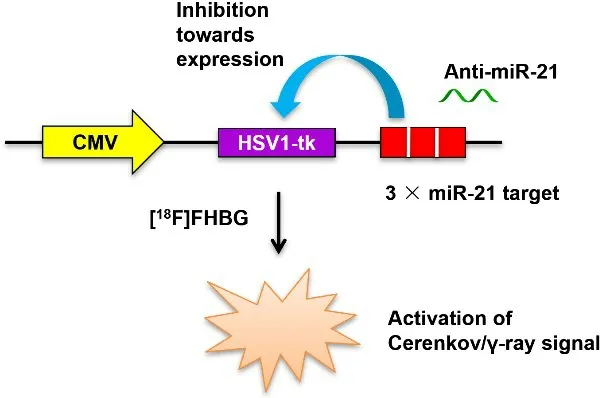
图1 CMV-HSV1-tk-3×miR-21t/[18F]FHBG报告基因成像体系原理示意图.Fig.1 Schematic diagram of the CMV-HSV1-tk-3×miR-21t/[18F]FHBG reporter gene system.
采用上述转染试剂盒将上述报告基因载体瞬转入A549细胞,得稳定表达CMV-HSV1-tk-3×miR-21t报告基因载体的A549细胞(A549T细胞)。所有细胞置于37 ℃、5%CO2环境中培养,至铺满瓶底70%面积时传代。
1.3 [18F]FHBG制备
[18F]F-离子基于PETtrace回旋加速器(GE)通过核反应18O(p,n)18F制备。用能量为16.4 MeV、强度5 mA的质子束流轰击靶水[18O]H2O(纯度97%)30 min。富集靶水中的[18F]F-到QMA柱,用K2CO3(3 mg,0.5 mL水溶液)与K222(15 mg,1 mL 无水乙腈溶液)洗脱收集。[18F]FHBG的标记制备在TRACERLab FXFN自动合成仪(GE)上通过亲核取代反应进行:将[18F]F-加热抽真空共沸,另加无水乙腈同法干燥,加前体(2 mg,0.6 mL无水乙腈溶液),120 ℃反应10 min,冷却后加HCl(1 mol/L,0.5 mL),95 ℃水解5 min,冷却后加NaOH(2 mol/L,0.25 mL)中和,反应体系过Alumina N/C18串联柱,水(5 mL)洗涤C18柱,乙醇(2 mL)洗脱产物,加磷酸盐缓冲生理盐水(PBS)稀释,过滤除菌后立即用于后续实验[15]。
1.4 转染细胞成像及γ计数
将A549T 细胞接种于12 孔板中[(0.31~5)×105/孔],培养12 h贴底。加[18F]FHBG(107kBq/孔)孵育120 min。加4 °C预冷PBS洗3次,0.25%胰酶-0.02%EDTA溶液消化;细胞悬液转入96孔板进行契伦科夫光学成像和γ计数;另将A549T细胞接种于12孔板中(5×105/孔),培养12 h贴底后,采用脂质体2000转染试剂转染反义寡聚miR-21(Anti-miR-21;终浓度25~100 nmol/L),培养24 h;同法加[18F]FHBG成像及γ计数[16]。
契伦科夫成像采用IVIS Spectrum光学成像系统(PerkinElmer)曝光5 min,其余参数为默认值。用Advanced Acquisition and Analysis Tools 软件(PerkinElmer)手动勾划感兴趣区(ROI)并提取发射光强度。采用Wizard 2480自动γ计数器(PerkinElmer)测定γ计数率。
1.5 转染细胞系移植瘤模型成像
所有动物实验操作依照当地官方和作者所在单位的动物福利及研究伦理相关规定设计和执行。移植瘤模型采用4~5周龄无胸腺雌裸鼠(Envigo)构建。接种前将A549T细胞重悬于预冷PBS并与基质胶混合(1∶1,v/v)并置于冰上。细胞悬液注射至右后肢外侧皮下(5×106/只)。卡尺测定移植瘤体直径,待其体积(瘤体积=π×短径2×长径/6)≥200 mm3时,将小鼠分为对照组和实验组,5只/组。实验组采用In vivo-jetPEI 试剂(0.1 mL)与Anti-miR-21(50 mg)混合,于小鼠瘤内注射,对照组小鼠瘤内注射In vivo-jetPEI 试剂与对照RNA 混合物(50 mg)。24 h后,实验组、对照组小鼠分别经尾静脉注射[18F]FHBG(3.7 MBq/300 μL),1 h后以异氟烷吸入法麻醉小鼠;取俯卧位采集契伦科夫光学图像,曝光2 min,其余参数为默认值。
1.6 统计学分析
采用SPSS 22.0软件进行统计分析,定量资料的组间比较均采用Student'st检验,以P<0.05为差异有统计学意义。线性相关回归分析在Prism 8软件(GraphPad)上进行。
2 结果
2.1 细胞数量与成像信号强度的相关性
A549T细胞与[18F]FHBG共孵育后,成像信号强度与细胞数量之间的线性回归分析结果显示,契伦科夫光学图像上显示的信号强度随着细胞数量倍增而同步增强(图2A)。契伦科夫光学信号强度与细胞数量呈现良好的线性正相关(R2=0.9962,图2B)。此外,放射性γ计数率与A549T细胞数量之间也呈现显著的线性正相关(R2=0.9807,图2C)。
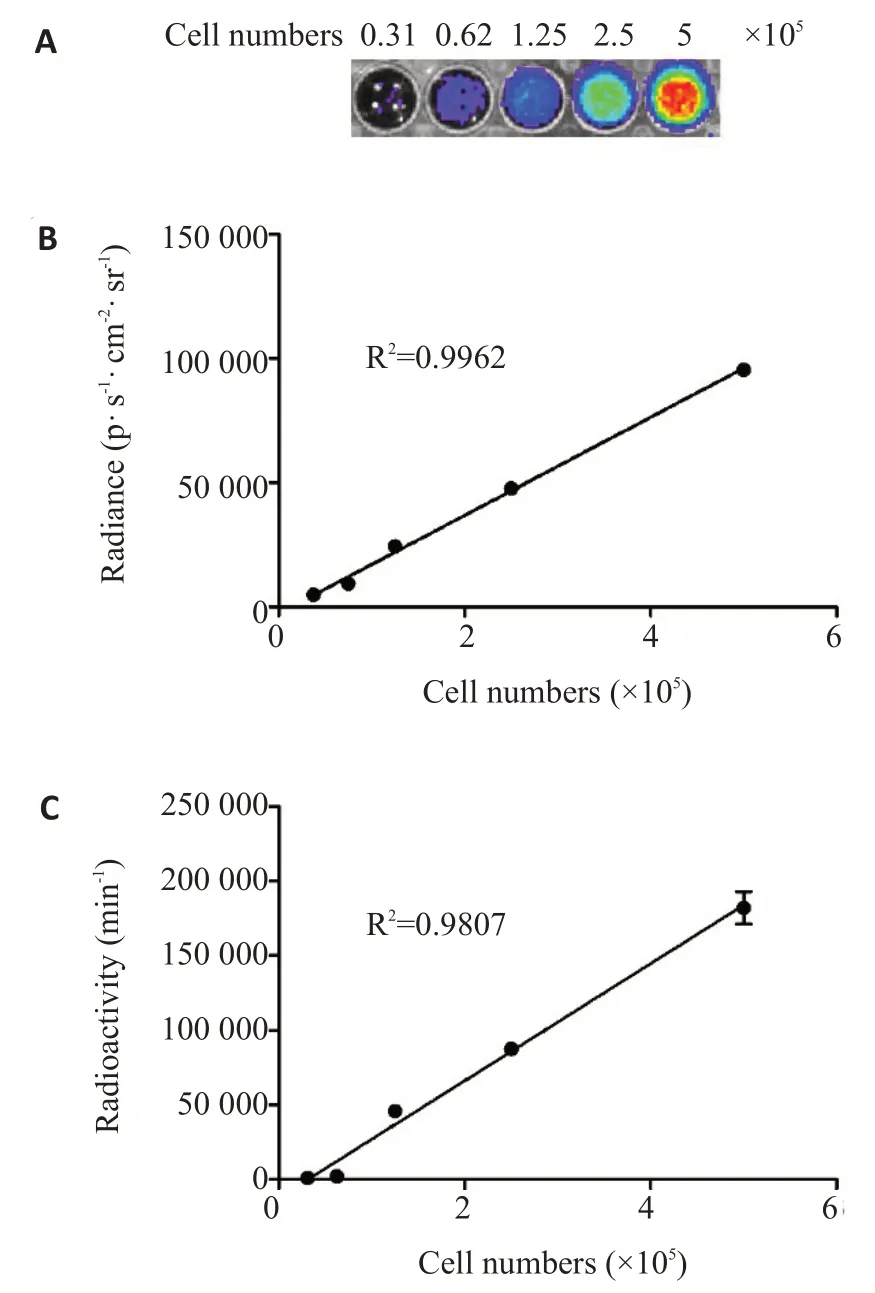
图2 稳定表达报告基因载体的梯度数量A549T细胞与[18F]FHBG共孵育120 min后的成像信号.Fig.2 The signals transmitted by the A549T cells in gratitude number stably expressing the reporter gene vector after the incubation with[18F]FHBG for 120 min.
2.2 反义寡聚miR-21对成像信号的调控作用
经梯度剂量Anti-miR-21 处理的A549T 细胞与[18F]FHBG孵育后的成像信号强度测定结果显示,契伦科夫光学图像上显示的信号强度随着Anti-miR-21浓度倍增而同步增强(图3A);契伦科夫光学信号强度与Anti-miR-21浓度呈现正向剂量依赖关系(图3B)。此外,放射性γ计数率也随着Anti-miR-21浓度倍增而同步上升,呈剂量依赖性正相关(图3C)。

图3 加入梯度剂量反义寡聚miR-21处理的稳定表达报告基因载体的A549T细胞与[18F]FHBG共孵育120 min后的成像信号Fig.3 The signals transmitted by the A549T cells stably expressing the reporter gene vector after the treatment with antisense oligomeric miR-21 in gratitude concentration and the subsqeuent incubation with[18F]FHBG for 120 min.
在瘤内注射Anti-miR-21(实验组)或混合RNA(对照组)的A549T皮下瘤模型(n=5)给药[18F]FHBG后的契伦科夫光学图像中,实验组瘤体轮廓清晰可见;而对照组瘤体轮廓难以与背景组织区分;且上述2组之间移植瘤信号的视觉对比非常明显(图4),在活体水平有效展示了上述报告基因对内源性miR-21抑制HSV1-tk表达活性的响应,以及Anti-miR-21对miR-21功能的序列特异性抑制作用。
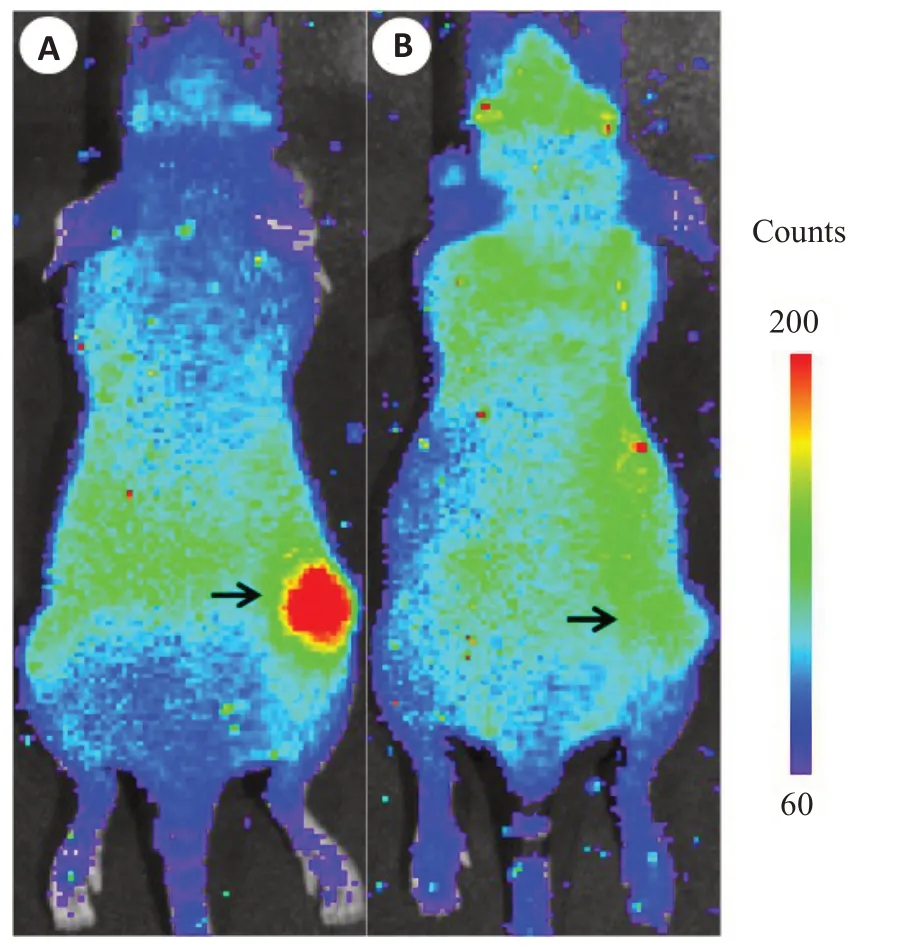
图4 稳定表达报告基因载体的A549T细胞皮下移植瘤模型小鼠在注射[18F]FHBG 2 h后的典型活体契伦科夫光学图像.Fig.4 The typical in vivo Cerenkov images of subcutaneous A549T xenograft model stably expressing the reporter gene vector at 2 h after the injection of[18F]FHBG.
3 讨论
已知在细胞内>60%的mRNA表达可被microRNA调控。就种类而言,microRNA与mRNA之间的调控关系是一个复杂的交叉网络。揭示microRNA的细胞内动态表达模式将有助于阐明microRNA调控的机制,具有重要的研究及临床意义[17]。已知microRNA miR-21在癌症的起始、进展和转移中起关键作用。一些肿瘤类型依赖miR-21的表达以维持其恶性表型[4]。因此对miR-21在肿瘤组织或细胞中的表达进行成像,不仅有望作为肿瘤诊断标志物,也可用于分析相关信号通路和构建miR-21靶向药物研究模型[16]
本研究构建报告基因体系的总体设计原理如下:在HSV1-tk基因下游3’-UTR区域构建三联miR-21靶基因序列(3×miR-21t);3×miR-21t序列可被细胞的内源性miR-21互补结合;当内源性miR-21表达时,miR-21结合3×miR-21t序列,从而抑制HSV1-tk基因表达,即负向调控;外源加入的Anti-miR-21可通过互补配对使miR-21的功能沉默,从而恢复HSV1-tk的表达及其活性,即正向调控;HSV1-tk的磷酸激酶活性可使进入细胞质的[18F]FHBG被磷酸化,无法再转运出胞外,从而蓄积在胞内,并持续发射γ射线和契伦科夫光学信号。
为了验证本文所构建的报告基因成像体系的定量可靠性,本研究分析了A549T细胞与[18F]FHBG共孵育后的成像信号强度与细胞数量之间的线性相关性,结果显示上述报告基因体系的表达及其功能活性是稳定均一的;在不超过5×105细胞的范围内,契伦科夫光学信号强度可准确反映细胞数量。这说明上述报告基因体系具备较好的定量能力。为验证上述报告基因系统的特异性,本研究还测定了经梯度剂量Anti-miR-21处理的A549T细胞与[18F]FHBG孵育后的成像信号强度,结果显示Anti-miR-21确可靶向性地发挥作用,抑制miR-21下调HSV1-tk基因表达的功能。此外,在本研究中还观察到契伦科夫光学定量信号与射线直接定量信号之间能相互匹配。结合活体成像结果可知,上述报告基因体系在契伦科夫光学模态下能特异性地准确表征靶组织肿瘤细胞内microRNA的表达和分布情况。
目前报道最多的miR-21 活体成像策略是基于miR-21 杂交活化激发信号原理的靶向纳米材料探针[18-21]。既往有研究者基于荧光素酶报告基因与miR-21靶序列融合表达载体,利用内源性microRNA发挥小干扰RNA的功能,以下调或关闭报告基因表达,对荷瘤模型鼠进行了生物发光成像,取得了良好效果[22]。而理论上更换其他报告基因类型,应可适用于相应的成像模态。因此在上述经典报告基因成像策略的基础上,本研究选择已广泛用于核素成像的HSV1-tk与[18F]FHBG的组合,尽量利用成熟原理和成像设备,构建了针对miR-21表达的新型报告基因体系,提供了一种对肿瘤细胞内miR-21表达进行便捷、实时、定量可视化的新方法。
据笔者所知,本文是首例基于HSV1-tk/[18F]FHBG激酶报告基因体系,对microRNA的表达进行契伦科夫光学靶向成像的报道。在报告基因成像常用的核素成像、光学成像、磁共振成像这3种模态中,光学模态在空间分辨率、敏感度方面位于中间;虽在组织透射能力、定量准确度方面还不够理想,但在设备成本、操作便捷性方面则优于其他模态。在光学模态中,荧光成像便于多通道检测,但依赖外源激发光,活体组织自发荧光背景干扰较强,不利于负向调控报告基因的信号采集;生物发光无需激发光源,特异性较强,背景对比度较高,但需在成像前给药发光底物(例如荧光素),且敏感度偏低;契伦科夫光学模态最显著的特征是其基于放射性示踪剂,灵敏度高,发射光谱范围宽[23],还可整合光学与核素成像的优势。同其他光学成像模态一样,契伦科夫光学信号的组织透射能力也相对有限,其信号强度会受到组织吸收散射的干扰。本研究所用动物模型的皮下移植瘤属于浅表组织,受到上述影响较小,进行组间的契伦科夫光学信号强度比较尚属可行。
本研究的局限在于:虽初步构建了miR-21特异性报告基因成像体系,但仅进行了契伦科夫光学成像以及γ放射性计数率的测定,及针对miR-21成像的特异性验证,未进行射线信号的直接成像。后续研究中,将构建原位荷瘤及转移瘤动物模型,并进行活体PET/契伦科夫光学成像,评价该报告基因体系用于多模态定量动态成像的性能。
综上所述,本文构建了一种用于对肿瘤内miR-21进行靶向契伦科夫光学成像的新型报告基因体系。该体系有望进一步推广至活体多模态成像应用,为实时、定量表征肿瘤细胞的特定microRNA表达水平、分布及其动力学特征提供了新的方法学思路,并为达成肿瘤的精准诊疗探索了新的技术路径。